不同免疫细胞及PD-1单抗杀伤前列腺癌细胞的初步研究*
王丙萍,段金凯,高艳伟,马虎林,苏日娜,张浩,高维实
010017呼和浩特,内蒙古自治区人民医院 肿瘤研究所(王丙萍),腹部肿瘤外科(高艳伟、马虎林、苏日娜、张浩、高维实);010070呼和浩特,内蒙古建筑职业技术学院 公共课教学部(段金凯)
前列腺癌是目前全世界男性中最常见到的恶性肿瘤之一,发病率在全球男性中位于第二位,癌症死因第五位,并且死亡人数在持续增加[1-2]。在我国,前列腺癌患者的生存情况和预后与发达国家相比还存在一定的差距[3-5]。
过继性免疫治疗是肿瘤免疫疗法的一种,其原理是将人体内的抗肿瘤免疫细胞采集后,经过体外培养扩增后回输患者,以增强人体免疫系统,从而达到抗肿瘤的目的。细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)是经过细胞因子诱导培养而成的一群异质混合型细胞,以T细胞为主,其主要效应细胞是天然杀伤T细胞(natural killer T cells, NKT),兼具有T淋巴细胞强大的抗肿瘤活性和NK细胞的非限制性杀瘤优点。NK细胞(natural killer cells,NK)是大颗粒淋巴细胞,约占人体外周血淋巴细胞总数的10%左右,大部分存在于人的肝脏、脾脏、外周血以及骨髓中,少部分存在于淋巴结中[6]。NK细胞参与天然免疫和适应性免疫,是先天免疫系统中最具杀伤性的细胞毒性淋巴细胞,能够介导强大的抗病毒和抗肿瘤作用[7]。作为人体免疫系统中的第一道防线,NK细胞能够直接杀伤病毒感染细胞和肿瘤细胞,而不需要依赖抗体,也不受主要组织相容性复合体(major histocompatibility complex,MHC)限制,属于非特异性的杀伤作用。
免疫检查点指的是在免疫细胞上表达的一系列分子,它能调节免疫细胞的激活,是人体维持免疫稳态的重要调控机制。目前研究最清楚的免疫检查点有细胞毒T淋巴细胞相关抗原 4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)、程序性死亡受体1(programmed cell death protein 1,PD-1)及其配体(programmed cell death ligand 1,PD-L1)。PD-1发挥作用是在免疫应答的后期,通过影响干扰素γ(interferon-gamma,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)以及白细胞介素2(interleukin-2,IL-2)等细胞因子的分泌进而影响T细胞的增殖。肿瘤的免疫逃逸机制是一个复杂的过程,在这个过程中免疫检查点起到的作用不可忽视,在免疫逃逸过程中肿瘤细胞的表面通常会过度表达免疫检查点分子,使得细胞毒T细胞的活性受到抑制,进而促进肿瘤细胞的增值。
本研究拟通过研究CIK细胞、NK细胞及PD-1单抗+NK细胞对3种前列腺癌细胞系LNCaP、DU145 、PC3的杀伤效率,鉴定其用于后期治疗前列腺癌的可行性,为应用细胞过继回输治疗前列腺癌的研究及临床应用奠定基础。
1 材料与方法
1.1 实验材料
前列腺癌细胞株PC3、LNCaP、DU145购自中国科学院上海细胞所;GT-551培养基为日本TaKaRa公司;VIVOTM15培养基、DMEM高糖培养基、1640培养基、胎牛血清(fetal bovine serum,FBS)、胰酶、磷酸盐缓冲液(PBS)为美国Gibco公司;IFN-γ、IL-1α、IL-2、IL-7、IL-15、IL-18、IL-21、OKT3为美国R&D公司;抗人CD16单克隆抗体为中国北京同立海源生物科技有限公司;PD-1单克隆抗体(nivolumab)为中国大连美仑;Ficoll淋巴细胞分离液为中国TBDTM公司;荧光标记单克隆抗体:CD3-FITC、CD56-PE、鼠抗人IgG-FITC为美国BD公司;CCK8试剂盒为中国博士德生物公司。
1.2 实验仪器
二氧化碳培养箱及生物安全柜(Thermo,美国);倒置荧光显微镜(Leica,德国);FACSCalibur流式细胞仪(BD,美国)高速离心机(Eppendorf,德国);超净工作台(苏州泰安空气技术有限责任公司,中国);ELx808吸收光酶标仪(Biotec,美国)。
1.3 实验方法
1.3.1 前列腺癌细胞株的培养 前列腺癌细胞株的培养液分别为PC3—DMEM-F12,LNCaP—RPMI-1640,DU145—DMEM高糖,FBS浓度均为10%。0.25%胰蛋白酶消化的时间分别是LNCaP、DU145为1 min,PC3为3 min。
1.3.2 外周血单个核细胞(peripheral blood mononuclear cell,PBMCs)分离 Ficoll密度梯度离心法分离PBMCs,收集血浆置于56℃水浴锅内保持30 min,冷却后离心,转移上清保存于4℃备用;将白膜层移出,加入PBS吹打清洗,离心弃上清,VIVOTM15培养基重悬PBMCs细胞,显微计数,取样进行流式检测。
1.3.3 CIK细胞的诱导扩增 培养基为GT-551,调整PBMCs细胞浓度为2×106个/mL第0 d加入IFN-γ 1 000 U/mL,37℃,5%CO2培养箱中培养。第1 d加入100 U/mL的IL-1α,50 μg/mL的CD3单抗(OKT3),300 U/mL的IL-2。此后每隔2 d加入培养基及300 U/mL的IL-2,调整细胞浓度。FITC-CD3和PE-CD56抗体染色,流式细胞仪鉴定CIK细胞。
1.3.4 NK细胞的诱导扩增 调整PBMCs细胞密度为1.5×107个/mL,加入自体血清10%,IL-2 1 000 IU/mL、IL-7 10 ng/mL、IL-15 50 ng/mL、IL-18 10 ng/mL、IL-21 50 ng/mL、OKT3 10 ng/mL和Anti-CD16 10 ng/mL,90% VIVOTM15培养基培养细胞,细胞接种密度≤1.5×107个/mL,密度过大影响NK生长,放入37℃,5%CO2培养箱中培养。每隔2天补液调节细胞的密度为1.0×107个/mL;培养基=90% VIVOTM15培养基+自体血浆10%+IL-2 1 000 IU/mL。14 d后,流式细胞仪检测结果,合格后收获细胞。
1.3.5 流式细胞检测 免疫荧光标记法进行流式细胞分析,取免疫细胞1 mL,PBS洗涤,离心弃液,加入50 μL PBS轻轻悬浮细胞20 μL CD3-FITC和20 μL CD56-PE,4℃避光保存30 min。PBS洗涤后流式细胞仪分析检测,用异硫氰酸标记IgG作为阴性对照,根据流式细胞分析图中CD3+CD56+的百分比确定CIK细胞所占比例以及CD3-CD56+的百分比确定NK细胞所占比例。
1.3.6 CCK-8法检测杀伤效率 分别以CIK细胞、NK细胞、PD-1单抗+NK细胞为效应细胞,靶细胞分别为前列腺癌细胞株LNCaP、DU145、PC3。将3种靶细胞以5×103个/孔 的数量分别接种于96孔板中,于37℃,5% CO2培养箱中培养12 h后弃液。PD-1单抗+NK细胞为效应细胞的处理方式是每106个NK细胞加入PD-1单抗6 μg在培养箱中培育2 h。然后按效靶比0.1∶1、0.5∶1、1∶1、5∶1、10∶1、15∶1、20∶1的比例分别加入效应细胞,同时设置单独靶细胞孔和每种比例的单独效应细胞孔,每个比例3个复孔。共同培养24 h后,加入CCK8 试剂放于37℃,5% CO2培养箱中,孵育3.5 h后用酶标仪测定450 nm波长的OD值,以此方法检测NK细胞的细胞毒活性,公式如下:杀伤率(%)=[1-(实验组OD值-单独效应细胞OD值)/单独靶细胞组OD值]×100%。
1.4 统计学方法
应用SPSS 19.0进行数据统计分析,采用单因素方差分析,在P<0.05时被认为差异具有统计学意义。
2 结 果
2.1 CIK细胞及NK细胞的培养结果
健康人外周血分离PBMCs后,分别经细胞因子诱导扩增CIK细胞及NK细胞。CIK细胞诱导培养结果是第0 d为散落的颗粒状细胞,3~4 d后聚集成团,出现CIK细胞集落(图1A)。培养14 d,经流式细胞仪鉴定(图1B、C),CD3+细胞为85.28%±17.67%,CD3+CD56+细胞为22.02%±2.68%,CD8+CD56+细胞为23.09%±6.85%,确定为CIK细胞。NK细胞诱导培养结果是第0 d为散落的颗粒状细胞,3~4 d后聚集成团,出现细胞集落,培养10~4 d后,细胞重新分散为单个细胞(图1D)。经流式细胞仪鉴定CD3-CD56+细胞(图1E、F),外周血中占比较少的NK细胞,扩增到占比83.20%±8.54%以上,细胞总数扩增倍数为(251.66±19.05)倍,NK细胞扩增倍数为(1 940.17±402.22)倍。

图1 CIK细胞及NK细胞的培养结果
2.2 CIK细胞毒活性的检测
以CIK细胞为效应细胞,靶细胞分别为前列腺癌细胞株LNCaP、DU145、PC3,在不同效靶比的情况下(0.1∶1、0.5∶1、1∶1、5∶1、10∶1、15∶1、20∶1),加入CCK8 试剂,孵育3.5 h后,用酶标仪测定450 nm波长OD值的方法检测NK细胞的细胞毒活性(图2)。通过公式分别计算不同效靶比下CIK对靶细胞PC3、LNCaP、DU145的杀伤率。结果表明(表1),随着效靶比的增高,CIK细胞对靶细胞PC3、LNCaP、DU145的杀伤率也逐步增高。CIK细胞对靶细胞LNCaP在效靶比为20∶1时杀伤率最高(76.34%±4.93%),与效靶比为1∶1、5∶1、10∶1、15∶1的实验组相比杀伤效率逐步增高,各实验组间差异无统计学意义(P>0.05),但与效靶比0.1∶1和0.5∶1实验组相比差异显著(P<0.05);CIK细胞对靶细胞DU145的杀伤率在1∶1、5∶1、10∶1、15∶1、20∶1时逐步增高,在20∶1时杀伤率最高(34.59%±3.51%),各效靶比的杀伤效率差异无统计学意义(P>0.05),但与其它组相比差异显著(P<0.05);CIK细胞对靶细胞PC3的杀伤率在5∶1、10∶1、15∶1、20∶1时逐步增高,在20∶1时杀伤率最高(58.72%±8.08%),无统计学意义(P>0.05),但与其它组相比差异显著(P<0.05);CIK细胞对3种靶细胞的杀伤率差异极显著(P<0.01)。CIK细胞在不同效靶比时对3种靶细胞的杀伤率结果表明,CIK效应细胞在效靶比为10∶1、15∶1、20∶1时,杀伤率逐步增高,各效靶比的杀伤效率差异无统计学意义(P>0.05),但与其它组相比差异显著(P<0.05)。
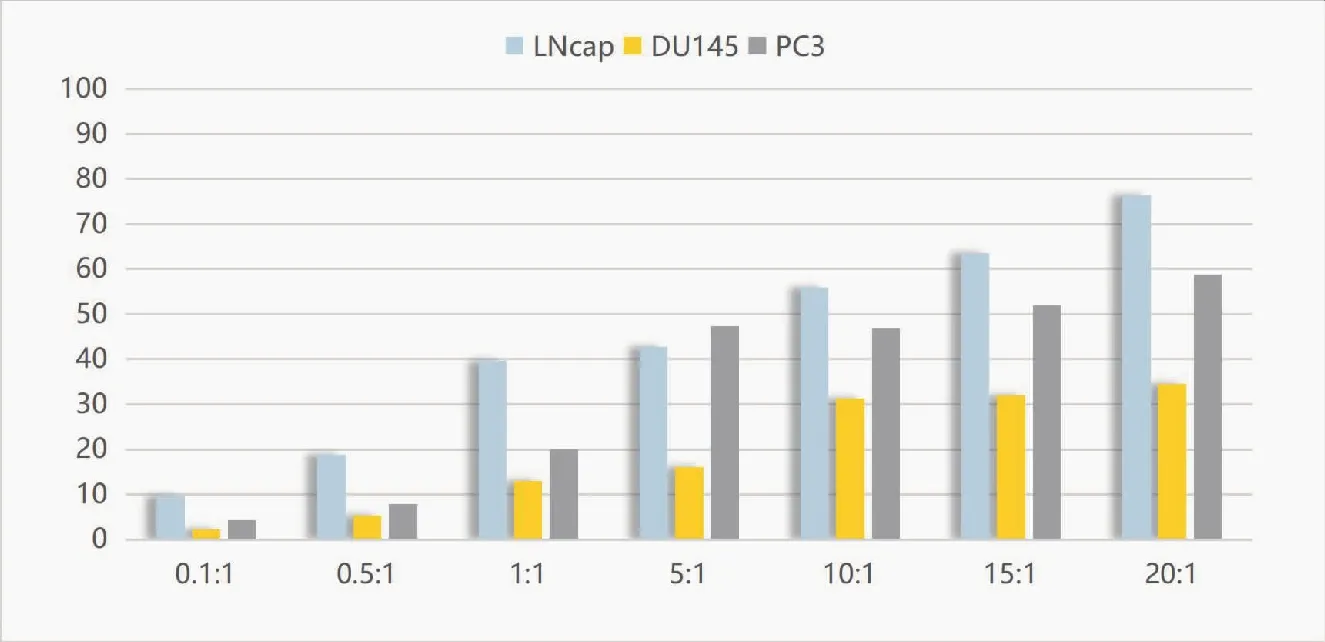
图2 CIK细胞对靶细胞LNCaP、DU145、PC3的杀伤效率(%)
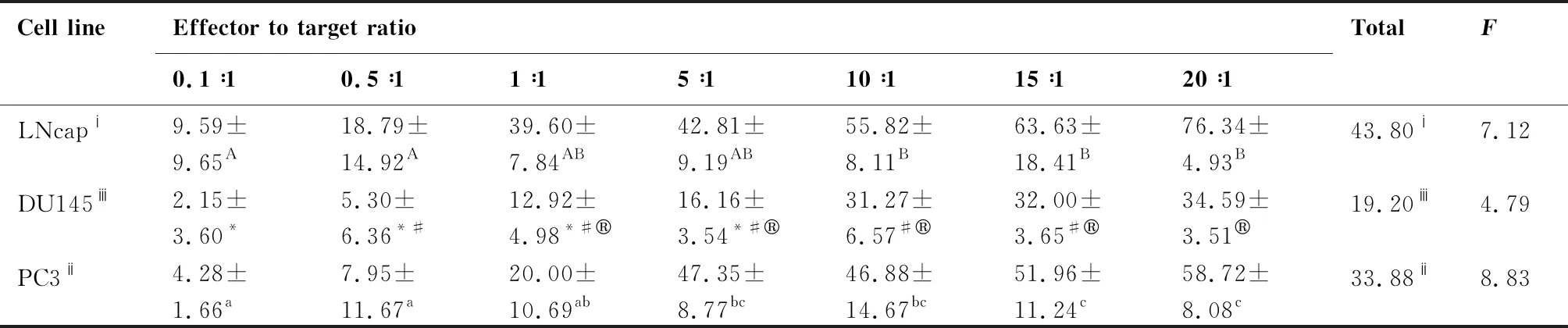
表1 CIK细胞对靶细胞LNCaP、DU145、PC3的杀伤效率(%)
2.3 NK细胞毒活性的检测
通过公式分别计算不同效靶比下NK细胞对靶细胞LNCaP、DU145、PC3的杀伤率。结果表明(表2、图3),NK细胞对靶细胞LNCaP在效靶比为1∶1时杀伤率最高92.03%±9.95%,与效靶比为0.5∶1、5∶1、10∶1、15∶1、20∶1的实验组相比,各实验组间差异无统计学意义(P>0.05),但与效靶比0.1∶1实验组相比差异极显著(P<0.01);NK细胞对靶细胞DU145在效靶比为10∶1时杀伤率最高72.40%±8.30%,与效靶比为5∶1的实验组相比差异无统计学意义(P>0.05),但与其它实验组相比差异显著(P<0.05);NK细胞对靶细胞PC3的杀伤率在除了效靶比为0.1∶1、0.5∶1的实验组外,其余各实验组的杀伤率均为负数,并且各实验组间差异极显著(P<0.01),说明NK细胞对前列腺癌PC3细胞株没有杀伤效果;并且随着效靶比逐步增高,其负数值越大,说明NK细胞对其有促进生长作用。

表2 NK细胞对靶细胞LNCaP、DU145、PC3的杀伤效率(%)
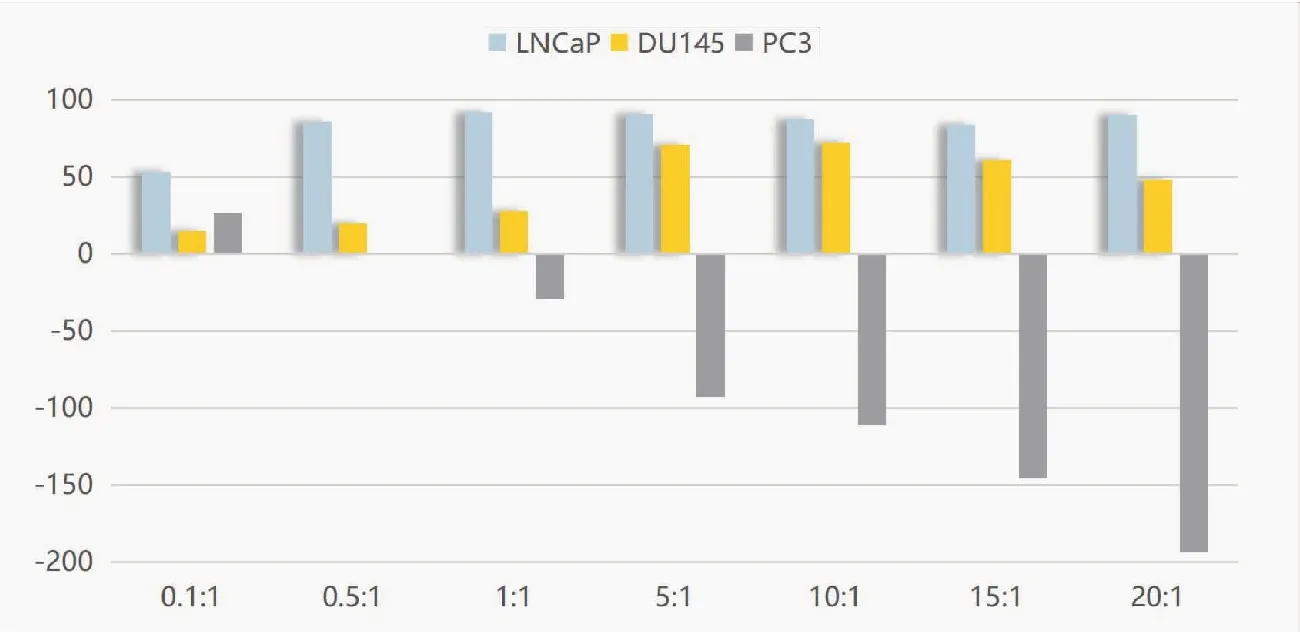
图3 NK细胞对靶细胞LNCaP、DU145、PC3的杀伤效率(%)
2.4 PD-1单抗+NK细胞毒活性检测
通过公式分别计算不同效靶比下NK细胞对靶细胞LNCaP、DU145、PC3的杀伤率。结果表明(表3、图4),PD-1单抗+NK细胞对靶细胞LNCaP在效靶比为15:1时杀伤率最高(96.65%±17.89%),与其它效靶比的实验组相比,各实验组间差异无统计学意义(P>0.05);PD-1单抗+NK细胞对靶细胞DU145在效靶比为10∶1时杀伤率最高(69.64%±13.18%),与效靶比为5∶1、15∶1、20∶1的实验组相比差异无统计学意义(P>0.05),但与其它实验组相比差异显著(P<0.05);PD-1单抗+NK细胞对靶细胞PC3的杀伤率在除了效靶比为0.1∶1、0.5∶1的实验组外,其余各实验组的杀伤率均为负数,并且各实验组间差异显著(P<0.05),说明PD-1单抗+NK细胞对前列腺癌PC3细胞株没有杀伤效果;并且随着效靶比逐步增高,其负数值越大,说明NK细胞对其有促进生长作用。

表3 PD-1单抗+NK细胞对靶细胞LNCaP、DU145、PC3的杀伤效率(%)

图4 PD-1单抗+NK细胞对靶细胞LNCaP、DU145、PC3的杀伤效率(%)
2.5 三种效应组对3种靶细胞最高杀伤效率比较
通过对三种效应组杀伤3种靶细胞最高效率的比较分析(表4、图5),结果表明三种效应组对靶细胞LNCaP的最高杀伤效率之间差异无统计学意义(P>0.05),对靶细胞DU145的最高杀伤效率CIK效应组与NK、PD-1+NK效应组间差异极显著(P<0.01),对靶细胞PC3的最高杀伤效率CIK效应组与NK、PD-1+NK效应组间差异极显著(P<0.01)。三种效应组对3种靶细胞最高杀伤效率各组间相比都差异极显著(P<0.01)。
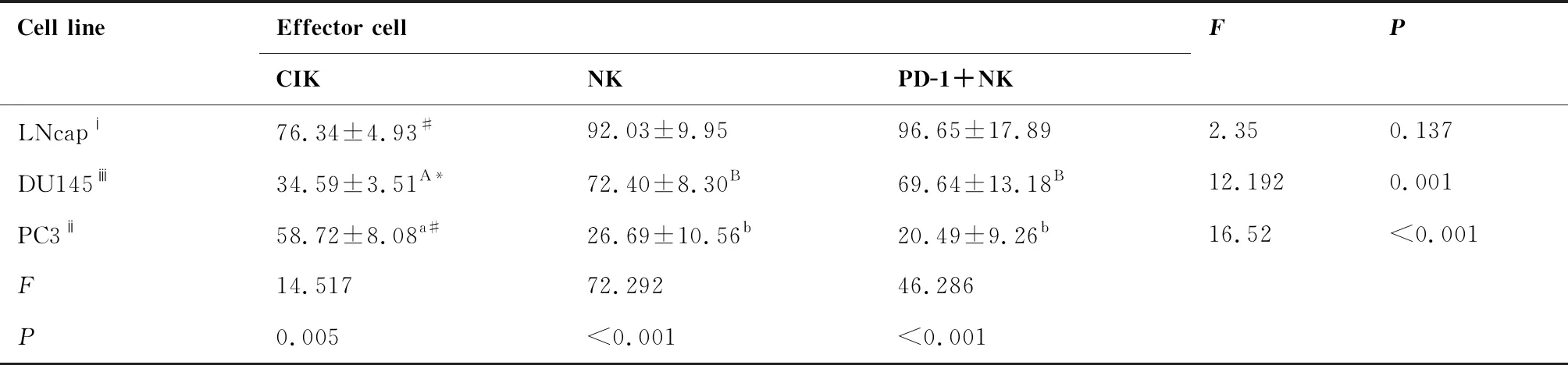
表4 三种效应细胞对靶细胞LNCaP、DU145、 PC3的最高杀伤率比较(%)
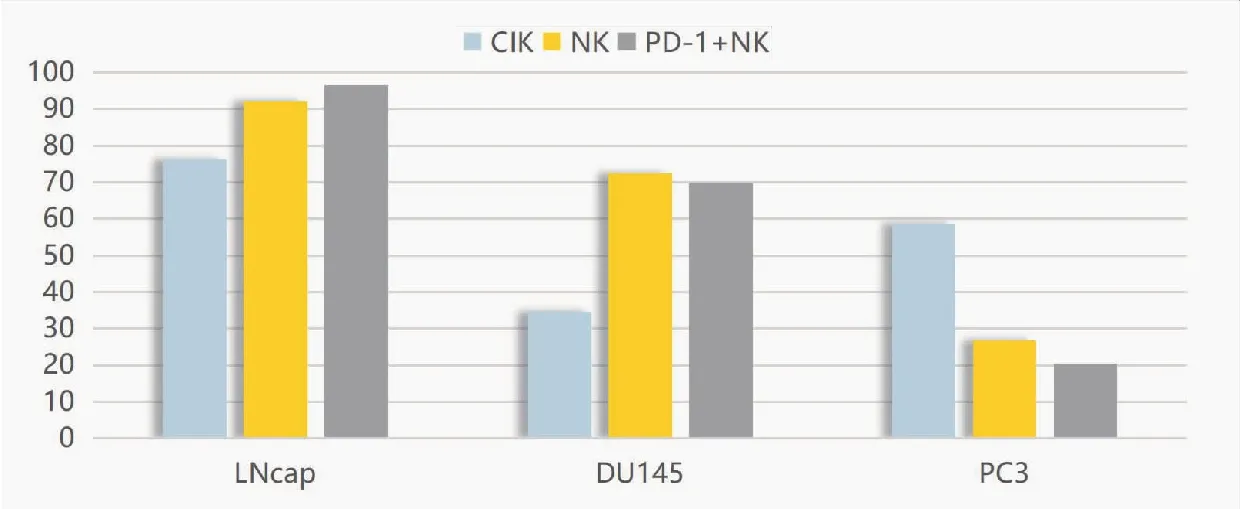
图5 三种效应细胞对靶细胞LNCaP、DU145、 PC3的最高杀伤率比较(%)
3 讨 论
随着经济的发展以及人口寿命增长,我国前列腺癌的发病率近年来已出现逐步升高趋势[8-12]。目前对于前列腺癌的治疗手段主要包括手术治疗、内分泌治疗、放疗以及化疗。而对于晚期和转移性的前列腺癌患者,雄激素剥夺治疗是其主要治疗手段,但这种方法破坏了男性正常的内分泌环境,会引起一定的并发症,且部分患者并发症严重,如果出现疾病进展,患者将失去所有现有治疗手段对生存期的收益。因此,对于这部分前列腺癌患者,急需开发出新的治疗手段,以提高其生活质量、延长生存期。
CIK细胞是近年细胞过继性免疫治疗的主要应用类型,主要是由于其技术操作简便、容易获得,同时成本相对较低,能够降低广大癌症患者的经济负担,使其易于接受;由于CIK细胞是异质混合型细胞,其CD3+CD56+效应细胞纯度有限[13-14],对于治疗时易产生的严重副反应有减轻作用,同时还可以弥补晚期肿瘤患者免疫低下导致的自身免疫细胞弱化的缺点,降低移植物抗宿主病(graft versus host disease,GVHD)发生的风险[15-16]。本研究结果显示,CIK细胞对不同前列腺癌细胞系的杀伤效率差异极显著(P<0.01),说明CIK细胞过继性回输治疗前列腺癌的效果可能与患者所患前列腺癌类型相关。
NK细胞是除T细胞之外的机体抗肿瘤的另一重要利器,其本身具有广谱抗肿瘤的作用,同时还具有强大的间接增强T细胞免疫应答的作用,是T细胞发挥抗肿瘤功能的基础[17]。有研究表明,NK细胞受损和细胞数量的减少,与各类肿瘤的进展都具有相关性,NK细胞过继性回输在晚期非小细胞肺癌的治疗中取得了令人满意的效果[18]。与T细胞相比,NK细胞的过继性回输具有耐受性良好,神经毒性、细胞因子释放综合征和GVHD等严重不良反应的发生率大大降低;同种异体NK细胞的回输还能避免或降低杀伤细胞免疫球蛋白样受体介导的抑制性信号,从而发挥更好的抗肿瘤作用[19-21]。本研究结果显示效应细胞NK对3种靶细胞LNCaP、DU145 、PC3的杀伤率差异极显著(P<0.01);NK细胞对LNCaP的杀伤效率大于对DU145的杀伤效率;对于PC3没有杀伤作用,反而促进其生长。笔者通过对以往研究资料的梳理,发现在生物学特性方面[22],PC3与DU145均为低分化、雄激素非依赖的前列腺癌细胞,均具有转移潜能且缺乏内源性的雄激素受体的表达,均同时表达细胞生长因子CK5和CK8/18;而PC3与LNCaP均表现为上皮细胞特性、高表达E-cadherin、不表达Vimentin。因此,除PC3细胞系不表达野生型P53蛋白,而DU145和LNCaP细胞均可表达野生型P53蛋白外,并没有发现PC3细胞系与另外两株前列腺癌细胞系的不同之处。然而,P53是人体的抑癌基因之一,其突变会导致原有抑癌功能的丧失,同时获得新的致癌功能;有研究证明表达野生型P53的肿瘤细胞对放、化疗的敏感性强于不表达野生型P53的肿瘤细胞[23-24]。这说明本研究中“NK细胞促进PC3细胞系生长”的结果,可能是由PC3细胞系不表达野生型P53蛋白引起的;也可能是由PC3细胞系的特殊性导致的,而这种“特殊性”在目前的研究资料中并没有呈现出来,因此需要后续进行深入研究探索其作用机制。本研究的结果为肿瘤免疫逃逸的研究提出了可能作为目标的研究细胞以及研究方向。
免疫检查点抑制剂的应用为肿瘤患者的治疗带来了新的希望,其作用机制是阻断免疫检查点与其受体的结合,从而解除了肿瘤细胞对T细胞增殖的抑制作用,使得T细胞的抗肿瘤免疫得以激活。目前,关于PD-1/PD-L抑制剂的应用在肾细胞癌、黑色素瘤、膀胱癌、肺癌、霍奇金淋巴瘤和结直肠癌的治疗中取得了十分重大的突破,被美国食品药品监督管理局批准可以应用于临床治疗[25-30]。
研究表明NK细胞也表达PD-1分子,在卵巢癌患者中有一个高表达PD-1的NK细胞亚群,其抗肿瘤能力及增殖能力明显受到了抑制,当使用PD-1抑制剂时,可以部分恢复该NK细胞亚群的功能[31]。在肝癌、食道癌、胃癌及结直肠癌患者的肿瘤浸润NK细胞及外周血NK细胞上PD-1表达增高,并提示与患者的不良预后相关;通过阻断PD-1/PD-L1信号的方法可以使NK细胞的脱颗粒水平和细胞因子水平显著增加,同时能够抑制NK细胞的凋亡[32]。在霍奇金淋巴瘤中,PD-1在CD3-CD56hiNK细胞上的表达明显升高,通过研究发现其与PD-L1+肿瘤相关巨噬细胞的相互作用,介导了肿瘤的免疫逃逸[33]。在多种小鼠肿瘤模型中都发现了阻断PD-1和PD-L1信号可诱导强烈的NK细胞反应,并且证明这种反应是PD-1抑制剂发挥治疗效果所必须的[34]。有研究发现,NK细胞可以分泌FLT3LG细胞因子,其作用是富集刺激性树突状细胞(stimulatory dendritic cells,SDCs)于肿瘤内,而SDCs可以激活细胞毒性T细胞并促进其抗肿瘤免疫反应,因此NK细胞可以促进患者对PD-1抑制剂治疗的反应性。还有研究表明,通过IFN-γ等细胞因子预先激活肿瘤微环境中的STAT1/NK细胞轴,可以增加肿瘤对免疫检查点抑制剂疗法的敏感性[35]。免疫检查点抑制剂与NK细胞联合应用,在治疗白血病和非小细胞肺癌患者时是安全、有效且具有生存益处的[36-37]。以上所有研究都说明,NK细胞在PD-1信号通路阻断疗法中发挥着十分重要的作用。然而本研究结果显示,PD-1单抗与NK细胞联合应用对3种前列腺癌细胞系的杀伤效率与单独NK细胞相比,各组间差异均无统计学意义(P>0.05),提示PD-1单抗与NK细胞联合应用并不能提高NK细胞体外杀伤前列腺癌细胞系的效率。本研究结果表明PD-1单抗可能不适用于前列腺癌的治疗,并且NK细胞过继性回输联合PD-1抑制剂的治疗策略可能并不适用于前列腺癌治疗;但是这个研究结论的确定还有待动物实验的进一步验证。
本研究通过对三种效应组杀伤3种靶细胞最高效率的比较分析,结果表明NK细胞与PD-1单抗+NK细胞效应组间差异无统计学意义且趋势相同,除对靶细胞LNCaP的最高杀伤效率之间差异无统计学意义外,对靶细胞DU145和PC3的最高杀伤效率与CIK细胞效应组之间差异极显著。NK细胞对于靶细胞LNCaP和DU145细胞系的杀伤效率要高于CIK细胞对其杀伤效率;而相较于“NK细胞促进PC3细胞系生长”的结果,CIK细胞对PC3细胞系的杀伤效率最高能达到58.72%±8.08%。这说明在未能明确“NK细胞促进PC3细胞系生长”机制的前提下,CIK细胞可能更适合作为前列腺癌治疗的免疫细胞;或者以NK细胞作为前列腺癌治疗的免疫细胞后,发现不起作用或疾病进展,则应当停止NK细胞治疗或改为CIK细胞治疗。PC3细胞、DU145细胞是激素抵抗性前列腺癌(castration resistant prostate cancer,CRPC),而LNCaP细胞是激素敏感性前列腺癌(metastatic hormone-sensitive prostate cancerm,mHSPC),为什么NK细胞、PD-1+NK对LNCaP的杀伤效果好,而对PC3细胞反而无杀伤力?甚至促进其生长?可能的机制是这种治疗对mHSPC效果好而对于CRPC效果差甚至起到反作用。因此,NK细胞、PD-1+NK细胞过继免疫治疗对于早期的激素敏感性前列腺癌可能有一定的治疗作用,但具体效果仍需进一步研究证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

