解毒化瘀颗粒对肝衰竭的疗效与作用机制研究*
姚元谦,吕建林,毛德文,王光耀,陈玮钰,黄 娴
(1.广西中医药大学研究生院,广西 南宁 530001;2.广西中医药大学第一附属医院,广西 南宁 530023)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)在我国的肝衰竭患者中占有很大的比例,主要与乙型肝炎病毒(HBV)感染相关,常在短时间内发生肝内或肝外多器官衰竭,其病情进展较快,短期病死率极高[1-2]。目前对于ACLF的治疗缺少特效药物。近年来,随着人工肝技术的不断发展及对肝衰竭患者管理认识的加强,一定程度上提高了ACLF的治疗效果,但其预后仍较差。肝移植是目前最有效的治疗措施,但受到肝源及患者经济条件的制约[3-4]。
解毒化瘀颗粒是毛德文教授在“毒邪病因”原理指导下,总结得出治疗肝衰竭的临床经验方,具有解毒祛邪、化瘀消癥之效,全方由茵陈、大黄、白花蛇舌草、赤芍、郁金、石菖蒲组成[5]。前期研究[6]已表明,解毒化瘀颗粒可通过NO-cGMP、NF-κB、c-Met等信号通路治疗肝衰竭,涉及Caspase、TNFR I、Gadd45a、SOCS、TGF-β等作用靶点。本研究基于系统评价和生物信息学方法进一步探讨解毒化瘀颗粒治疗ACLF的临床疗效和作用机制。
1 资料与方法
1.1 文献检索 以“解毒化瘀颗粒”“肝衰竭”“JIEDUHUAYU”“Liver Failure”“Hepatic failure”“Acute-on-chronic liver failure”为检索词,采用主题词加自由词的方式检索PubMed、Web of Science、Cochrane、Embase、SinoMed、CNKI、VIP、WanFang数据库,检索时间为建库至2022年2月。
1.2 纳入标准及排除标准
1.2.1 纳入标准 (1)研究类型:随机对照试验(RCT),文献语种为中文或英文;(2)研究对象:符合《肝衰竭诊治指南》[7]中对ACLF的诊断;(3)干预措施:治疗组需使用解毒化瘀颗粒治疗,允许两组采用同样的常规内科药物治疗;(4)所纳入的文献应含有以下结局指标之一:总有效率、死亡率、MELD评分、血清总胆红素(TBiL)、血清白蛋白(ALB)、血清丙氨酸氨基转移酶(ALT)、凝血酶原活动度(PTA)。
1.2.2 排除标准 (1)非随机对照试验(RCT),包括综述类、回顾性研究、动物研究等;(2)数据重复的研究仅纳入1项;(3)数据无法提取的文献。
1.3 资料提取及质量评价 为确保文献筛选及数据提取录入准确无误,由2名数据员进行交叉核对。提取信息包括:作者及发表年份、试验人数、试验设计、结局指标等。利用改良Jadad量表进行文献质量评估,总分为7分,0~3分为低质量文献,4~7分为高质量文献。
1.4 统计学方法 运用R软件进行数据分析,计数资料采取相对危险度(RR)、计量资料则采用均数差(MD)进行表示,且均选其95%置信区间(CI)进行描述。使用I2定量检验进行异质性分析,当I2≤50%时可采取固定效应模型(FE),反之则采用随机效应模型(RM)进行合并分析。
1.5 解毒化瘀颗粒的化学成分筛选及靶点预测 检索TCMSP(https://tcmsp-e.com/)、SymMap(www.symmap.org)数据库获取各药物的化学成分,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为筛选条件进行收集。通过TCMSP数据库下载各化学成分的mol2格式数据文件,依次上传至PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/)预测各化学成分的潜在作用靶点,并以Norm Fit≥0.5为条件筛选出高概率靶点,然后将各靶点ID上传至UniProt平台(https://www.uniprot.org/)统一转换为GeneSymbol。
1.6 挖掘GEO芯片数据并获取ACLF差异靶点 检索GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)获取GSE139602芯片数据集,下载该芯片的转录组数据及GPL13667注释文件,该组数据包括6个健康肝脏样本及8个ACLF肝脏样本。运用R包“limma”等程序包,对2组样本进行差异分析,其中差异靶点的筛选条件为|lgFC|≥1、P<0.05。使用R包“WGCNA”等程序包进行加权基因共表达网络分析(Weighted correlation network analysis,WGCNA),该方法首先计算出每2个靶点之间的Pearson相关系数,通过加权算法构建一个靶点间的无尺度连接网络,将具有高度协同表达的靶点聚类成模块,然后计算每个模块与ACLF样本、正常样本之间的关联系数,最终筛选出与ACLF显著相关且具有共表达、共调控属性的模块靶点,结合差异分析进一步筛选出其中的差异靶点,这些靶点可能通过协同作用在ACLF复杂的调控机制中起到重要影响。
1.7 获取交集靶点并进行PPI、富集分析 应用R包“Venn”绘制药物靶点、差异靶点及WGCNA显著相关靶点的韦恩图,并映射出三者的交集靶点。将交集靶点提交至STRING平台(https://string-db.org/)获取PPI蛋白互作网络,将该网络数据导入Cytoscape 3.9.0进行拓扑分析。使用R包“clusterProfiler”对交集靶点进行GO、KEGG富集分析。运用Cytoscape软件绘制化学成分-基因靶点-作用通路网络图,并通过网络连接度预测解毒化瘀颗粒治疗ACLF的主要化学成分。
1.8 分子对接验证 选取主要化学成分和核心靶点进行分子对接,从TCMSP数据库下载主要化学成分的MOL2文件,从PDB数据库(https://www.rcsb.org)下载蛋白受体的pdb文件,使用PyMOL软件删除蛋白受体的水分子及配体,运用AutoDock-Tools1.5.6软件将MOL2文件及pdb文件转换为pdbqt文件,并确定蛋白受体的活性口袋,最后通过AutoDock Vina软件进行分子对接。
2 结果
2.1 文献检索结果 共检索获得文献201篇,严格按照纳入与排除标准筛选文献,最终纳入10项[8-17]RCTs进行数据分析。文献筛选过程及文献基本资料见图1、表1。
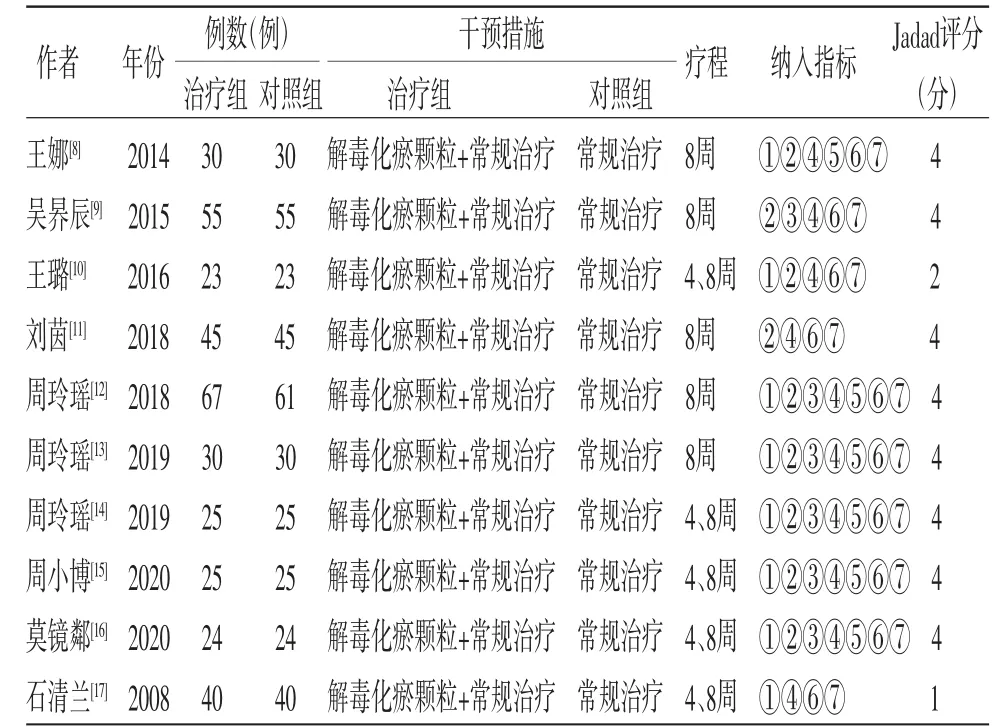
表1 纳入文献的基本资料
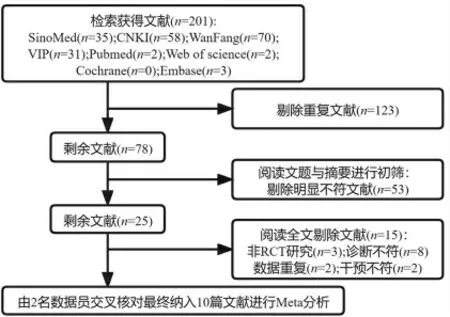
图1 文献筛选流程图
2.2 文献质量评价结果 改良Jadad评分量表评估显示,有8篇文献[8-9,11-16]达到4分,表明分析质量较高。(见表1)有2篇文献[10,17]仅提及随机未描述具体随机方法,其余文献均使用了随机数字表法,除1项文献[17]外,其他文献均报告了死亡病例,其中有4篇文献[10,12-14]描述了因失访或退出造成病例脱落,10篇文献均未提及分配隐藏、盲法等具体内容。利用Cochrane提供的偏倚风险评价工具进行偏倚评估。(见图2)
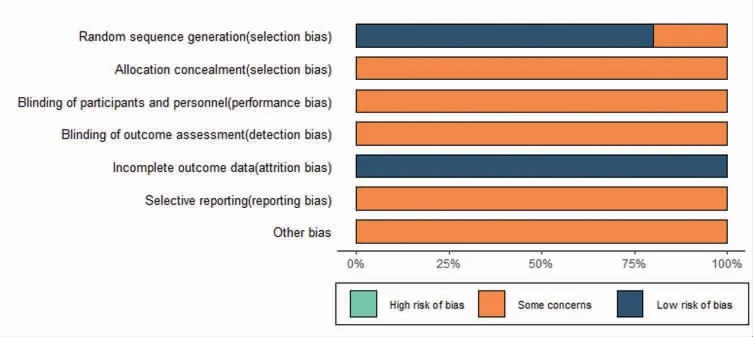
图2 偏倚风险评估图
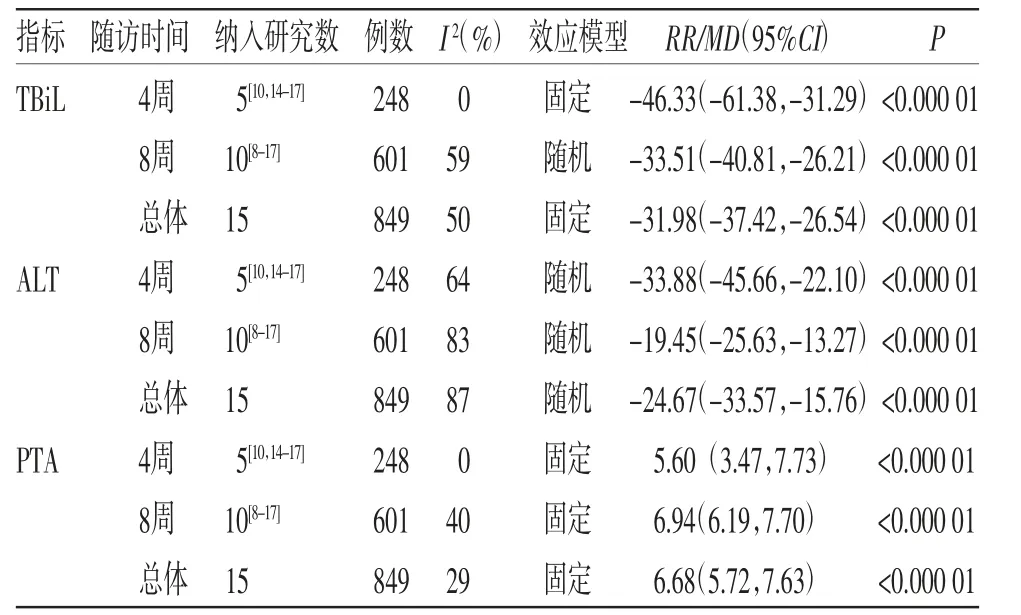
2.3 Meta分析结果 根据随访时间的不同,分成4周和8周两个亚组进行分析。分析结果显示,在总有效率、死亡率、MELD评分、TBiL、ALB、ALT和PTA指标上,治疗组均优于对照组(P<0.05)。在治疗时间方面,总体上第8周的治疗效果优于第4周,表明持续使用解毒化瘀颗粒进行治疗,可使ACLF患者获得更佳的疗效。Meta分析结果见表2。
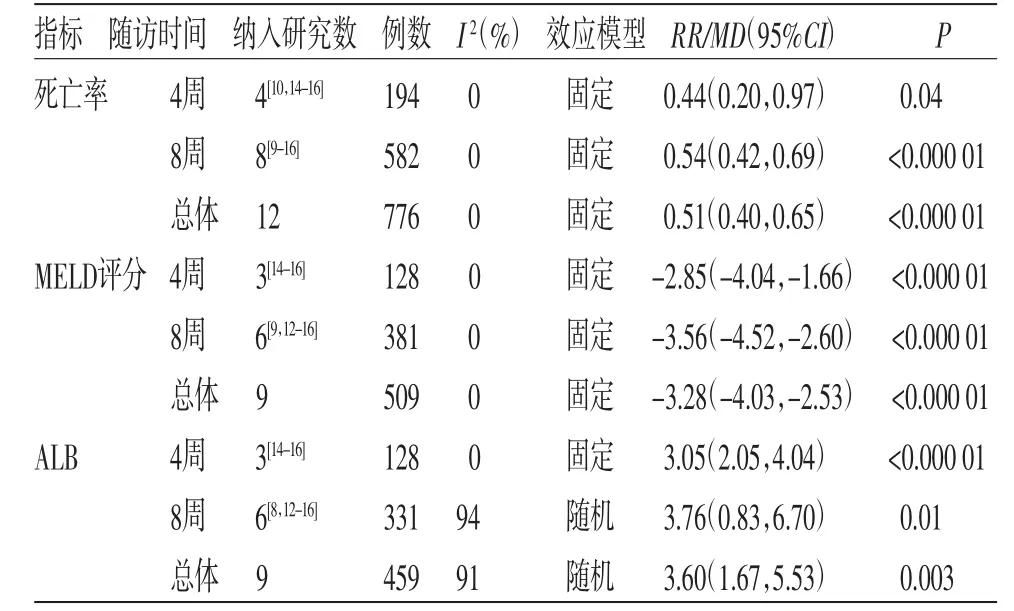
表2 Meta 分析结果
续表2:
2.4 筛选药物靶点和疾病靶点 通过TCMSP、SymMap数据库检索、筛选获得84个化学成分,上传至PharmMapper筛选获得682个药物靶点。对GSE139602芯片数据进行差异分析,筛选获得768个差异靶点,其在ACLF样本中表达上调的靶点有381个、表达下调的靶点有387个。(见图3)通过WGCNA分析,筛选出与正常样本、ACLF样本相关性最高的靶点,图中绿色模块和棕色模块相关性最高,共1 175个靶点。(见图4)
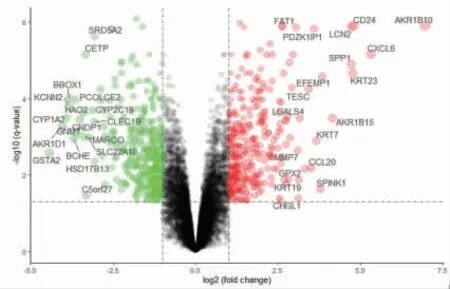
图3 差异分析火山图
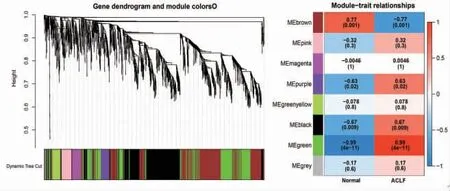
图4 WGCNA 分析
2.5 获取交集靶点及PPI分析 将药物靶点、差异靶点及WGCNA靶点导入R软件,绘制韦恩图,共映射出52个交集靶点。构建交集靶点的蛋白互作网络,进行拓扑分析发现,该网络的核心靶点有CYP3A4、CYP1A2、CYP1A1、ABCG2等。(见图5)
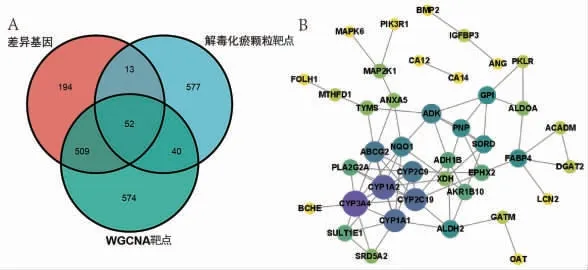
图5 交集靶点分析
2.6 交集靶点富集分析 对52个交集靶点分别进行GO、KEGG富集分析,得到生物学进程(BP)219条,主要包括类固醇代谢、激素代谢、酒精代谢过程等;得到细胞组分(CC)9条,主要包括细胞基质连接、黏着斑、囊泡腔等;得到分子功能(MF)41条,主要包括铁离子结合、四吡咯结合、血红素结合等;得到信号通路19条,主要包括化学致癌作用-受体激活、亚油酸代谢、类固醇激素生物合成、细胞色素P450代谢、花生四烯酸代谢、胆汁代谢通路等。(见图6~7)
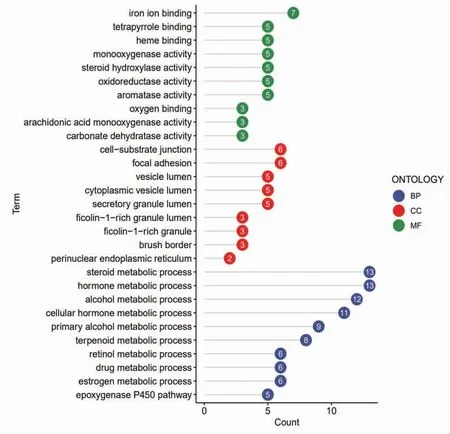
图6 交集靶点GO 富集分析
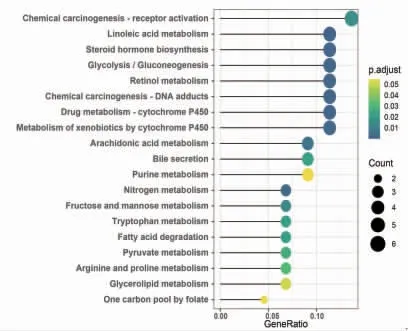
图7 交集靶点KEGG 富集分析
2.7 构建化学成分-靶点-通路网络 为了更清晰地展示解毒化瘀颗粒治疗ACLF的化学成分、交集靶点与作用通路之间的关系,故构建关系网络图。(见图8)通过网络图可直观看出,解毒化瘀颗粒对ACLF具有多途径、多成分的作用机制。根据Degree值,预测其治疗ACLF的主要化学成分。(见表3)
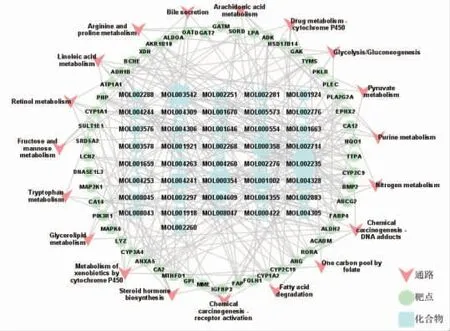
图8 化学成分-靶点-通路图
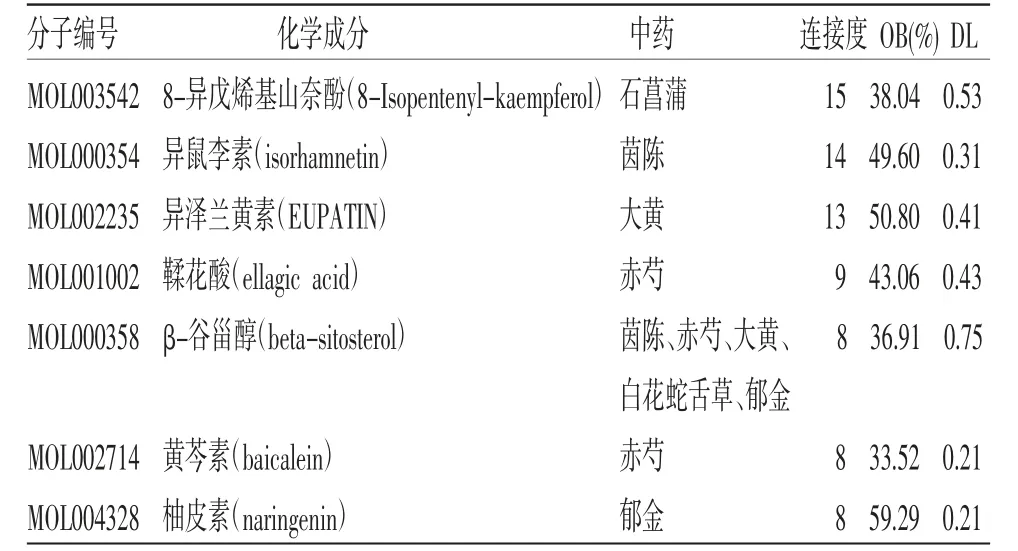
表3 解毒化瘀颗粒治疗ACLF 的主要化学成分
2.8 分子对接验证 选取7个主要化学成分及8个核心靶点进行分子对接,一般认为结合能(Affinity)<-4.25 kcal/mol则配体与靶点受体之间有结合活性,Affinity<-5.0 kcal/mol表明匹配活性较佳,Affinity<-7.0 kcal/mol提示具有较强的对接活性。分子对接结果见图9,56组对接得分均<-5.0 kcal/mol,最低得分为-6.2 kcal/mol(NQO1-β谷甾醇),最高得分为-11.9 kcal/mol(CYP1A1-鞣花酸),平均得分为-8.78 kcal/mol,表明筛选出的靶点与化学成分间具有较好的匹配度。选取部分对接结果进行展示。(见图10)
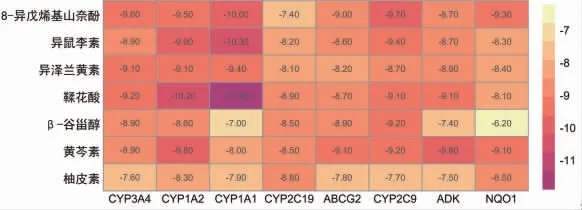
图9 主要化学成分-核心靶点分子对接热图
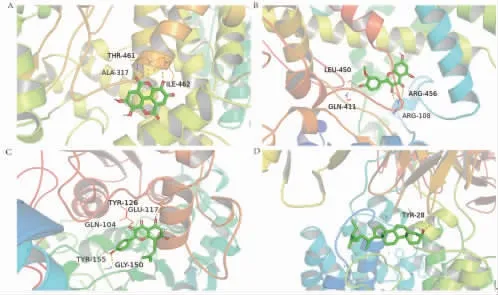
图10 分子对接展示图
3 讨论
中医学将肝衰竭归属于“急黄”“瘟黄”等范畴,病位在肝胆,连及脾肾,病机上多属于正虚邪实[18]。面对ACLF发病机制的复杂性及证候的多变性,中医学从整体出发辨证施治,在常规治疗的基础上,配合中医药治疗,极大程度改善了患者预后,降低了病死率。解毒化瘀颗粒是毛德文教授根据多年临床经验拟定的验方,多项临床研究和基础实验研究表明其能有效干预肝衰竭的进展,如柏文婕等[19]对68例肝衰竭患者加用解毒化瘀颗粒发现,其能够调节肝衰竭患者的免疫功能、减轻肝脏炎症;吕建林等[20]对180只SPF级Wistar大鼠的研究表明,解毒化瘀颗粒可能通过上调Mfn1和Mfn2的表达抑制线粒体分裂,推动线粒体结合,降低碎片化现象,保护线粒体,从而对肝衰竭大鼠发挥保护作用。
本研究对10项RCTs进行Meta分析(共601例患者)发现,加用解毒化瘀颗粒(治疗组)治疗ACLF优于单用西医治疗(对照组)。经过4周、8周的治疗周期后,在总有效率、死亡率、MELD评分、TBiL、ALB、ALT、PTA指标方面,治疗组均优于对照组(P <0.05),如在ALT 指标上,第4 周的分析结果为MD=-33.88,95%CI(-45.66,-22.10),P<0.000 01,第8周的分析结果为MD=-19.45,95%CI(-25.63,-13.27),P<0.000 01。同时可以看出,第8周的治疗效果优于第4周,表明持续使用解毒化瘀颗粒进行治疗,可使ACLF患者获得更佳的疗效。
通过生物信息学进一步分析解毒化瘀颗粒治疗ACLF的作用机制,PPI拓扑分析发现核心靶点主要为细胞色素P450(CYP450)氧化酶家族成员,如CYP3A4、CYP1A2、CYP2C9等,此外还有ABCG2、ADK、NQO1。CYP450酶在药物、类固醇、致癌物及许多化学品的代谢中起到重要作用。临床上90%的药物需经CYP450酶代谢,能力最强的成员为CYP3A4,是人体含量最丰富的肝药酶。其活性被诱导或被抑制会导致某些外源性物质产生肝毒性,从而引起肝损伤,甚至有研究认为该基因的高表达与恶性肿瘤进展有关[22]。醌氧化还原酶(NQO1)在肝细胞内起到抗氧化作用,其表达水平受Nrf2信号通路调控,NQO1的诱导或敲除分别与氧化应激易感性的降低或增加有关[23]。研究发现增强肝衰竭大鼠NQO1等因子的表达,能够缓解细胞炎症反应和细胞凋亡[24]。
对52个交集靶点进行富集分析发现,解毒化瘀颗粒干预ACLF的生物途径主要涉及类固醇代谢、激素代谢、酒精代谢、细胞基质连接、黏着斑、囊泡腔、铁离子结合、四吡咯结合等,而KEGG信号通路主要有化学致癌作用-受体激活、亚油酸代谢、类固醇激素生物合成、细胞色素P450代谢通路、花生四烯酸代谢、胆汁代谢等。亚油酸是不饱和脂肪酸的一种,属于人体必需脂肪酸。它们的衍生物如前列腺素、血栓素和白三烯等,参与炎症和免疫等重要病理过程[25]。研究[26]发现亚油酸可通过抑制肝星状细胞的激活或增殖来改善脂肪肝纤维化。花生四烯酸是生物体内分布最广泛的一种omega-6多不饱和脂肪酸,是许多生物活性物质的直接前体[27];细胞色素P450代谢途径能将花生四烯酸代谢为二十碳三烯酸和类花生酸等;研究表明两者能起到抑制肝脏炎症、减少细胞凋亡、抗肝纤维化的作用[28-29]。
解毒化瘀颗粒中治疗ACLF的主要化学成分有7个,这些化学成分均具有广泛的药理活性,如8-异戊烯基山奈酚有抗氧化、抗肿瘤、抗炎、抗菌等作用[30]。异鼠李素同样有着丰富的药理作用,研究发现其能够有效缓解药物诱导的小鼠肝损伤,且保护作用与其抗炎和抗氧化作用有关,可能是通过调控MAPK/Nrf-2等信号通路发挥作用[31]。亦有研究表明,异鼠李素可抑制肝星状细胞活化并降低细胞外基质的形成和自噬,有显著的抗肝纤维化作用[32]。
综上所述,解毒化瘀颗粒治疗ACLF具有多途径、多成分的作用机制,包括抑制肝脏炎症、抗肝纤维化、减少脂质蓄积、抗氧化、改善肝功能等作用。本研究通过对解毒化瘀颗粒的Meta分析及生物信息学分析表明,其治疗ACLF疗效确切,且具有丰富的作用机制。

