溃结灌肠液Ⅱ改善溃疡性结肠炎菌群结构和炎症机制的网络药理学筛查及实验验证*
陈 鹏,马嘉泽,张加敏,胡俊杰,李万里,程议乐,李晓柳,丁 康
(南京中医药大学附属南京中医院,江苏 南京 210000)
溃疡性结肠炎(ulcerative colitis,UC)是一种发病机制尚不明确的慢性非特异性肠道炎症性疾病,主要临床症状为反复发作或持续的腹泻、腹痛、黏液血便伴里急后重等[1]。由于本病病程迁延难愈,症状反复发作,且目前为止仍无根治的药物和方法,约30%的UC患者需行全结直肠切除术,具有很高的致残率,给患者家庭及社会造成严重的经济压力及医疗负担[2-3]。中医学通过辨证论治、整体观念特色相结合治疗UC,具有疗效确切、作用范围广泛、副作用小等优点,在诱导缓解、防止疾病复发、提高患者生活质量等方面有明显的优势[4-5]。近年来,越来越多的文献开始报道UC与肠道菌群的关系,肠道菌群失衡在UC发生发展过程中的启动和促进作用已达成共识[6]。许多天然药物的化学成分(如酚酸类化合物)均可通过调节肠道菌群、炎症因子缓解UC[7]。研究也发现对不同证型的UC患者辨证使用中药复方均能够有效调节肠道菌群失衡,修复肠道黏膜损伤[8]。
溃结灌肠液是国家级非物质文化遗产“丁氏中医诊疗法”的重要组成部分,作为南京中医药大学附属南京中医院院内中药复方制剂,其疗效确切[9-10]。溃结灌肠液Ⅱ由原方去除轻粉化裁而来,前期的临床研究和基础研究证明该药治疗UC疗效明确,与溃结灌肠液原方相当[11-12]。网络药理学基于系统生物学、基因组学、蛋白组学等学科理论,运用高通量组学数据分析、计算机模拟及网络数据库检索等技术,揭示药物-基因-靶点-疾病相互作用的网络关系,网络药理学的整体性、系统性和综合性与中药多成分、多靶点、整体性的特点具有高度的相似性[13-14]。本研究借助网络药理学筛查溃结灌肠液Ⅱ改善UC菌群结构及炎症的主要成分和靶点,并以小鼠为研究对象,探究溃结灌肠液Ⅱ对葡聚糖硫酸钠盐(DSS)造模小鼠肠道菌群结构和炎症因子的调节作用,从菌群平衡角度阐明其治疗UC的机制及现代生物学内涵。
1 网络药理学筛查溃结灌肠液Ⅱ改善UC菌群结构和炎症的主要活性成分和关键靶点
1.1 溃结灌肠液Ⅱ主要活性成分及作用靶点的搜集和校正利用TCMSP数据库分别收集金银花、地榆、白及、乳香、没药的主要活性成分,以Caco-2细胞渗透性≥-0.4、口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为筛选条件[15-16]。对于人工牛黄、海螵蛸、珍珠粉、煅石膏、煅炉甘石5味动物或矿物类中药,查阅相关文献补充遗漏的有效成分。然后通过TCMSP数据库和PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得其2D分子结构,利用Swiss Target Prediction 平台(http://www.swisstargetprediction.ch/)预测主要化学成分作用的靶点。最后使用Uniprot数据库(https://www.uniprot.org/)进行靶点信息比对和基因名称校正。
1.2 UC的疾病靶点检索和蛋白互相作用网络(protein-protein interaction network,PPI)的构建 利用GeneCards数据库检索UC和肠道菌群失衡相关疾病的靶点。将UC及肠道菌群失衡疾病靶点与药物主要成分作用的靶蛋白取交集,用R软件制作韦恩图。将药物成分-疾病交集基因数据上传至String数据库(https://string-db.org)中构建PPI图。分别导出TSV文件,上传至Cytoscape3.7.1,计算各主要蛋白之间的互作次数,并据此找到关键基因。
1.3 GO功能富集与KEGG通路富集分析 将上述交集基因数据导入Metascape数据库(http://metascape.org)进行GO功能富集分析和KEGG通路富集分析,并利用R软件作图。
1.4 活性成分-靶点-富集通路网络的构建 将溃结灌肠液Ⅱ的主要药物成分、疾病交集基因、富集通路数据导入Cytoscape3.7.1软件,制作“活性成分-靶点-富集通路”网络图,并通过网络拓扑结构分析得出关键化学成分。
2 动物实验验证
2.1 实验动物 36只C57BL/6J雄性小鼠,SPF级,体质量18~22 g,由杭州医学院提供。动物生产许可证号:SCXK(浙)2019-0002。饲养条件:室温(22±2)℃,湿度50%~60%,明暗周期12 h,实验前适应性喂养1周,可自由获取食物和水。实验经南京中医药大学动物实验伦理委员会批准,实验过程中对动物的操作和处理均严格按照南京中医药大学实验动物伦理委员会有关章程进行,伦理批件号:202109A034。
2.2 药物与试剂 葡聚糖硫酸钠盐(dextran sulfate sodium,DSS)(批号:60316ES60)购自翌圣生物科技(上海)股份有限公司;三氯甲烷(氯仿)(批号:10006818)购自国药集团化学试剂有限公司;异丙醇(批号:1011101)购自上海申博化工有限公司;DEPC水(批号:R0021)购自上海碧云天生物技术有限公司;RNA isolater Total RNA Extraction Reagent(批号:R401-01)、HiScript III RT SuperMix for qPCR(批号:R323)均购于南京诺唯赞生物科技股份有限公司。
2.3 主要仪器 KZ-II型高速组织研磨仪(武汉塞维尔生物科技有限公司);Micro 21R型高速冷冻离心机(赛默飞世尔科技有限公司);DM500型光学显微镜(德国徕卡显微系统);CFX Connect荧光定量PCR仪(美国伯乐生命医学产品有限公司)。
2.4 造模与分组 使用DSS诱导构建小鼠UC疾病模型[17]。采用随机数字表法选取10只小鼠作为空白对照组,空白对照组小鼠自由饮水,其余26只小鼠均自由饮用5%葡聚糖硫酸钠盐(DSS)溶液7 d,监测小鼠体质量、粪便状态和便血情况,评估小鼠疾病活动指数(disease activity index,DAI),小鼠出现腹泻、便血、体质量减轻等症状可视为UC急性期模型复制成功。造模死亡小鼠1只,造模成功率96.15%(25/26)。将造模成功小鼠按随机数字表法选取10只小鼠作为给药组,剩余15只小鼠作为模型对照组。
2.5 实验给药 根据非标准体质量动物的校正系数表[18],人与22 g非标准小鼠换算系数约为11.95,折算小鼠溃结灌肠液Ⅱ用量为4.2 g/kg。造模第5天时造模组小鼠体质量明显低于空白对照组(P<0.05),视为UC急性期模型造模成功。从造模第6天起,给药组小鼠给予4.2 g/kg溃结灌肠液Ⅱ灌肠,空白对照组和模型对照组小鼠给予等量生理盐水灌肠,1次/d,连续灌肠5 d。给药期间,模型对照组小鼠死亡2只。
2.6 观察指标
2.6.1 一般情况观察 在整个研究过程中每日观察、记录各组小鼠一般情况及体质量变化,一般情况主要包括精神状态、活动状态、食欲、排便等。
2.6.2 16S rDNA测序分析小鼠肠道菌群变化 研究第11天采用颈椎脱臼法处死各组小鼠,剖腹取出小鼠结肠组织,用直尺测量结肠长度并拍照记录。沿肠道纵行剖开整段结肠,并收取结肠内容物,其余结肠组织冻存于-80 ℃冰箱中。用预冷的生理盐水冲洗结肠,滤纸吸干水分,观察结肠黏膜炎症情况及溃疡数量。挑选病变严重处的溃疡及附近的结肠黏膜组织保存于4%中性甲醛溶液中24 h,然后进行常规脱水、石蜡包埋,制成4 μm厚切片,HE染色固定,显微镜下观察结肠黏膜,并拍照记录。由上海美吉生物医药科技有限公司完成16S rDNA测序分析小鼠肠道菌群,结合测序结果分析找到各组间微生物菌群的差异。
2.6.3 PCR检测肿瘤坏死因子-α(tumor necrosis factor,TNF-α)mRNA及白细胞介素-1β(interleukin-1β,IL-1β)mRNA表达 取小鼠结肠组织适量,加入RNA isolater Total RNA完成匀浆,按说明书提取总RNA。通过分光光度计计算RNA浓度,满意后取样品5 μg,进行反转录合成cDNA。再取待测样品cDNA按说明书配制成总体积为20 μL的PCR反应体系,按95 ℃预变性5 min,进入循环95 ℃变性10 s,58 ℃退火30 s,进行40个循环。以参照基因GAPDH作为标准,采用2-△△Ct法进行相对定量分析,引物序列见表1。
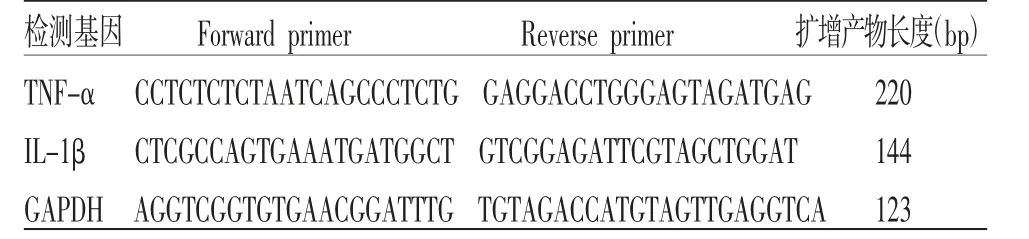
表1 引物序列表
2.6.4 肠道菌群与关键靶点的相关性分析 利用heatmap图通过相关性数值可视化展示菌群与炎症因子之间的关系,评估肠道菌群与关键靶点之间的相关性。
2.7 统计学方法通过Graphpad Prism 8软件进行处理,计量资料以“均数±标准差”表示,符合正态分布者,多组间比较采用单因素方差分析,组间比较采用LSD-t检验,不符合正态分布者,采用秩和检验,对于重复测量的数据,采用重复测量方差分析。以P<0.05为差异有统计学意义。
3 结果
3.1 主要药物成分及其作用靶点 通过TCMSP搜集溃结灌肠液Ⅱ中金银花、地榆、白及、乳香、没药主要化学成分,以OB≥30%,DL≥0.18为筛选条件,获得金银花主要化学成分17个,地榆7个,白及7个,乳香8个,没药43个;通过文献挖掘补充记录海螵蛸[19-20]主要成分17个,珍珠粉[21]主要成分19个,人工牛黄[22]主要成分6个,煅石膏[23]主要成分1个,煅炉甘石[24]主要成分2个。将通过TCMSP、Swiss Target Prediction预测的相关靶点映射到Uniprot进行蛋白标准化命名,最终去重后得到891个靶蛋白。
3.2 蛋白互相作用网络 通过R软件将溃结灌肠液Ⅱ主要成分作用的891个靶蛋白和GeneCards数据库检索的4 837个UC基因、87个肠道菌群失衡基因取交集,得到23个共有靶点。(见图1)将23个共有靶点上传至String数据库进行靶点间的蛋白互作分析,物种选择人类,置信度设定为>0.4,隐藏没有互作关系的靶蛋白,构建PPI图。(见图2)基因蛋白互相作用网络包含23个节点、132条边,平均度值(Degree)为11.5。1个节点Degree代表与该节点相连的边的条数,具体见表2。

图1 溃结灌肠液Ⅱ与UC及肠道菌群失衡基因交集靶点韦恩图
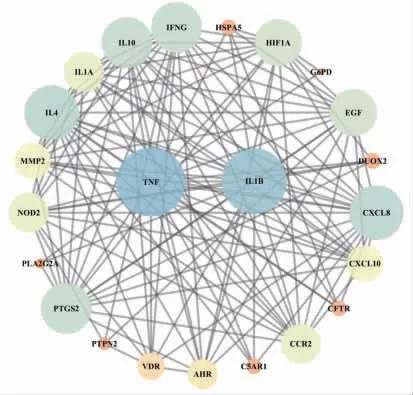
图2 溃结灌肠液Ⅱ与UC 及肠道菌群失衡基因交集靶点PPI 图
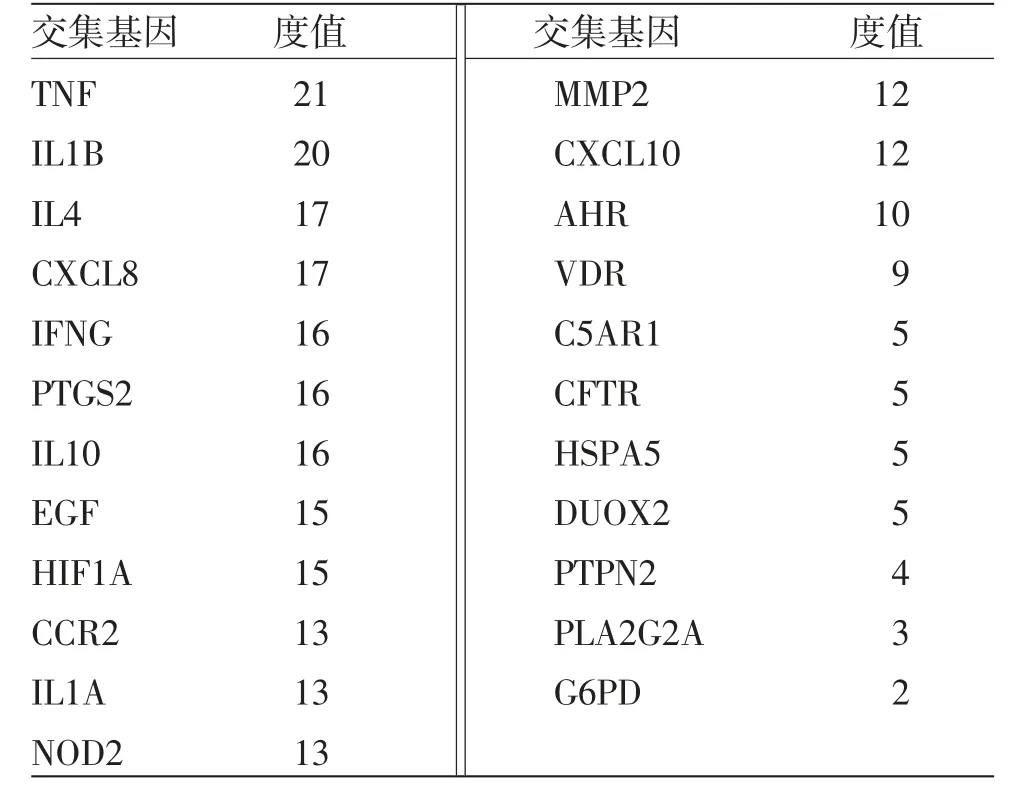
表2 交集靶点度值表
3.3 GO分析和KEGG分析 将上述23个交集基因数据导入Metascape数据库,进行GO功能富集分析和KEGG通路富集分析,并利用R软件作图。(见图3~4)图3中纵轴表示GO名称,横轴表示富集数量,绿色为分子功能,橙色为细胞组分,蓝色为生物过程。在生物过程中,细胞因子产生的正向调节、血管生成的调节、血管发育的调节、炎症反应的调节、对外部刺激反应的正向调节等显著富集;在分子功能中,细胞因子受体结合、受体配体活性、生长因子受体结合、细胞黏附分子结合、抗氧化活性等显著富集;在细胞组分中,膜侧、质膜外侧、内吞囊泡、细胞顶端、转录调节复合物等显著富集。图4中纵轴表示通路名称,横轴表示富集因子,气泡颜色表示富集显著性,气泡大小表示富集数量。通过KEGG分析显示,炎症性肠病、IL-17信号通路、Th17细胞分化、TNF信号通路、NF-κB信号通路、Toll样受体信号通路、C型凝集素受体信号通路、NOD样受体信号通路、趋化因子信号通路、致病性大肠杆菌感染、沙门氏菌感染、志贺氏菌病等显著富集。
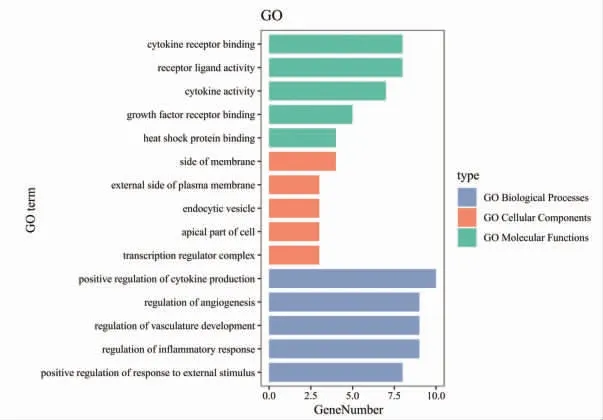
图3 溃结灌肠液Ⅱ与UC及肠道菌群失衡基因交集靶点GO分析
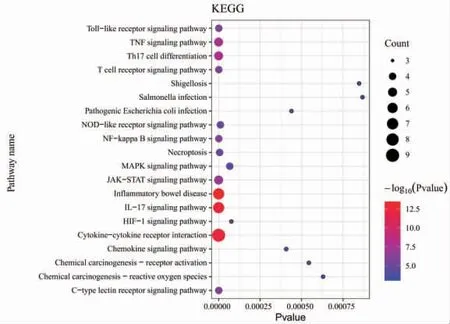
图4 溃结灌肠液Ⅱ与UC 及肠道菌群失衡基因交集靶点KEGG 分析
3.4 活性成分-靶点-富集通路网络 通过Cytoscape3.7.1软件构建活性成分-靶点-富集通路网络,见图5。图中节点的大小表示Degree值。外圈正六边形52个为独有活性成分,内圈正六边形4个为共有化学成分,箭形20个为选取P<0.05的富集通路,菱形23个为共有靶点。网络拓扑结构分析得出各节点Degree值,前5的化学成分为槲皮素(quercetin)、β-谷甾醇(betasitosterol)、山奈酚(kaempferol)、木犀草素(luteolin)、豆甾醇(stigmasterol)。
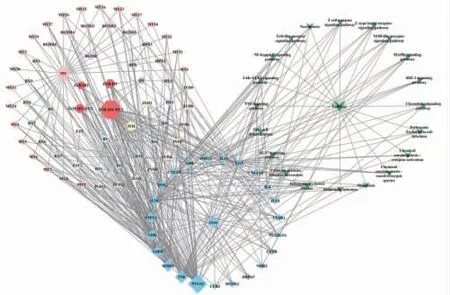
图5 活性成分-靶点-富集通路网络图
3.5 各组小鼠一般情况 实验期间,空白对照组小鼠饮食、大便、精神状态等一般情况均未见明显异常。模型对照组和给药组小鼠均逐渐出现精神萎靡、行动迟缓、腹泻、便血、食欲减退等不适。
3.6 各组小鼠相对体质量比较 以D0时小鼠体质量为基础体质量,相对体质量=当天测量体质量(g)/基础体质量(g)×100。造模前各组小鼠体质量比较,差异均无统计学意义(P>0.05)。造模第5天时造模组小鼠相对体质量明显低于空白对照组(P<0.05),视为UC急性期模型造模成功。空白对照组小鼠在不同时间点相对体质量变化比较,差异无统计学意义(P>0.05),不存在时间效应;模型对照组小鼠在造模开始后体质量持续降低,于造模第10天达到最低值,差异有统计学意义(P<0.05);给药组小鼠在造模第7天前体质量持续下降,差异有统计学意义(P<0.05),造模第7天后体质量逐渐上下波动,存在时间效应。各组小鼠相对体质量总体比较,差异有统计学意义(P<0.05),即存在分组效应;模型对照组小鼠在造模第5天后相对体质量均低于空白对照组(P<0.05);给药组小鼠在造模第8天后相对体质量均高于模型对照组(P<0.05);时间因素与分组因素存在交互效应(P<0.05)。(见表3、图6)
表3 各组小鼠相对体质量比较 (±s)
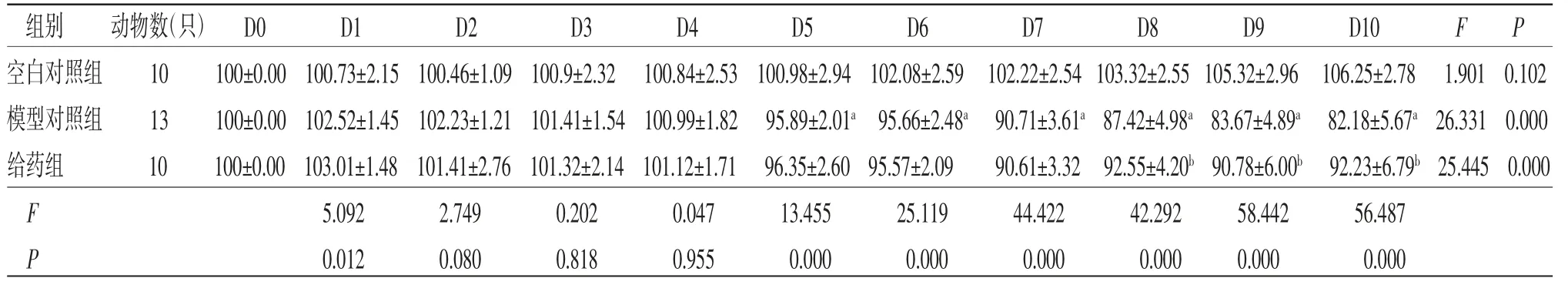
表3 各组小鼠相对体质量比较 (±s)
注:F时间主效应=30.395,P时间主效应=0.000;F分组主效应=36.388,P分组主效应=0.000;F交互效应=7.224,P交互效应=0.000;与空白对照组比较,aP<0.05;与模型对照组比较,bP<0.05
组别动物数(只) D0D1D2D3D4D5D6D7D8D9D10FP空白对照组10100±0.00 100.73±2.15 100.46±1.09 100.9±2.32 100.84±2.53 100.98±2.94 102.08±2.59 102.22±2.54 103.32±2.55 105.32±2.96 106.25±2.78 1.901 0.102模型对照组13100±0.00 102.52±1.45 102.23±1.21 101.41±1.54 100.99±1.82 95.89±2.01a 95.66±2.48a 90.71±3.61a 87.42±4.98a 83.67±4.89a 82.18±5.67a 26.331 0.000给药组10100±0.00 103.01±1.48 101.41±2.76 101.32±2.14 101.12±1.71 96.35±2.60 95.57±2.0990.61±3.32 92.55±4.20b 90.78±6.00b 92.23±6.79b 25.445 0.000 F 5.0922.7490.2020.04713.45525.11944.42242.29258.44256.487 P 0.0120.0800.8180.9550.0000.0000.0000.0000.0000.000
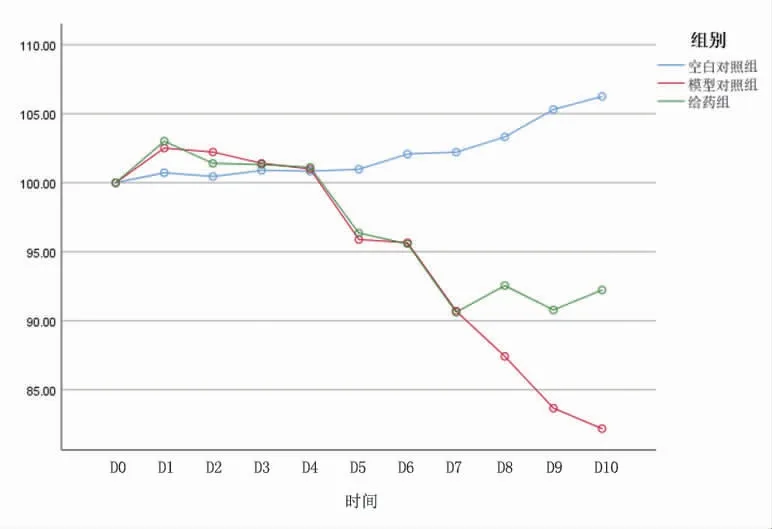
图6 体质量交互效应轮廓图
3.7 各组小鼠结肠长度比较 模型对照组小鼠结肠长度明显短于空白对照组(P<0.05),给药组小鼠结肠长度明显长于模型对照组(P<0.05)。(见图7)
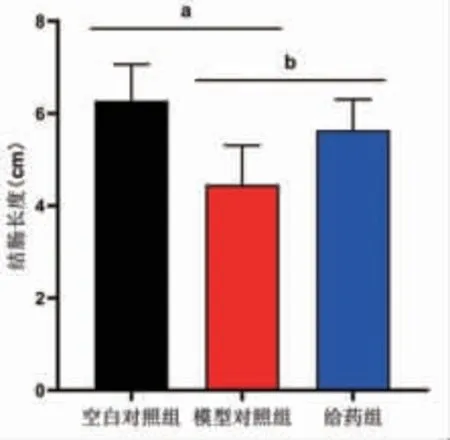
图7 各组小鼠结肠长度比较 (±s)
3.8 各组小鼠结肠组织病理学变化情况 空白对照组小鼠结肠黏膜、腺体及隐窝结构完整,无明显炎症细胞浸润;模型对照组小鼠结肠黏膜损伤明显,未见隐窝,存在大量炎症细胞浸润;给药组小鼠结肠黏膜腺体及隐窝结构清晰,伴少许炎症细胞浸润。(见图8)
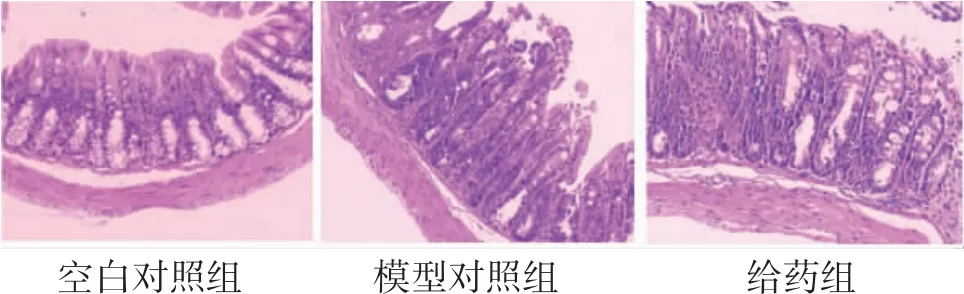
图8 各组小鼠结肠黏膜组织病理改变情况(HE,×40)
3.9 各组小鼠结肠黏膜TNF-α mRNA、IL-1β mRNA相对表达量比较 模型对照组小鼠结肠黏膜TNF-α mRNA、IL-1β mRNA相对表达量均明显高于空白对照组(P<0.05);给药组小鼠结肠黏膜TNF-α mRNA、IL-1β mRNA相对表达量明显低于模型对照组(P<0.05)。(见图9)
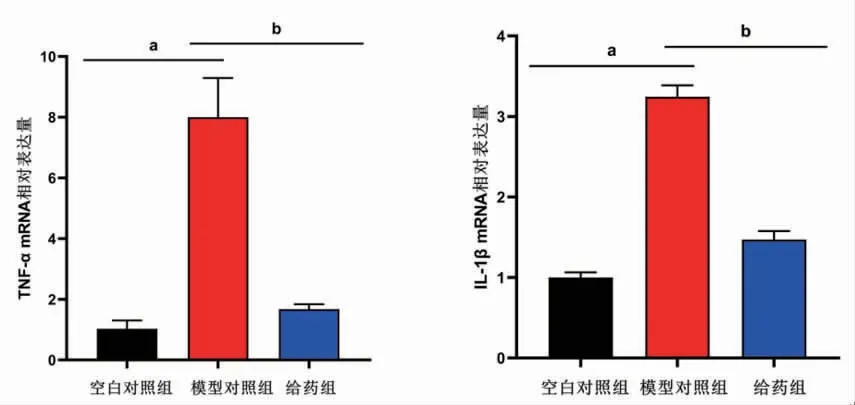
图9 各组小鼠结肠黏膜TNF-α mRNA、IL-1β mRNA相对表达量比较 (±s)
3.10 小鼠肠道菌群变化情况 本研究中18个粪便样本被用于16S rDNA测序,群落组成分析在不同分类学水平上统计各样本的物种丰度,通过群落柱形图直观反映群落组成。由图10可知,门水平下小鼠肠道菌群集中在厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、脱硫杆菌门(Desulfobacterota)、疣微菌门(Verrucomicrobiota)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteriota)。与空白对照组比较,模型对照组变形菌门(0.05%→9.31%)、脱硫杆菌门(0.003%→2.72%)及梭杆菌门(0.00%→2.06%)丰度明显降低(P<0.01);厚壁菌门(75.87%→55.46%)及疣微菌门(2.38%→0.14%)丰度明显升高(P<0.01)。溃结灌肠液Ⅱ干预后,给药组小鼠肠道脱硫杆菌门(2.72%→1.51%)丰度降低,但差异无统计学意义(P>0.05),而变形菌门(9.31%→1.13%)、梭杆菌门(2.06%→0.03%)丰度较模型组明显降低;给药组厚壁菌门(55.46%→68.61%)丰度增高,但差异无统计学意义(P>0.05);给药组疣微菌门(0.14%→0.54%)丰度较模型组明显增高(P<0.05)。(见图11~12)结果提示溃结灌肠液Ⅱ能够逆转DSS诱导的UC小鼠模型肠道菌群结构异常改变。
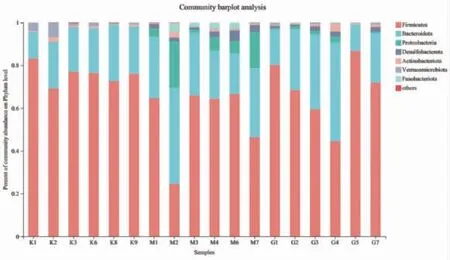
图10 各组小鼠肠道菌群门水平表达水平
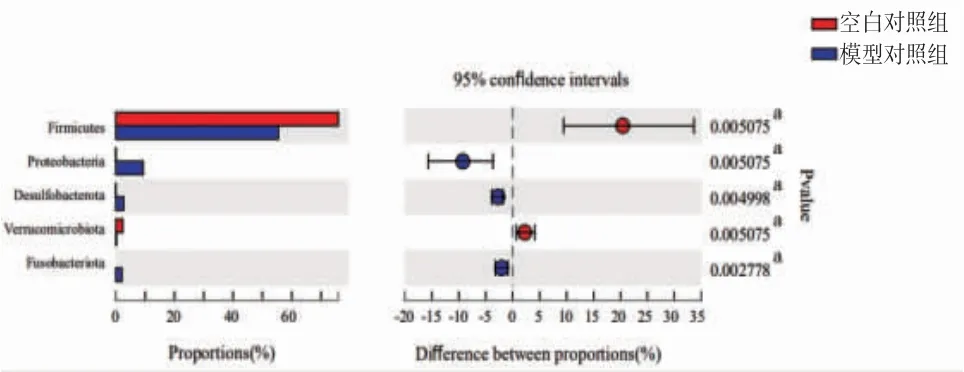
图11 模型对照组和空白对照组小鼠肠道菌群门水平差异表达情况
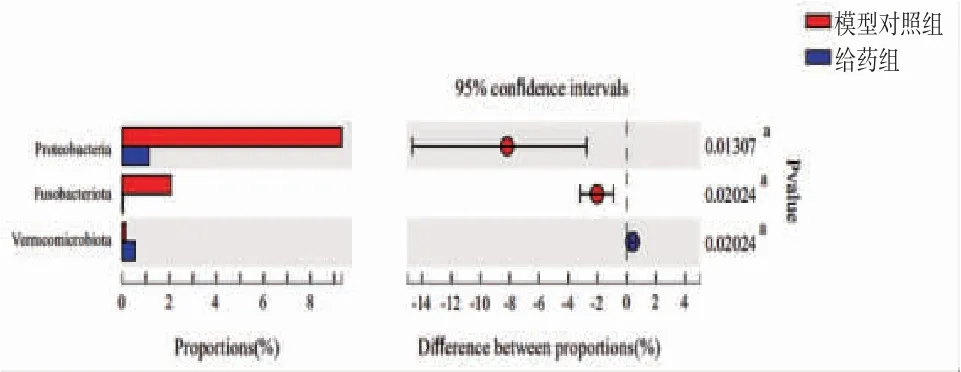
图12 模型对照组和给药组小鼠肠道菌群门水平表达情况
与空白对照组比较,属水平模型对照组小鼠肠道菌群中Clostridium_sensu_stricto_1(8.30%→22.33%)、Alistipe(s1.49%→16.81%)、拟杆菌属(Bacteroides)(2.07%→10.94%)、大肠杆菌-志贺菌属(Escherichia-Shigella)(0.003%→7.49%)、真杆菌属(Eubacterium_fissicatena_group)(0.02%→3.27%)、Romboutsia(0.01%→2.10%)、脱硫弧菌属(Desulfovibrio)(0.003%→2.72%)、梭杆菌属(Fusobacterium)(0%→2.06%)丰度明显升高(P<0.05或P<0.01);螺旋杆菌属(Turicibacter)(19.13%→6.05%)、norank_f__Muribaculaceae(17.06%→0.2%)、乳酸杆菌属(Lactobacillus)(13.87%→2.52%)、norank_f__norank_o__Clostridia_UCG-014(8.56%→0.63%)、瘤胃球菌科未分类属(unclassified_f__Ruminococcaceae)(5.98%→1.10%)、阿克曼菌属(Akkermansia)(2.38%→0.14%)、瘤胃球菌属(Ruminococcus)(1.75%→0.03%)丰度明显降低(P<0.01)。溃结灌肠液Ⅱ干预后,给药组小鼠肠道大肠杆菌-志贺菌属(Escherichia-Shigella)(7.49%→0.37%)、Fusobacterium(2.06%→0.03%)、UCG-005(0.52%→0.26%)、Clostridium_innocuum_group(0.47%→0.06%)、摩根氏菌属(Morganella)(0.21%→0%)丰度明显降低(P<0.01);乳酸杆菌属(Lactobacillus)(2.52%→8.88%)、norank_f_Muribaculaceae(0.2%→3.47%)、瘤胃球菌科未分类属(norank_f__Ruminococcaceae)(0.56%→1.57%)、Colidextribacter(0.41%→1.57%)、阿克曼菌属(Akkermansia)(0.14%→0.54%)、毛螺菌科UCG-006属(Lachnospiraceae_UCG-006)(0.09%→0.26%)、Anaeroplasma(0.02%→0.23%)、unclassified_c__Bacilli(0.05%→0.17%)、norank_f__norank_o_RF39(0.02%→0.18%)、瘤胃球菌属(Ruminococcus)(0.03%→0.16%)丰度明显升高(P<0.05或P<0.01)。(见图13~15)结果提示溃结灌肠液Ⅱ可能是通过增加益生菌乳酸杆菌属(Lactobacillus)、norank_f__Muribaculaceae、阿克曼菌属(Akkermansia)丰度、降低致病菌大肠杆菌-志贺菌属(Escherichia-Shigella)、梭杆菌属(Fusobacterium)丰度发挥治疗作用。
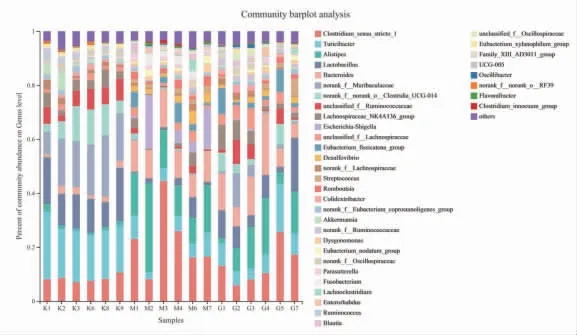
图13 各组小鼠肠道菌群属水平表达情况
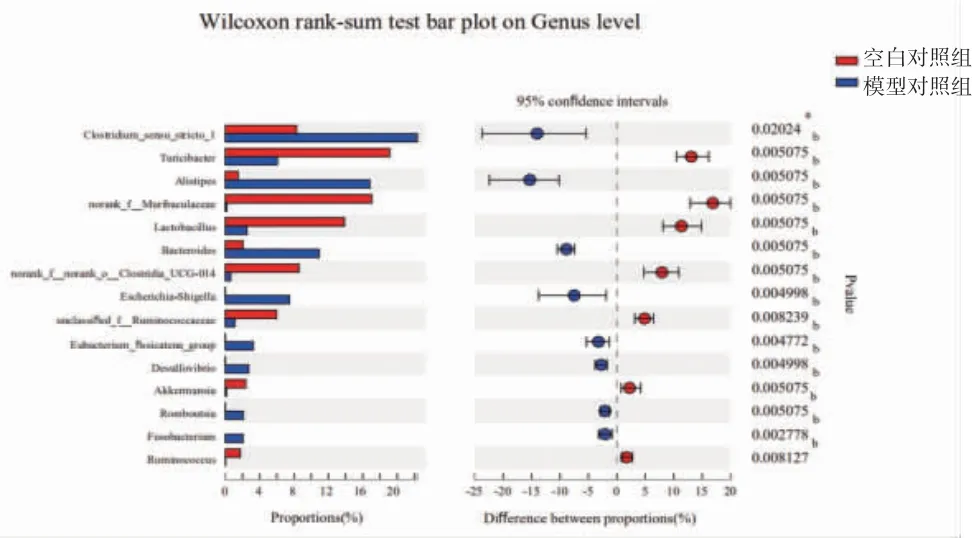
图14 空白对照组和模型对照组小鼠肠道菌群属水平表达情况
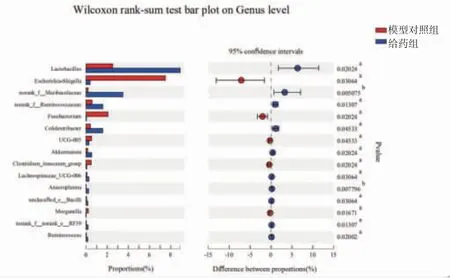
图15 模型对照组和给药组小鼠肠道菌群属水平表达情况
进一步分析乳酸杆菌(Lactobacillus)、norank_f__Muribaculaceae、阿克曼菌属(Akkermansia)、大肠杆菌-志贺菌属(Escherichia-Shigella)、梭杆菌属(Fusobacterium)等在小鼠肠道种水平变化情况,模型对照组小鼠uncultured_bacterium_g__norank_f__Muribaculaceae(17.06%→0.20%)、约氏乳杆菌(Lactobacillus_johnsonii)(10.18%→1.30%)、罗伊氏乳杆菌(Lactobacillus_reuteri(2.01%→0.56%)、阿克曼菌(Akkermansia muciniphila)(2.38%→0.14%)丰度明显降低(P<0.01或P<0.05),大肠杆菌(Escherichia_coli)(0.003%→7.49%)、溃疡梭杆菌(Fusobacterium_ulcerans)(0%→2.06%)丰度明显升高(P<0.01)。溃结灌肠液Ⅱ干预后,给药组小鼠肠道大肠杆菌(Escherichia_coli)(7.49%→0.37%)、溃疡梭杆菌(Fusobacterium_ulcerans)(2.06%→0.03%)丰度明显降低(P<0.05),约氏乳杆菌(Lactobacillus_johnsonii)(1.30%→5.27%)、罗伊氏乳杆菌(Lactobacillus_reuteri)(0.56%→2.14%)、uncultured_bacterium_g__norank_f__Muribaculaceae(0.2%→3.47%)、阿克曼菌(Akkermansia muciniphila)(0.14%→0.54%)丰度明显升高(P<0.05或P<0.01)。(见图16~17)
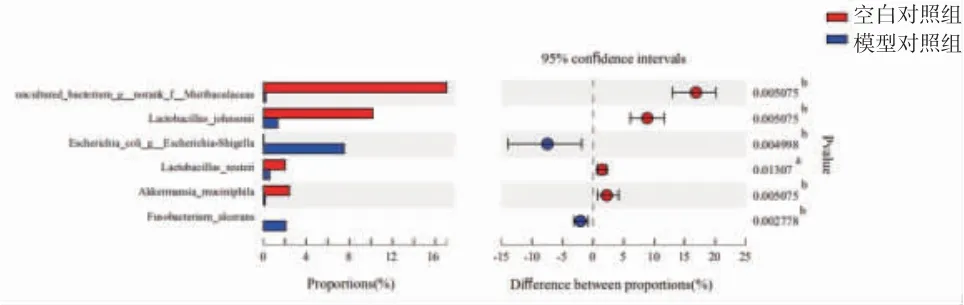
图16 空白对照组和模型对照组小鼠肠道菌群种水平表达情况
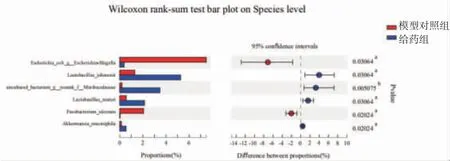
图17 模型对照组和给药组小鼠肠道菌群种水平表达情况
3.11 小鼠肠道菌群与炎症因子TNF-α、IL-1β相关性分析 小鼠肠道菌群在种水平uncultured_bacterium_g_norank_f__Muribaculaceae、约氏乳杆菌(Lactobacillus_johnsonii)、罗伊氏乳杆菌(Lactobacillus_reuteri)、阿克曼菌(Akkermansia muciniphila)等益生菌丰度变化与TNF-α mRNA、IL-1β mRNA表达呈负相关;大肠杆菌(Escherichia_coli)、溃疡梭杆菌(Fusobacterium_ulcerans)等致病菌丰度变化与TNF-αmRNA、IL-1β mRNA表达呈正相关。(见图18)结果提示溃结灌肠液Ⅱ可能是通过增加益生菌uncultured_bacterium_g__norank_f__Muribaculaceae、约氏乳杆菌(Lactobacillus_johnsonii)、罗伊氏乳杆菌(Lactobacillus_reuteri)、阿克曼菌(Akkermansia muciniphila)丰度、降低大肠杆菌(Escherichia_coli)、溃疡梭杆菌(Fusobacterium_ulcerans)丰度,从而抑制TNF-α mRNA、IL-1β mRNA表达来降低炎症反应。
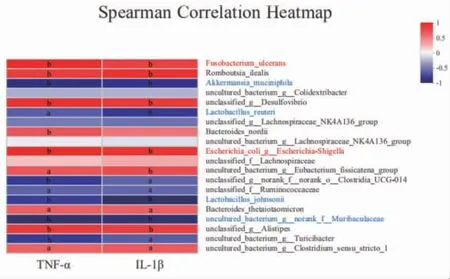
图18 小鼠肠道菌群与关键炎症因子TNF-α、IL-1β相关性分析
4 讨论
中医学并无“溃疡性结肠炎”的病名记载,但其诸多临床症状如腹痛、腹泻、里急后重、黏液脓血便可散见于中医古籍“肠澼”“飧泄”“下利”“痢疾”等疾病的相关论述中。本课题组总结“丁氏中医诊疗法”代表传人丁泽民教授学术思想和丁义江教授临床经验,认为本病病位在大肠,表现为大肠“内疡”[25]。肠道是人体最庞大的微生态系统,健康个体的肠道菌群主要由拟杆菌门、厚壁菌门、放线菌门和变形菌门构成,而环境、饮食及药物等诸多因素都会引起肠道菌群的数量、种类、比例等一系列变化,造成肠道菌群失衡[26]。尽管肠道菌群失衡与UC发病因果关系尚无定论,但肠道菌群失衡是UC的显著特征,主要体现在肠道菌群均度、丰度及多样性的减少。
由于本病发病部位靠近体表,肛门最常受累,外用给药方便,为中药灌肠法提供了便利。中药灌肠法在继承中医传统外治法“导法”和中医特色“辨证论治”思想的基础上,凭借其简效廉及安全性高的特点而应用广泛[27-28]。自1963年施汉章首用《景岳全书》玉关丸保留灌肠治疗慢性溃疡性结肠炎1例,此后中药煎剂灌肠开始普遍用于治疗本病。2017年《溃疡性结肠炎中医诊疗专家共识意见》肯定了中药灌肠法治疗UC的关键作用,并强调无论是直肠型、左半结肠型亦或广泛结肠型UC均可采用中药灌肠治疗。
本研究显示溃结灌肠液Ⅱ主要活性成分127个,改善UC菌群结构及炎症的关键活性成分中槲皮素(quercetin)、山奈酚(kaempferol)、木犀草素(luteolin)为天然黄酮类化合物,β-谷甾醇(beta-sitosterol)、豆甾醇(stigmasterol)为植物甾醇类化合物。HONG Z等[29]实验表明槲皮素能通过减轻氧化应激反应,逆转DSS诱导的肠炎小鼠肠道厚壁菌门的异常减少及变形菌门的异常增加,来发挥保护作用。QU Y F等[30]研究发现山奈酚能通过提高DSS诱导UC模型小鼠肠道厚壁菌门与拟杆菌门的比例,重塑肠道菌群来抑制脂多糖诱导的TLR4-NF-κB信号传导,从而增加紧密蛋白ZO-1、occludin和claudin-1的水平,恢复肠黏膜屏障的完整性。LI B L等[31]报告了木犀草素干预能增加UC大鼠肠道拟杆菌属和芽孢杆菌属丰度,显著缓解结肠损伤,抑制炎症反应。经木犀草素处理后,肠道微生物群的结构和组成也发生了改变。DING K等[32]指出β-谷甾醇能显著上调DSS诱导结肠炎肠上皮细胞多种抗菌肽的表达水平,这些抗菌肽又能够有效抑制炎症反应及伤寒沙门氏菌的生长,且该化合物具有低毒性特征。冯思敏等[33]比较了β-谷甾醇和豆甾醇对小鼠急性结肠炎的治疗效果,发现豆甾醇在缓解症状、抑制炎症方面效果优于β-谷甾醇。
本研究中功能和通路富集分析提示肠道菌群失衡是UC免疫应答异常的关键因素。富含微生物的肠道作为人体最大的内分泌和免疫器官在应激中起着重要的作用,尤其是氧化应激反应[34]。肠道菌群失调的相关疾病也往往与氧化应激有关,肠道菌群的紊乱可能导致肠道活性氧自由基的过度生物利用,产生氧化应激反应[35-36]。在正常情况下,活性氧自由基具有杀菌作用,且参与肠道防御功能。但过量的活性氧自由基会打破机体调节氧化还原平衡的内源性防御系统[37]。另外氧化应激反应还会触发脂质过氧化的链式反应,造成DNA的损伤及蛋白质的异常表达,刺激促炎性细胞因子产生,使结肠炎症损伤不断放大,导致结肠黏膜损害,甚至致癌[38]。活性氧自由基还能够促进跨膜蛋白occludin的酪氨酸磷酸化调节紧密连接的完整性,导致ZO-1的解离,增加肠黏膜屏障细胞旁通透性[39]。肠黏膜机械屏障的损伤使得肠道内的细菌及其代谢产物脂多糖能以跨细胞转运的方式或自由通过细胞间隙的方式越过肠黏膜屏障入侵黏膜固有层,造成细菌移位[40]。细菌移位激活黏膜固有层的中性粒细胞,诱导黏膜发生异常炎症反应,和UC的发生发展关系密切[41]。UC患者肠道有益共生菌的减少和机会致病菌的增多是菌群结构失衡最典型的表现。先天免疫激活过程中,结肠上皮细胞与肠道黏膜中的细菌保持动态平衡的关系。基于细菌抗原的快速识别Toll样受体(Toll-like receptors,TLR)及NOD样受体(NOD-like receptor,NLR),肠道中的细菌能刺激结肠上皮细胞和肠道淋巴组织发生局部和系统免疫应答。在正常的肠道中,调节性T淋巴细胞能对肠道共生菌进行特异地识别并相互作用,从而维持着黏膜免疫的稳态[42]。而募集于肠黏膜的淋巴细胞接受抗原刺激活化后分泌炎症介质,启动炎症反应;另一方面致病菌活跃也会被固有免疫细胞识别、吞噬,诱发效应性T细胞过度增殖,如辅助性T淋巴细胞Th17导致UC肠道黏膜炎症发生介导免疫损伤[43]。
通过对23个靶点的PPI网络进行拓扑分析,TNF、IL-1β等靶点是溃结灌肠液Ⅱ改善UC菌群结构及炎症的关键靶点。TNF是巨噬细胞和单核细胞在急性炎症过程中产生的炎症细胞因子,参与炎症、凋亡、淋巴细胞刺激和免疫细胞功能激活[44]。TNF可能通过活化NF-κB或AP-1转录因子来增强相关靶基因的表达,导致炎症细胞在炎症部位的聚集增多,进而启动细胞毒性、凋亡和急性期反应等过程来介导肠黏膜损伤[45]。目前TNF抑制剂已经广泛应用于炎症性肠病的治疗,与传统药物相比取得了较好的治疗效果[46]。IL-1β在UC受累黏膜中表达显著高于未受累黏膜,且治疗后IL-1β的含量明显下降[47]。IL-1β在受累肠道能够促进抗原提呈细胞的抗原表达,吸引中性粒细胞,引起IL-6、TNF-α等炎症介质释放,使得炎症细胞在受累肠道炎症部位聚集[48-49]。为了验证网络药理学分析结果,本研究采用DSS诱导构建UC小鼠模型。实验结果表明溃结灌肠液Ⅱ能够显著改善小鼠体质量减轻,减轻结肠长度缩短,促进肠黏膜愈合,减少炎症细胞浸润,抑制肠黏膜IL-1β和TNF-α的mRNA表达,提示溃结灌肠液Ⅱ治疗DSS诱导UC模型小鼠疗效显著。
本研究通过16S rDNA测序发现溃结灌肠液Ⅱ能够逆转DSS诱导的UC模型小鼠肠道变形菌门、梭杆菌门及疣微菌门的异常改变,可能是通过增加益生菌约氏乳杆菌(Lactobacillus_johnsonii)、罗伊优化杆菌(Lactobacillus_reuteri)、阿克曼菌曼菌(Akkermansia muciniphila)、uncultured_bacter ium_g_norank_f__Muribaculaceae丰度,降低致病菌大肠杆菌(Escherichia_coli)、溃疡梭杆菌(Fusobacterium_ulcerans)丰度发挥治疗作用。许多研究报告了UC患者和DSS诱导UC模型小鼠肠道菌群厚壁菌门数量减少及变形菌门数量增加的现象,这与我们的研究结果是一致的[50-51]。疣微菌门是1987年首次被发现,至1997年才被划出一门的新细菌;在人类肠道黏液层中,其代表菌为阿克曼菌科阿克曼菌属阿克曼菌(Akkermansia muciniphila,Akk)。Akk菌是疣微菌门的优势菌群,约占83%。进一步分析种水平发现本研究中给药组和模型对照组在门水平的显著差异即是溃结灌肠液Ⅱ干预后小鼠肠道阿克曼菌增长造成的,恰恰也是验证了这一点。QU S W等[52]研究发现阿克曼菌能够通过激活NLRP3缓解DSS诱导的急性结肠炎。乳杆菌属在食物中广泛分布,为一类能够通过发酵产生乳酸的革兰氏阳性菌,包括100多个种和亚种,如罗伊氏乳杆菌、约氏乳杆菌等[53]。本研究中溃结灌肠液Ⅱ能够显著增加小鼠肠道种水平罗伊氏乳杆菌、约氏乳杆菌丰度,这与DONG L等[54]研究结果相同。伊氏乳杆菌及约氏乳杆菌能够抑制促炎基因表达和恢复小鼠肠道微生物群,恢复紧密连接完整性,从而发挥抗炎作用[55-56]。KRISHNA M等[57]发现小鼠母体分娩前及哺乳期补充罗伊氏乳杆菌和约氏乳杆菌可改变小鼠肠道微生物群,并保护雌性后代免受实验性结肠炎的影响,为围产期利用益生菌对抗UC的发展潜力奠定了基础。Muribaculaceae在维持肠黏液层屏障功能中具有积极作用[58]。大肠杆菌属志贺氏菌属主要通过破坏肠黏膜通透性,增加出血发挥致病作用。本研究中DSS诱导UC小鼠模型肠道中大肠杆菌属-志贺氏菌属大肠杆菌丰度显著增加。大肠杆菌能够在易感宿主的肠道中长期定殖,分泌α-溶血素促进UC的发展,引发树突状细胞的死亡,刺激促炎细胞因子TNF-α、IL-6和IL-23的表达,损伤紧密连接蛋白occludin,破坏Caco-2细胞中的紧密连接,增加屏障通透性[59]。梭杆菌属定殖于人体口腔和肠黏膜,具有侵袭、黏附及促炎的致病特性,与UC及UC相关的结直肠癌发生发展密切相关[60]。DUBROVSKY A等[61]从热带地区患者溃疡中分离出了梭杆菌属溃疡梭杆菌,本研究取得了和DUBROVSKY A等[61]类似的结果,溃疡梭杆菌在UC患者肠道中显著增加,而饮食干预或药物干预能够降低溃疡梭杆菌丰度,提示溃疡梭杆菌可作为治疗UC的潜在靶点。
综上所述,溃结灌肠液Ⅱ治疗UC疗效显著,可能通过增加益生菌约氏乳杆菌(Lactobacillus_johnsonii)、罗伊氏乳杆菌(Lactobacillus_reuteri)、阿克曼菌(Akkermansia muciniphila)、uncultured_bacterium_g__norank_f__Muribaculaceae丰度,减少致病菌大肠杆菌(Escherichia_coli)、溃疡梭杆菌(Fusobacterium_ulcerans)丰度,抑制TNF-α mRNA、IL-1β mRNA表达来降低肠道炎症反应。

