4种酰胺类合成大麻素在人肝微粒体中Ⅰ相代谢规律研究
刘生凤 ,张 岚 ,刘书丞 ,侯臣之 ,徐 鹏 ,狄 斌 **
(1中国药科大学药物分析系,南京 210009;2国家禁毒委员会办公室-中国药科大学禁毒关键技术联合实验室,南京 210009;3公安部禁毒情报技术中心,毒品监测管控与禁毒关键技术公安部重点实验室,北京 100193)
合成大麻素是最常见的非法制造、贩卖及滥用的一类新精神活性物质,主要以电子烟、草药混合物等形式出现,可作用于中枢神经大麻素受体CB1和/或CB2,因此也被称为合成大麻素受体激动剂[1-3]。合成大麻素的药理作用与四氢大麻酚(Δ9-THC,传统大麻毒品的主要有效成分)相似,然而滥用合成大麻素更易产生严重的不良反应,包括癫痫发作、胃肠道反应、心脏毒性甚至死亡等[4-6]。为逃避管制,合成大麻素迅速更新变种,自2008年检测到第一代萘甲酰吲哚类JWH-018 以来,合成大麻素迄今已发展至第8 代吲哚/吲唑酰胺类合成大麻素,2021 年7 月起,我国已整类列管合成大麻素以加强立法监管[7-8]。
由于合成大麻素进入人体后广泛代谢,尿液中几乎无原型,因而针对毒品原型的检测方法极易导致该类毒品无法被检出,造成假阴性的结果[9]。在现阶段禁毒工作中,亟需通过推断新型酰胺类合成大麻素的代谢过程确定代谢标志物,为建立尿液和污水等生物样品中该类毒品的检验方法提供依据。虽然许多国内外学者已针对个别合成大麻素体内外代谢情况开展了深入研究,但合成大麻素结构类似、变异迅速,也应该研究合成大麻素类毒品的代谢规律,给潜在的新型合成大麻素代谢提供一定的参考[10-12]。2020年,苏格兰监狱和国内案件中相继出现3 种新型酰胺类合成大麻素N-(1-乙氧基羰基-2-甲基丙基)-1-(5-氟戊基)吲哚-3-甲酰胺(5F-EMB-PICA)、N-(1-氨基-3,3-二甲基-1-氧代丁烷-2-基)-1-(4-戊烯-1-基)-1H-吲唑-3-甲酰胺(ADB-4en-PINACA)和 2-[1-(4-氟丁基)-1H-吲哚-3-甲酰氨基]-3,3-二甲基丁酸甲酯(4FMDMB-BUTICA),目前国内外对其代谢产物少有研究,各仅有一篇利用斑马鱼或人肝细胞实验模型研究其代谢产物[13-17]。2016年,1-(4-氰基丁基)-N-(1-甲基-1-苯乙基)-1H-吲唑-3-甲酰胺(4CN-CUMYL-BUTINACA)在土耳其查获的香草药中首次被检测到,目前发现有滥用的趋势,然而国内尚未报道关于此物质的代谢研究[18-21]。
人肝微粒体体外温孵法可以模拟人体代谢过程,目前已应用于医药学领域,具有简便、快捷等优点,在法庭科学领域对新型毒品代谢物的研究方面也具有很好的应用推广前景。本研究结合人肝微粒体体外温孵法,借助超高效液相色谱-高分辨质谱联用技术检测ADB-4en-PINACA、4CNCUMYL-BUTINACA、5F-EMB-PICA 和 4F-MDMBBUTICA 酰胺类合成大麻素(结构式见图1)在人肝微粒体中的Ⅰ相代谢物,并推断其Ⅰ相代谢途径,总结4种酰胺类合成大麻素代谢规律,以期对潜在的新型酰胺类合成大麻素代谢研究提供一定的参考,为建立生物样品中该类物质的检验方法提供相关代谢研究数据。
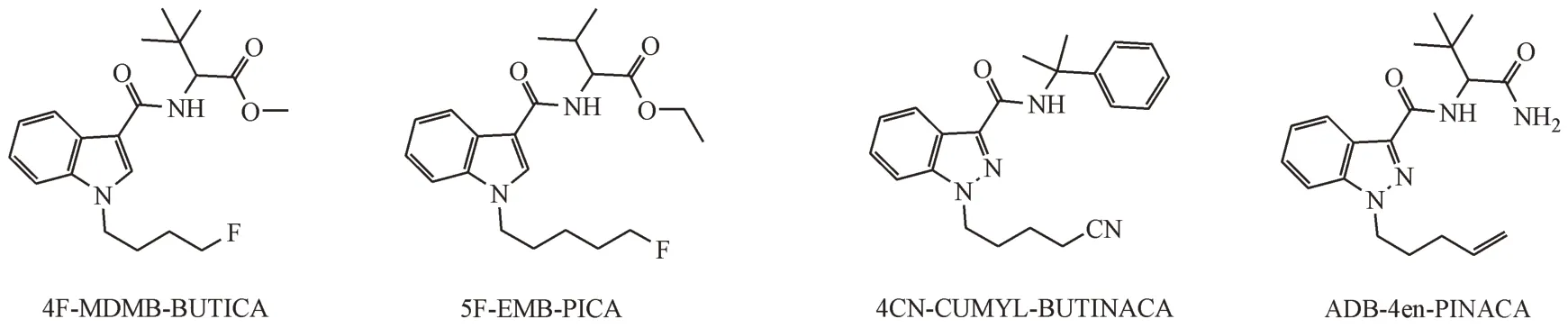
Figure 1 Structures of four amide synthetic cannabinoids4F-MDMB-BUTICA: Methyl (S)-2-(1-(4-fluorobutyl)-1H-indole-3-carboxamido)-3, 3-dimethylbutanoate; 5F-EMB-PICA: N-[[1-(5-fluoropentyl)-1H-indol-3-yl]carbonyl]-L-valine,ethyl ester;4CN-CUMYL-BUTINACA:1-(4-cyanobutyl)-N-(1-methyl-1-phenylethyl)-1H-indazole-3-carboxamide;ADB-4en-PINACA:N-(1-amino-3,3-dimethyl-1-oxobutan-2-yl)-1-(pent-4-en-1-yl)-1H-indazole-3-carboxamide
1 方 法
1.1 试 剂
ADB-4en-PINACA、4CN-CUMYL-BUTINACA、5F-EMB-PICA 和 4F-MDMB-BUTICA 标准品(公安部禁毒情报技术中心提供)。甲醇、乙腈(色谱纯,美国Fisher公司);甲酸、浓盐酸(分析纯,南京化学试剂股份有限公司)。男性蒙古人种(混合)人肝微粒体(LM-R-02M)[20 mg/mL,RILD 瑞德肝脏疾病研究(上海)有限公司];还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)(德国Roche Diagnostics GmbH公司);三羟甲基氨基甲烷(Tris)(分析纯,国药集团化学试剂有限公司);六水合氯化镁(MgCl2·6H2O)(分析纯,西陇化工股份有限公司);去离子水由实验室制备。
1.2 仪 器
LC-30AD 超高效液相色谱串联9030 四极杆-飞行时间质谱联用仪(日本Shimadzu 公司);Auto Science MTN-2800D氮吹仪(天津Auto Science仪器有限公司);D34135R 低温冷冻离心机(瑞士Bio Tool公司);实验室超纯水系统(南京妙之仪电子科技有限公司);XPR10 百万分之一天平(瑞士Mettler Toledo公司)。
1.3 分析条件
Waters Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7µm),柱温40 ℃;流量0.3 mL/min;进样量10µL;检测波长254 nm。流动相:A 为0.1%甲酸水溶液,B 为乙腈;梯度洗脱程序如下(A∶B):0 min(90∶10)→1 min(90∶10)→17 min(30∶70)→22 min(0∶100)→23 min(0∶100)→23.1 min(90∶10)→26 min(90∶10)。
ESI 电喷雾离子源;正离子模式;毛细管电压为3.5 kV;雾化器气体(N2)流速为3 L/min;加热气体(N2)流速为10 L/min;干燥气体(N2)流速为10 L/min;接口温度为300 ℃;DL 温度为250 ℃;加热块温度为400 ℃。各待测物通过正离子全扫描模式,扫描范围:100~1 000 m/z;进一步选取特定质荷比(m/z)的离子作为目标物进行二级子离子扫描,碰撞能量为10~40 eV。
1.4 体外人肝微粒体孵育条件
孵育体系总体积200µL,包含50 mmol/L Tris-HCl 缓冲溶液(pH 7.4),6 mmol/L MgCl2,1 mg/mL肝微粒体,10 µg/mL 合成大麻素(除ADB-4en-PINACA 质量浓度为5µg/mL),温孵体系中有机溶剂的含量小于总体积的1%,以保证混合人肝微粒体蛋白酶的活性(n = 3)。于37 ℃、150 r/min 预孵育5 min,加入NADPH溶液(终浓度0.50 mmol/L)启动反应,分别于10 min、60 min、3 h加入等体积冰乙腈200µL终止反应,剧烈振荡5 min。将混合人肝微粒体体外温孵所得混合溶液在4 ℃、13 000 r/min条件下离心 10 min,取上清液 300 µL 在 40 ℃条件下用N2吹干。再用0.1%甲酸水-乙腈溶液(50∶50)120 µL 复溶,涡旋振荡5 min,复溶溶液在4 ℃、13 000 r/min 条件下离心10 min,取上清液立即进样分析,采用Lab Solution 工作站对样品进行数据采集并分析。
将空白溶剂和未加底物的孵育反应系统溶液作为阴性对照1 和2 同时进行分析;同时将加入高温灭活的人肝微粒蛋白的反应体系(37 ℃,摇床振荡3 h)作为阴性对照3 以确证底物孵育过程中没有产生降解。
2 结 果
2.1 4种酰胺类合成大麻素代谢率分析
5F-EMB-PICA、ADB-4en-PINACA、4CN-CUMYL-BUTINACA 和 4F-MDMB-BUTICA 对 照 品 的液相色谱保留时间分别为16.07、14.29、15.33 和15.33 min。图2 汇总了4 种合成大麻素液相色谱图,其中每张小图均叠加了阴性对照和人肝微粒体孵育10 min、60 min、3 h 的液相色谱图(其中底物已用红色方框标记)。从图2 可以得出,人肝微粒体孵育后底物色谱峰明显下降,且产生了一些新的色谱峰相对于阴性对照,说明4种酰胺类合成大麻素发生了代谢,从而可进一步筛选并鉴定可能的代谢产物。
以阴性对照(0 min)中底物色谱峰峰面积为参照,分别用 10 min、60 min、3 h 的底物峰面积与之相比计算底物剩余百分比(n=3,图3)。60 min 时ADB-4en-PINACA、5F-EMB-PICA、4CN-CUMYLBUTINACA 和4F-MDMB-BUTICA 底物剩余百分比均小于50%,分别为42.68%、1.98%、17.14%和25.94%;3 h 时 ADB-4en-PINACA、5F-EMB-PICA、4CN-CUMYL-BUTINACA 和 4F-MDMB-BUTICA 底物剩余百分比均小于20%,分别为19.13%、0.59%、13.25%和12.36%。结果显示,4种合成大麻素在人肝微粒体中稳定性较低,代谢迅速,3 h近乎代谢完全。
2.2 4 种酰胺类合成大麻素在人肝微粒体中Ⅰ相代谢分析
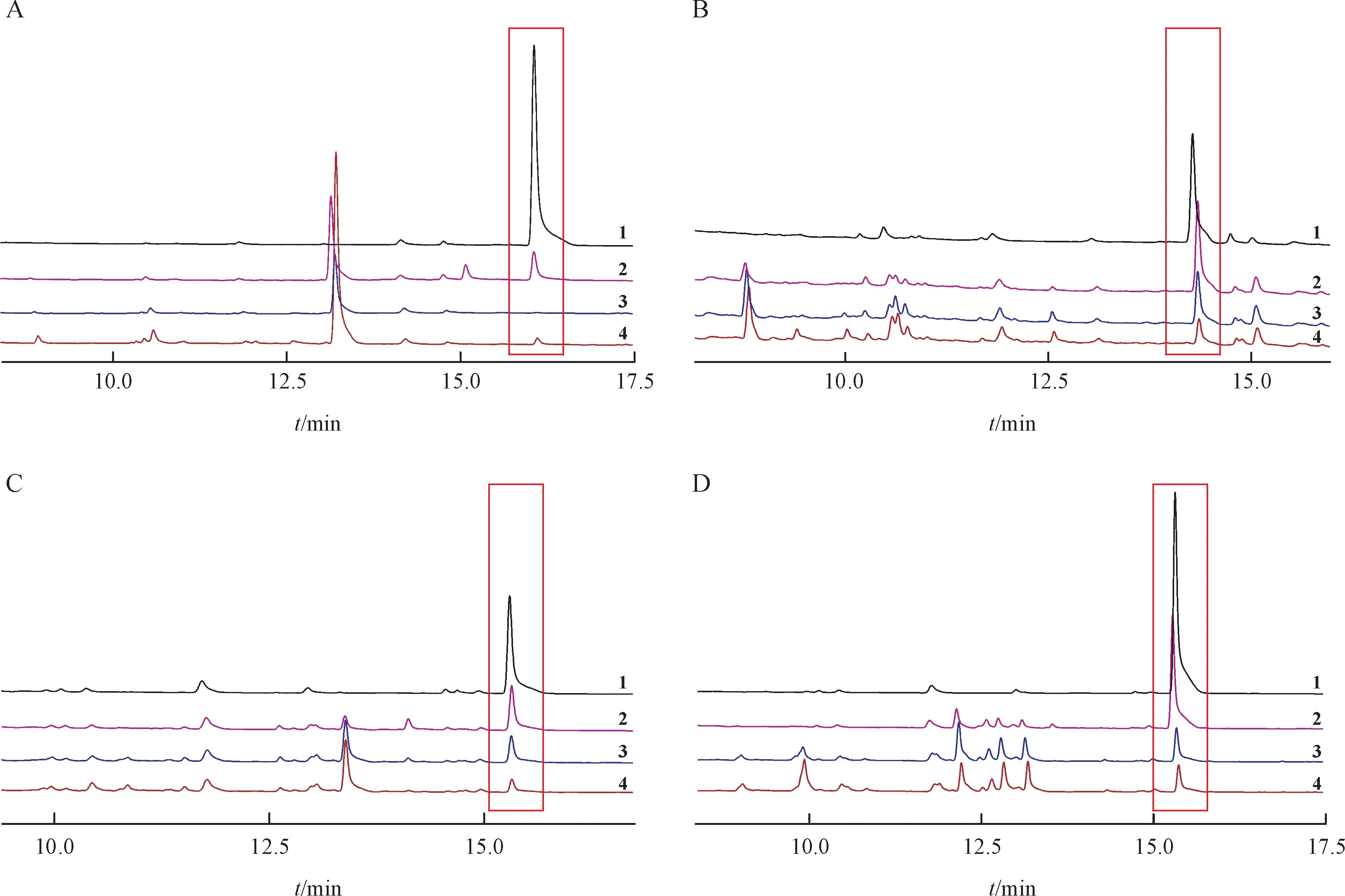
Figure 2 HPLC chromatograms of 5F-EMP-PICA(A),ADB-4en-PINACA(B),4CN-CUMYL-BUTINACA(C),and 4F-MDMB-BUTICA(D)1:Negative control;2:Incubated for 10 min;3:Incubated for 60 min;4:Incubated for 3 h
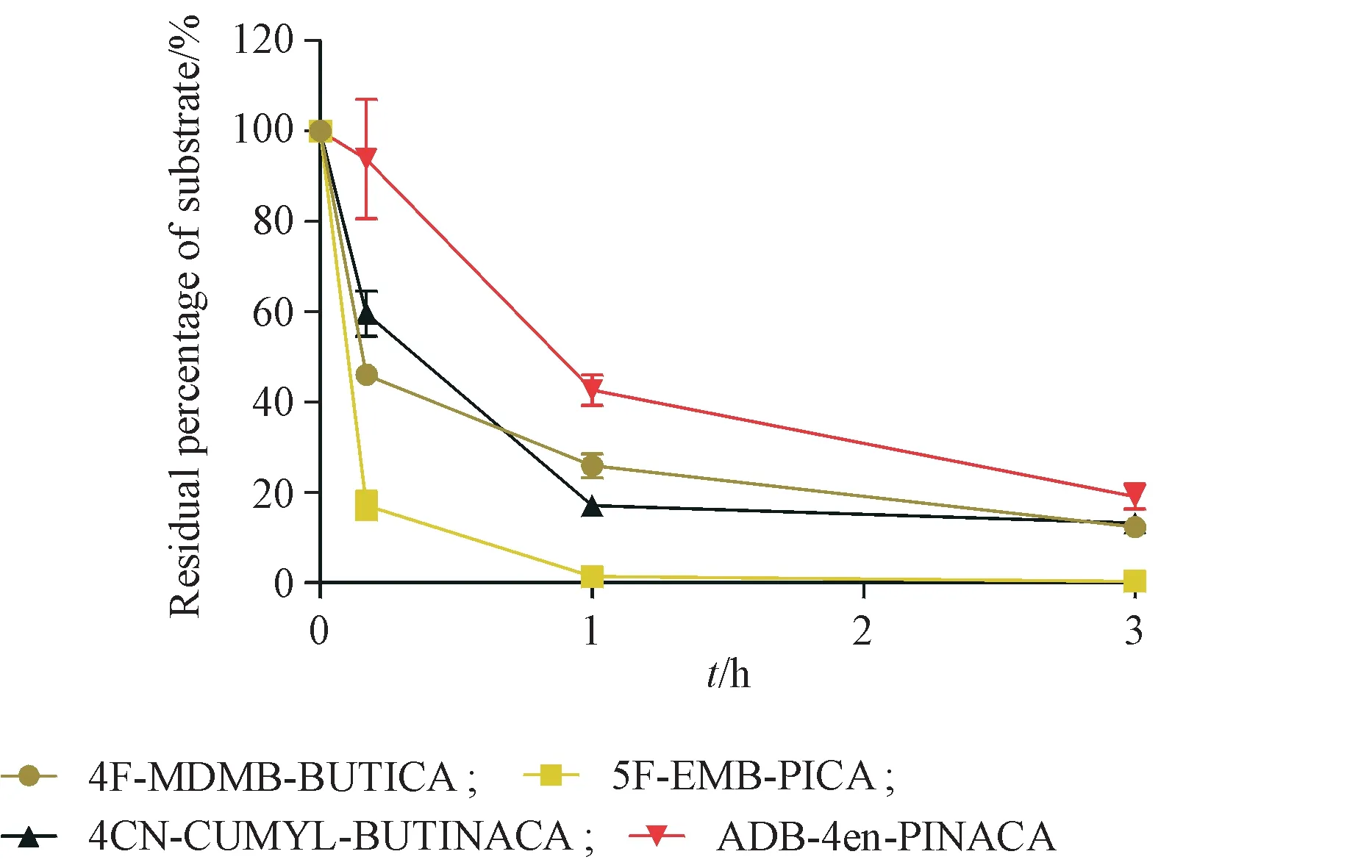
Figure 3 Residual percentage of the four amide synthetic cannabinoids after treatment with human liver microsomes(,n = 3)
2.2.1 5F-EMB-PICA 5F-EMB-PICA 在人肝微粒体实验模型中初步鉴定出14 种Ⅰ相体外代谢物,图4 是14 种代谢物的提取离子色谱图,代谢产物信息列于表1(代谢产物标记为M),其中M1-2和M7 在3 h 没有检出,但在10 min 有检出,因此也列入了表1。图5 为人肝微粒体中5F-EMB-PICA 及其主要代谢物的二级质谱图。
从代谢物的提取离子色谱图峰面积初步推断,5F-EMB-PICA 主要Ⅰ相代谢产物为酯水解代谢产物(M3)、酯水解合并吲哚环羟化代谢产物(M4-2)和酰胺水解代谢产物(M10),羟基化代谢反应优先发生在吲哚环和氟戊烷侧链上。根据原型化合物及代谢产物的质谱裂解信息,推测5F-EMBPICA的代谢途径示于图6。
2.2.2 ADB-4en-PINACA ADB-4en-PINACA 在人肝微粒体实验模型中初步鉴定出12种Ⅰ相体外代谢物,图7 是12 种代谢物的提取离子色谱图,代谢产物信息列于表2。图8 为人肝微粒体中ADB-4en-PINACA及其主要代谢物的二级质谱图。
从代谢物的提取离子色谱图峰面积初步推断,ADB-4en-PINACA 主要Ⅰ相代谢产物为双键氧化成邻二醇代谢产物(M3)、戊烯侧链单羟基化代谢产物(M1-1)和吲唑环单羟基化代谢产物(M1-2)。根据原型化合物及代谢产物的质谱裂解信息,推测ADB-4en-PINACA 可能的代谢途径示于图9。
2.2.3 4CN-CUMYL-BUTINACA 4CN-CUMYLBUTINACA 在人肝微粒体实验模型中初步鉴定出14 种Ⅰ相体外代谢物,图10 是14 种代谢物的提取离子色谱图,代谢产物信息列于表3,其中M2-2 在10 min有检出,因此也列入了表3。图11为人肝微粒体中4CN-CUMYL-BUTINACA 及其主要代谢物的二级质谱图。
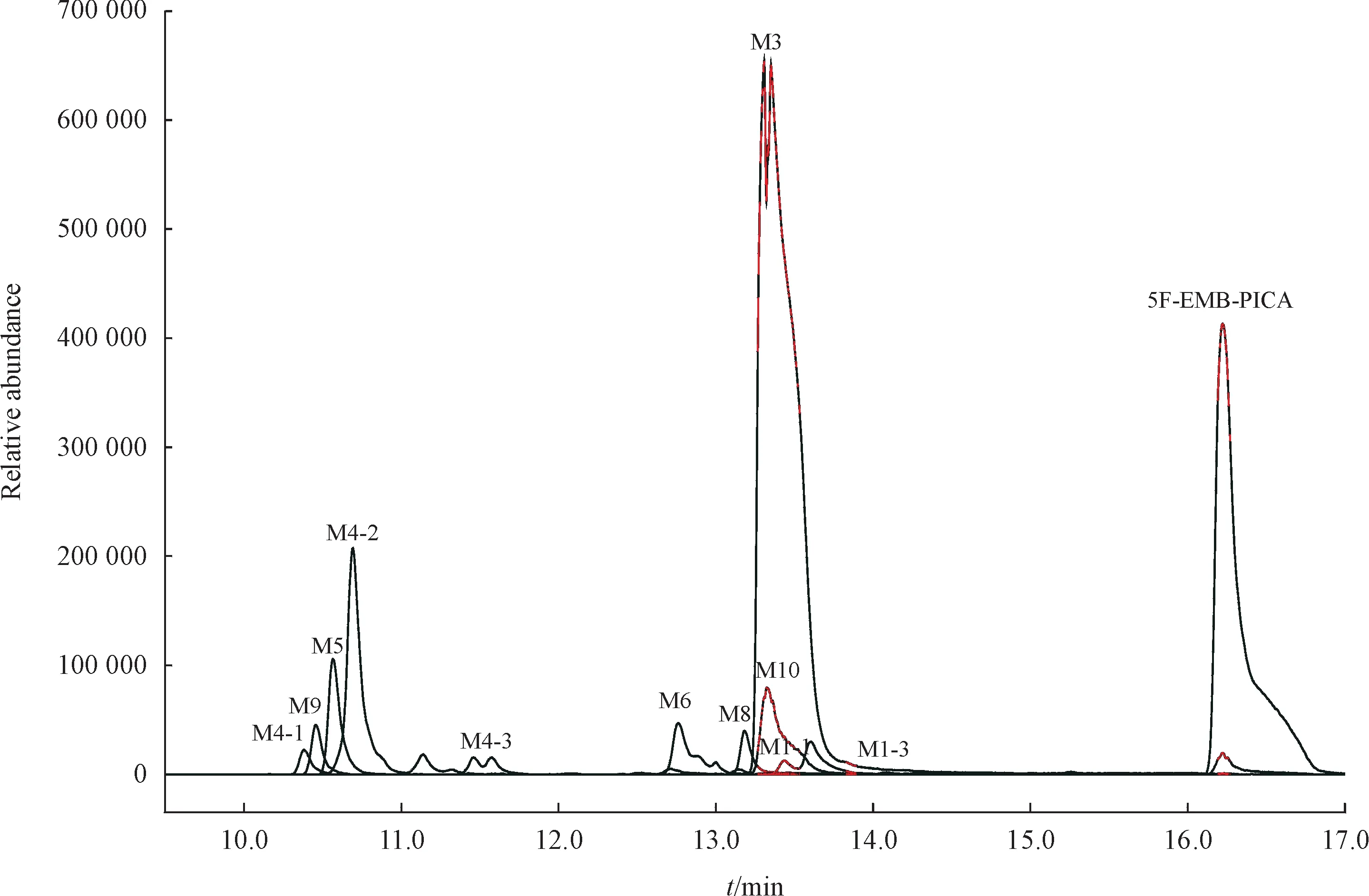
Figure 4 Combined extracted ion chromatograms of 5F-EMB-PICA's metabolites identified in human liver microsomes
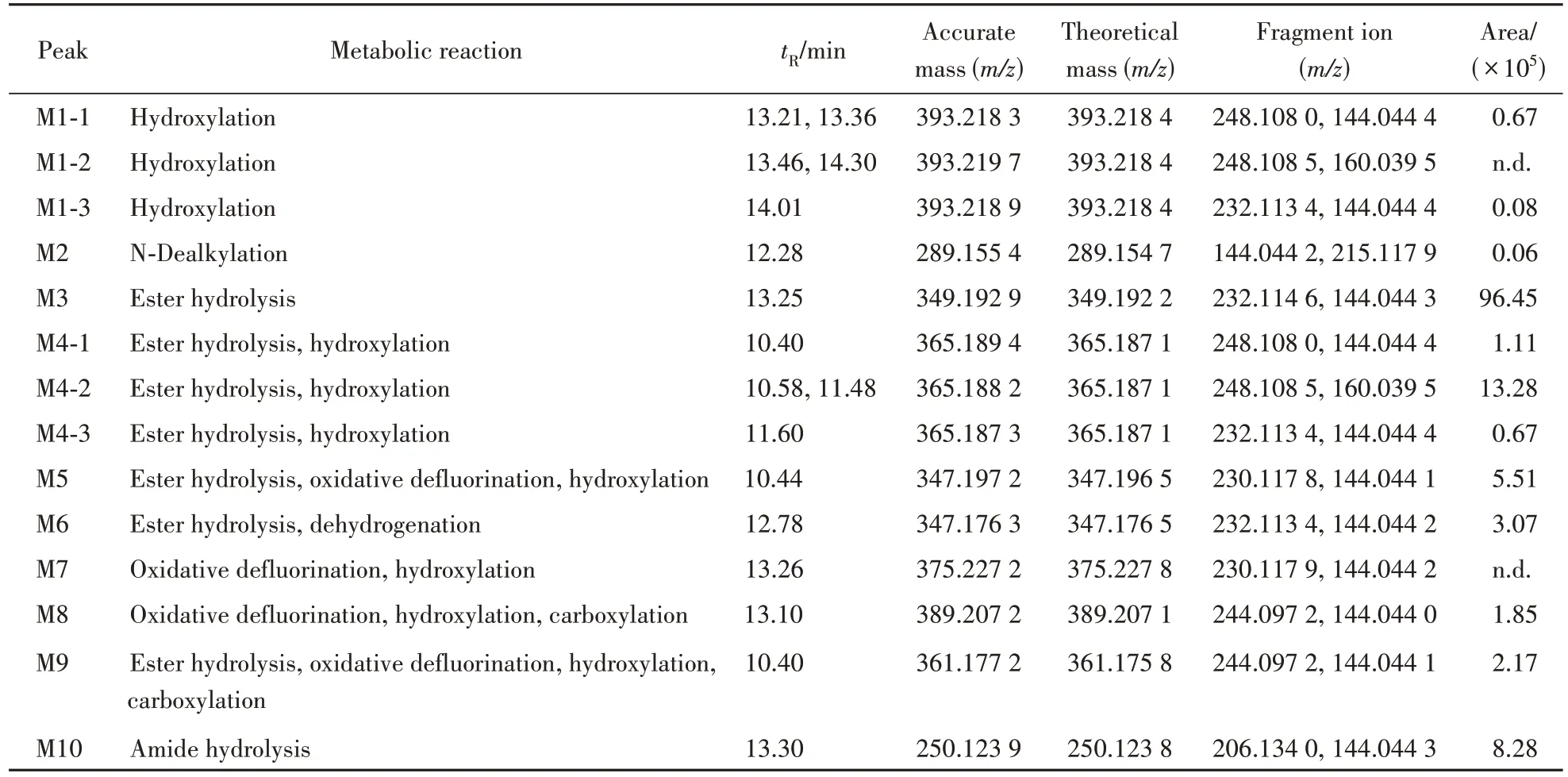
Table 1 Phase I metabolites of 5F-EMB-PICA
从代谢物的提取离子色谱图峰面积初步推断,4CN-CUMYL-BUTINACA 主要的Ⅰ相代谢产物为氧化脱氰羧基化代谢产物(M9)、氰基丁基侧链单羟基化代谢产物(M1-2)和1-甲基-苯乙基单羟基化代谢产物(M1-1)。根据原型化合物及代谢产物的质谱裂解信息,推测4CN-CUMYL-BUTINACA可能的代谢途径示于图12。
2.2.4 4F-MDMB-BUTICA 4F-MDMB-BUTICA在人肝微粒体实验模型中初步鉴定出21种Ⅰ相体外代谢物,图13 是21 种代谢物的提取离子色谱图,代谢产物信息列于表4,其中M2、M3-1 和M3-2在10 min有检出,因此也列入了表4。图14为人肝微粒体中4F-MDMB-BUTICA 及其主要代谢物的二级质谱图。
从代谢物的提取离子色谱图峰面积初步推断,4F-MDMB-BUTICA 主要的Ⅰ相代谢产物为酯水解代谢产物(M7)、N-脱烷基代谢产物(M14)和酯水解合并脱氢代谢产物(M9),且羟基化代谢反应优先发生在吲哚环上。根据原型化合物及代谢产物的质谱裂解信息,推测4F-MDMB-BUTICA 可能的代谢途径见图15。
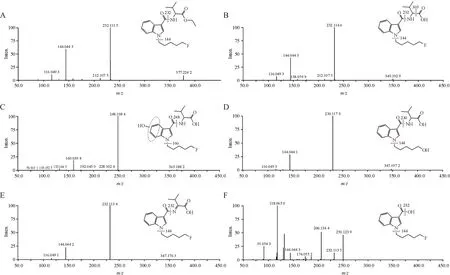
Figure 5 Mass spectrum and fragmentation information of 5F-EMB-PICA and its main metabolites in human liver microsomesA:5F-EMB-PICA;B:Ester hydrolysis metabolite(M3);C:Ester hydrolysis and hydroxylation metabolite(M4-2);D:Ester hydrolysis,oxidative defluorination and hydroxylation metabolite(M5);E:Ester hydrolysis and dehydrogenation metabolite(M6);F:Amide hydrolysis metabolite(M10)
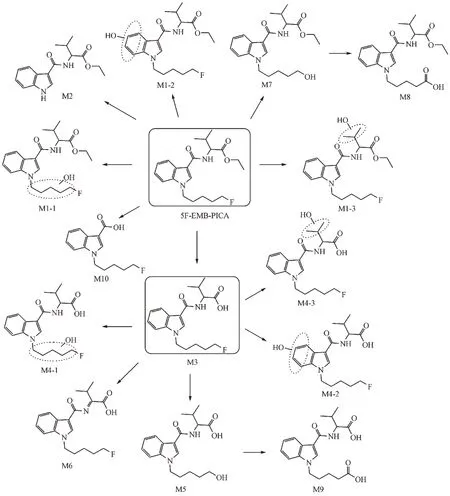
Figure 6 Metabolic pathways of 5F-EMB-PICA in human liver microsomes
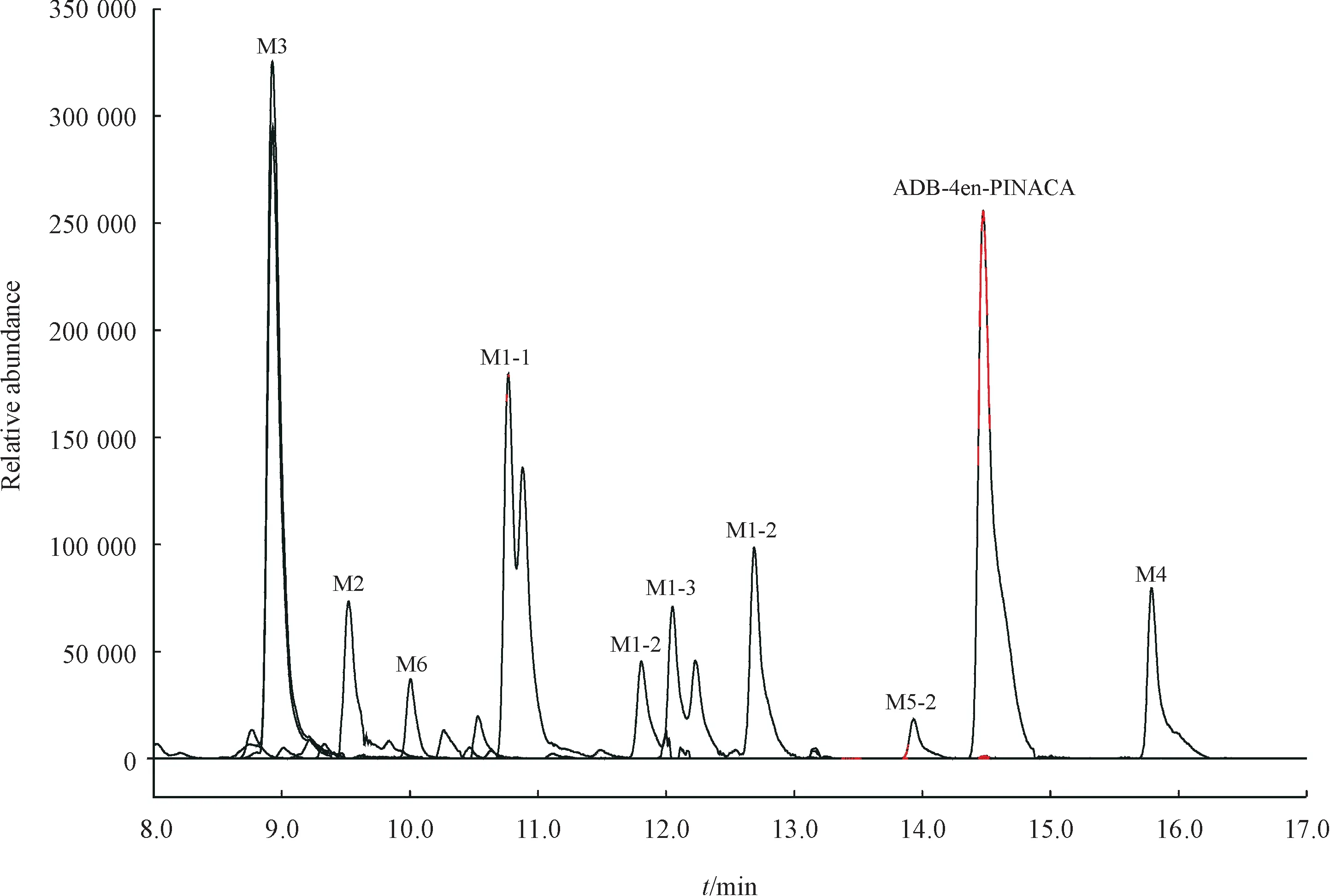
Figure 7 Combined extracted ion chromatograms of ADB-4en-PINACA's metabolites identified in human liver microsomes
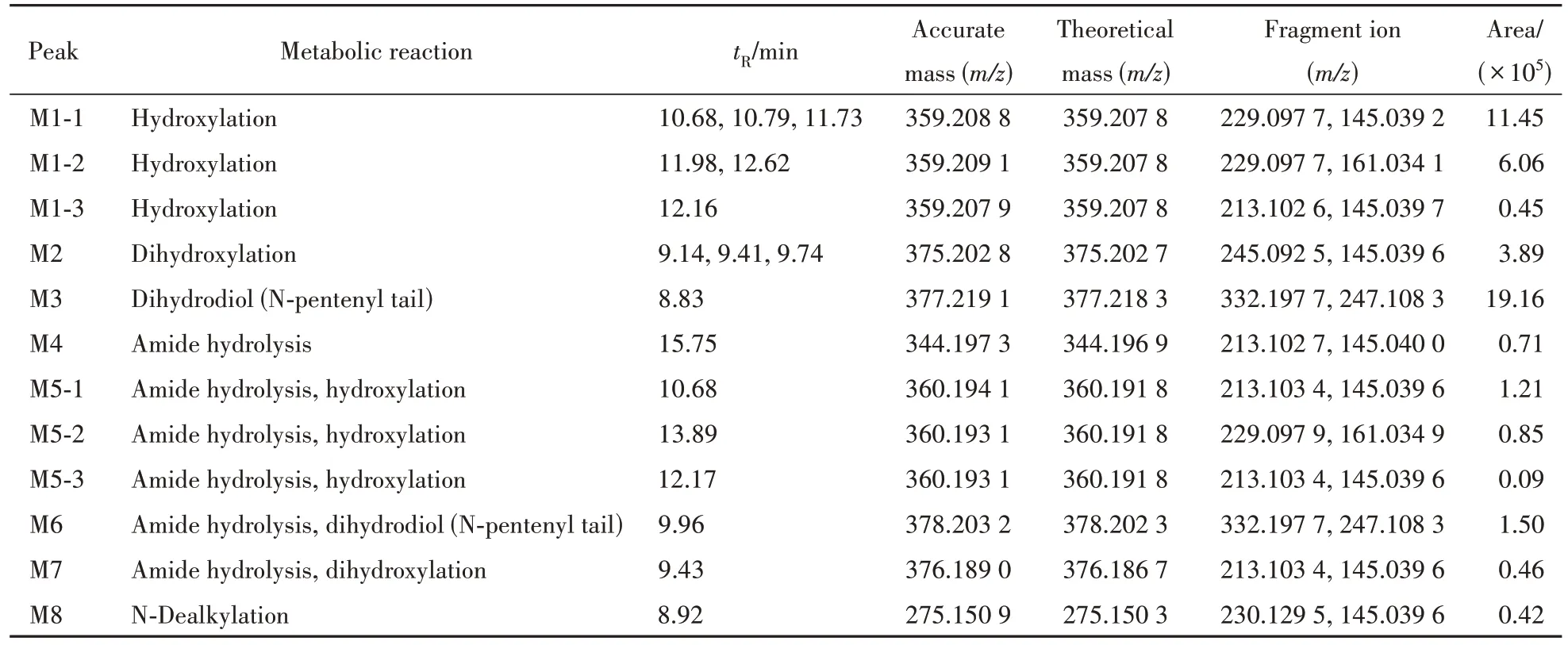
Table 2 Phase Ⅰmetabolites of ADB-4en-PINACA
3 讨 论
3.1 体外人肝微粒体孵育底物浓度优化
在人肝微粒体蛋白质量浓度为1 mg/mL,孵育时间为60 min条件下,分别考察了3种酰胺类合成大麻素质量浓度(1,5,10 µg/mL)对其代谢的影响,结果见图16。
结果显示,除ADB-4en-PINACA 浓度为10µg/mL 时,底物剩余百分比为64.8%,其余均小于25%。在不显著影响代谢率的情况下,当底物浓度选择更高时,潜在的代谢物的响应也会更高,更容易被检出。基于以上考虑,本研究酰胺类合成大麻素的孵育质量浓度选择为10 µg/mL(除ADB-4en-PINACA质量浓度为5µg/mL)。
3.2 4种酰胺类合成大麻素代谢规律
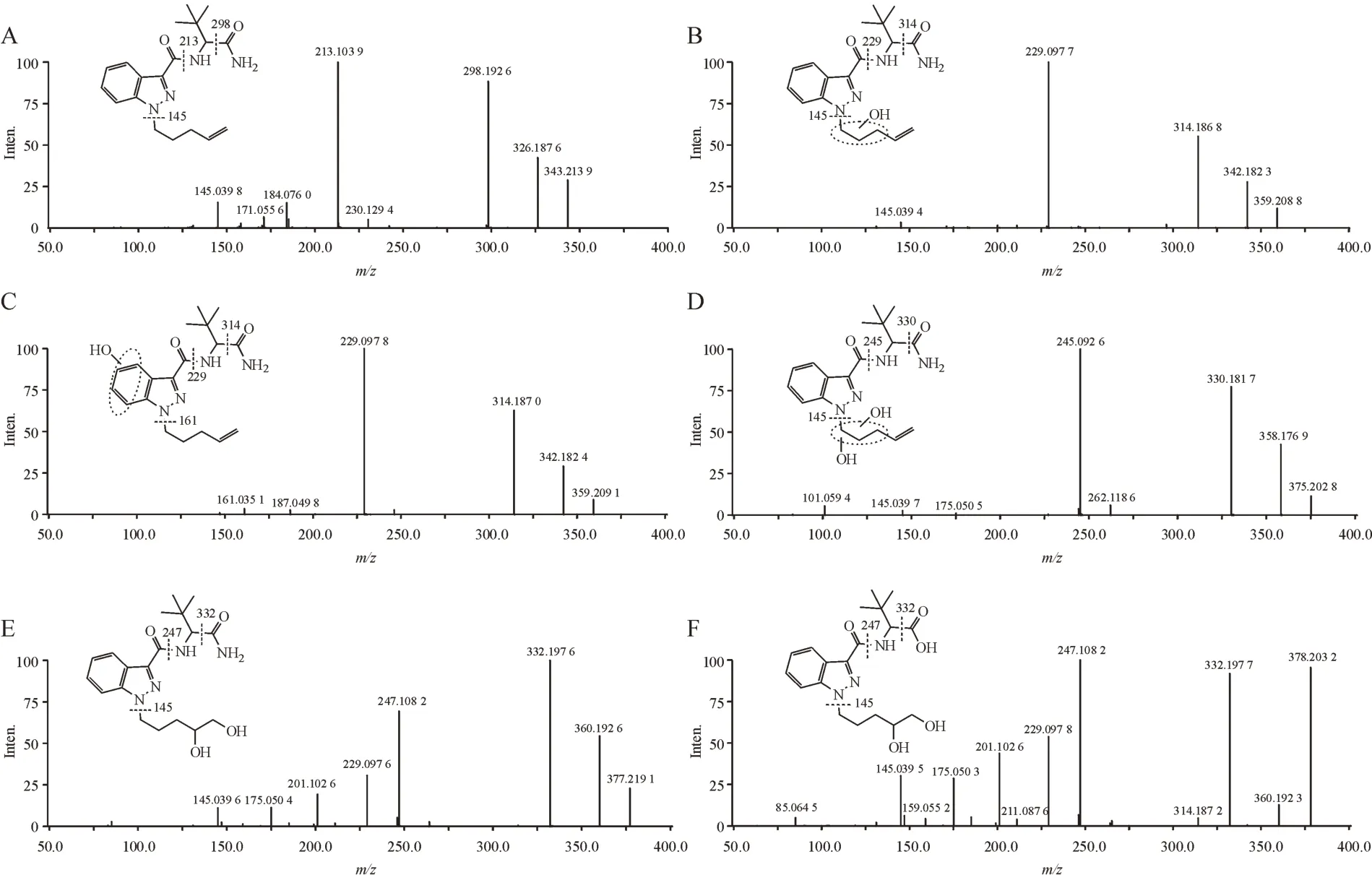
Figure 8 Mass spectrum and fragmentation information of ADB-4en-PINACA and its main metabolites in human liver microsomesA: ADB-4en-PINACA; B: Hydroxylation metabolite (M1-1); C: Hydroxylation metabolite (M1-2); D: Dihydroxylation metabolite (M2); E: Dihydrodiol(N-pentenyl tail)metabolite(M3);F:Amide hydrolysis and dihydrodiol(N-pentenyl tail)metabolite(M6)
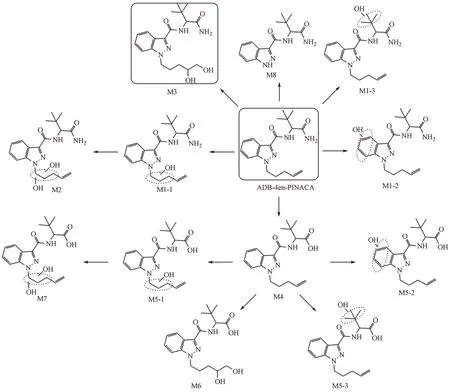
Figure 9 Metabolic pathways of ADB-4en-PINACA in human liver microsomes
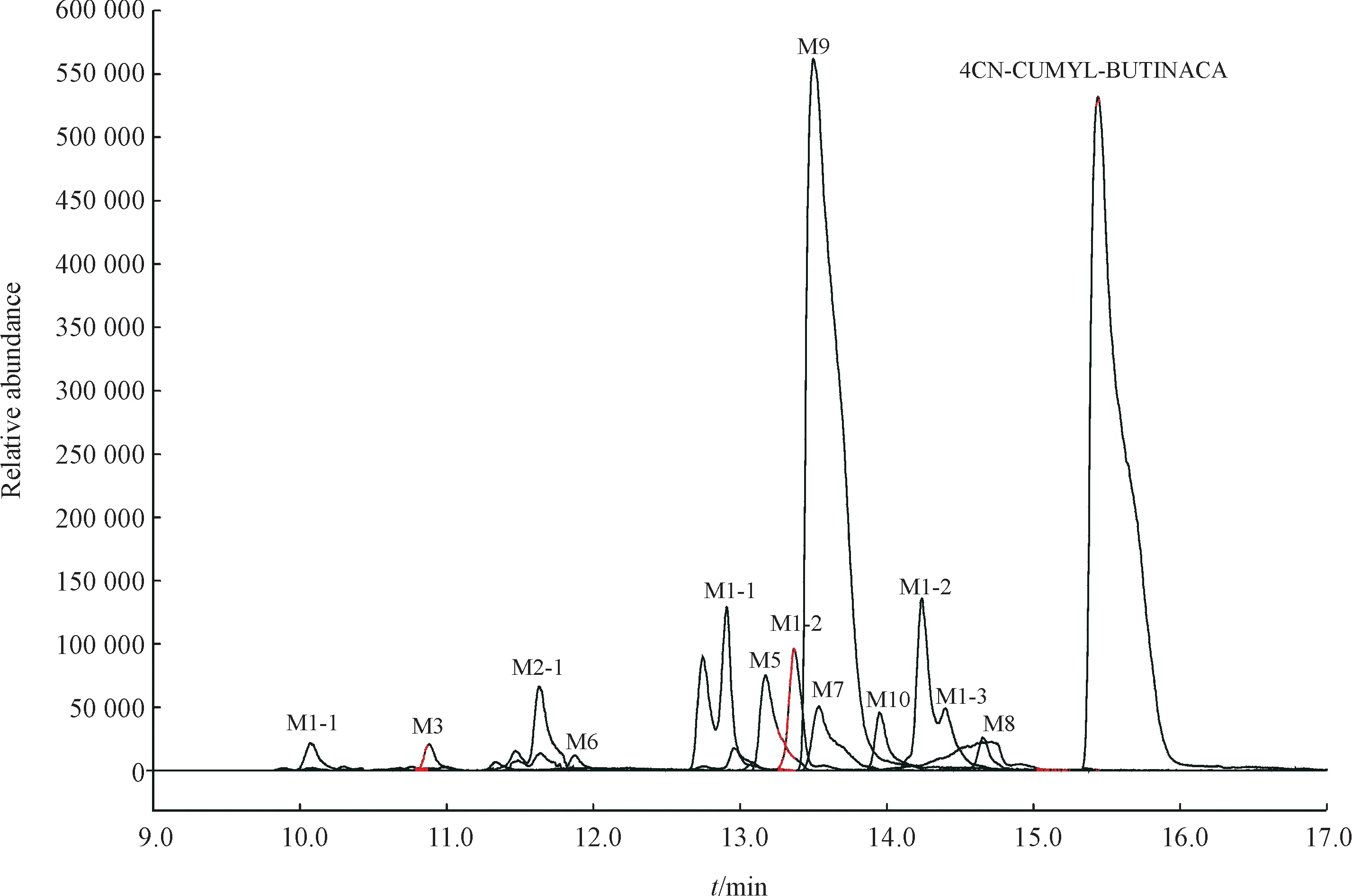
Figure 10 Combined extracted ion chromatograms of 4CN-CUMYL-BUTINACA's metabolites identified in human liver microsomes
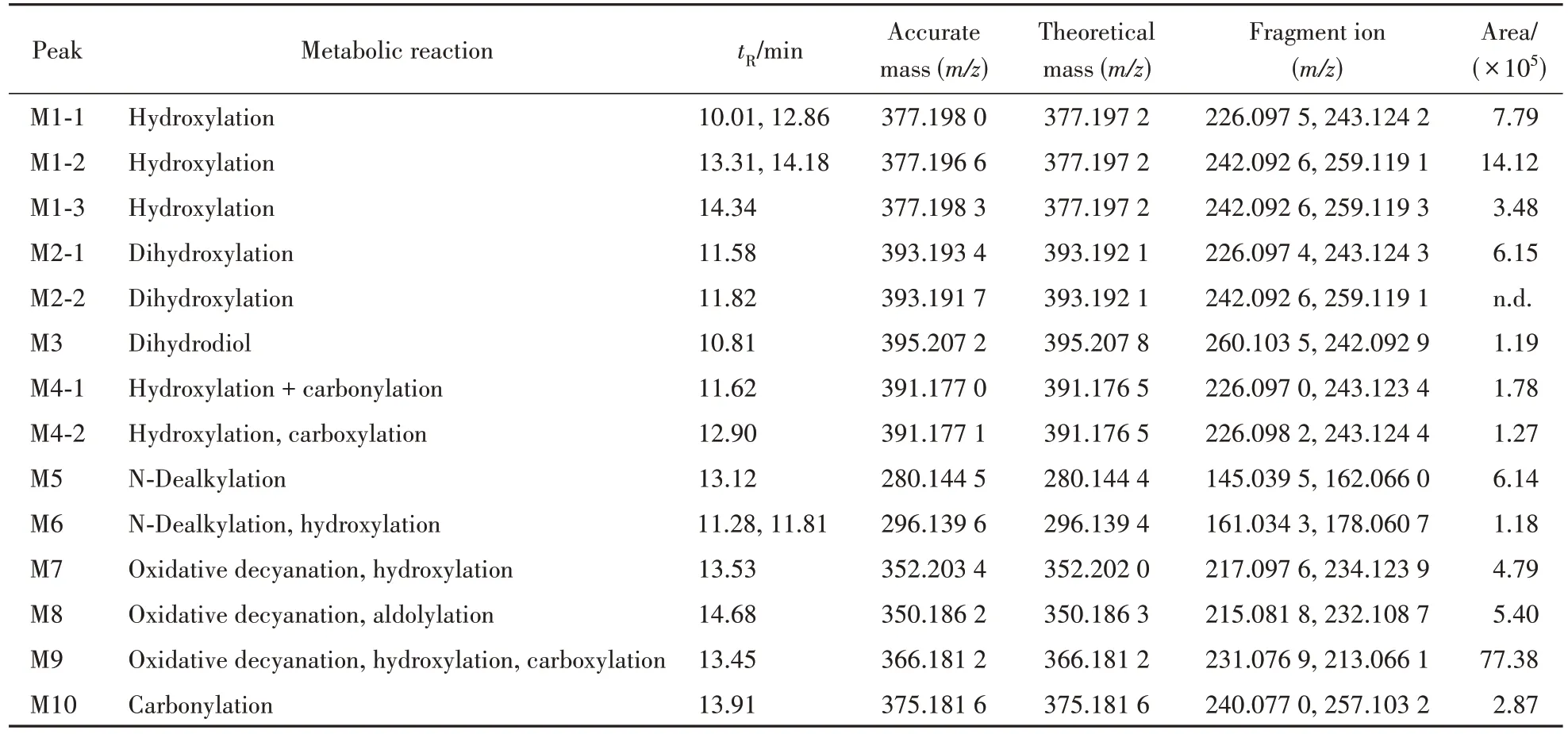
Table 3 Phase Ⅰmetabolites of 4CN-CUMYL-BUTINACA
根据表1 ~ 4,汇总统计出4 种酰胺类合成大麻素在人肝微粒体中一共存在27 种Ⅰ相代谢途径,包括羟基化、羰基化、羧基化、N-脱烷基和酯水解等。首先,从27种代谢途径发生的频率可知,单羟基化、双羟基化、N-脱烷基、N-脱烷基合并羟基化、酯/酰胺水解、酯水解合并羟基化和酯水解合并脱氢在4 种酰胺类合成大麻素中普遍发生。羟基化反应位点普遍发生在烷基侧链、吲哚/吲唑环和酰胺N 端,羟基化的目的是使分子极性增大,更有利于体内通过代谢后排出体外,是非常常见的一种代谢方式。其次,根据提取离子色谱图的峰面积,初步得出4 种酰胺类合成大麻素主要的Ⅰ相代谢途径为酯水解、双键氧化成邻二醇、氧化脱氟羧基化、单羟基化和N-脱烷基,其中羟基化代谢反应优先发生在烷基侧链和吲哚/吲唑环上。以上4 种酰胺类合成大麻素代谢规律的总结,希望能给新出现的酰胺类合成大麻素代谢研究提供参考。
3.3 4种酰胺类合成大麻素代谢标志物分析
从代谢物的提取离子色谱图峰面积得知,ADB-4en-PINACA、5F-EMB-PICA、4CN-CUMYLBUTINACA 和4F-MDMB-BUTICA 的峰度最大代谢产物分别为酯水解、双键氧化成邻二醇、氧化脱氰羧基化和酯水解代谢产物。在温孵10 min,60 min和3 h 过程中,4 种合成大麻素对应的峰度最大代谢产物的峰面积均逐渐增大,这与图3底物剩余百分比逐渐降低结论相对应。综上,酯水解代谢产物可推荐作为5F-EMB-PICA 和4F-MDMB-BUTICA的代谢标志物,双键氧化成邻二醇和氧化脱氰羧基化代谢产物可分别推荐作为ADB-4en-PINACA和4CN-CUMYL-BUTINACA的代谢标志物。
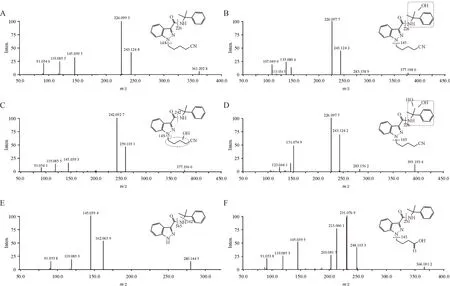
Figure 11 Mass spectrum and fragmentation information of 4CN-CUMYL-BUTINACA and its main metabolites in human liver microsomesA: 4CN-CUMYL-BUTINACA; B:Hydroxylation metabolite (M1-1); C: Hydroxylation metabolite (M1-2);D: Dihydroxylation metabolite (M2-1); E: NDealkylation metabolite(M5);F:Oxidative decyanation,hydroxylation and carboxylation metabolite(M9)
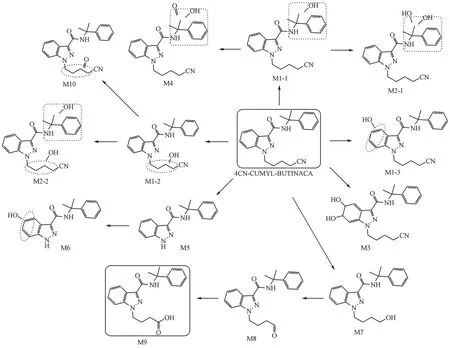
Figure 12 Metabolic pathways of 4CN-CUMYL-BUTINACA in human liver microsomes
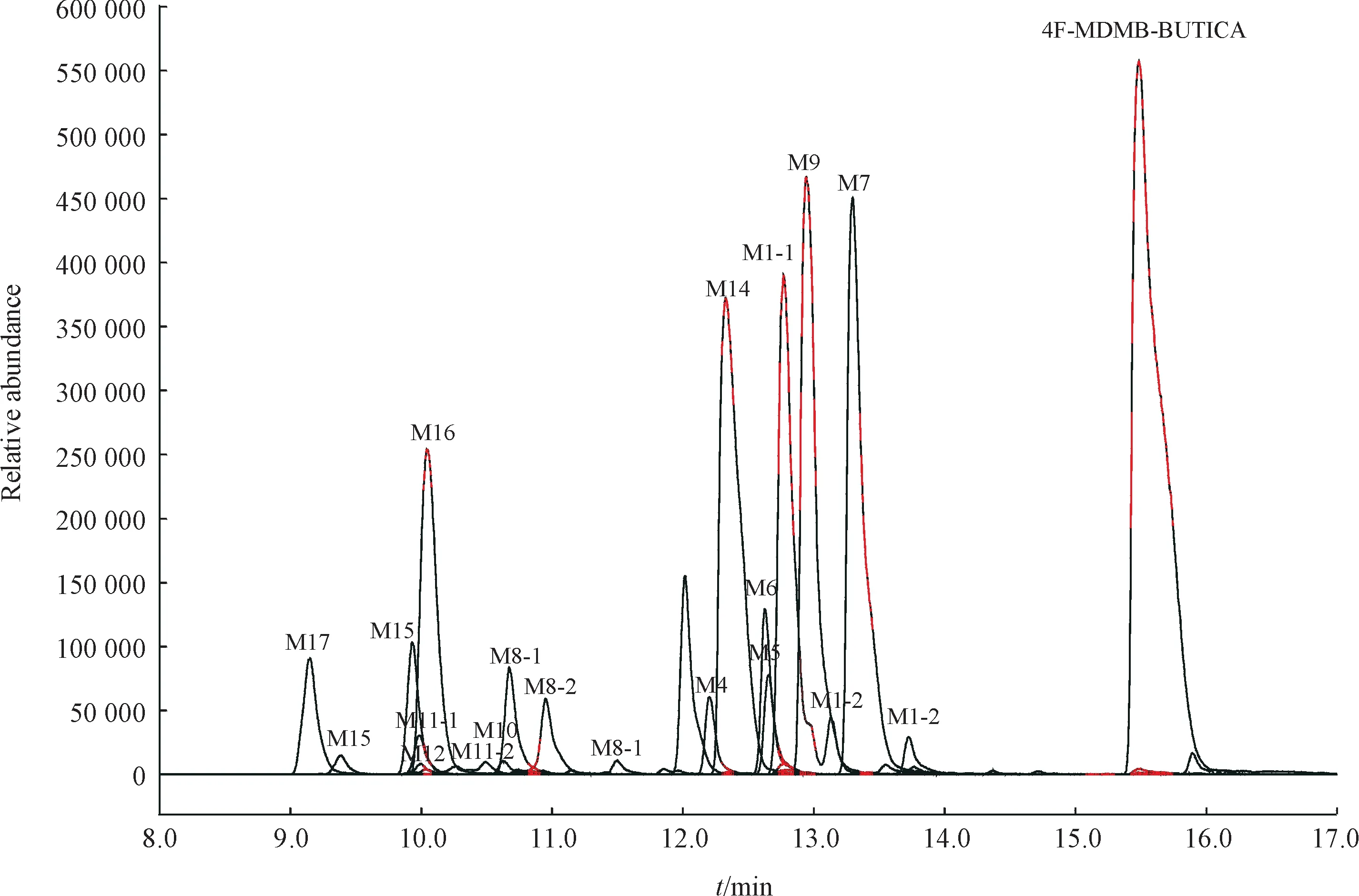
Figure 13 Combined extracted ion chromatograms of 4F-MDMB-BUTICA's metabolites identified in human liver microsomes
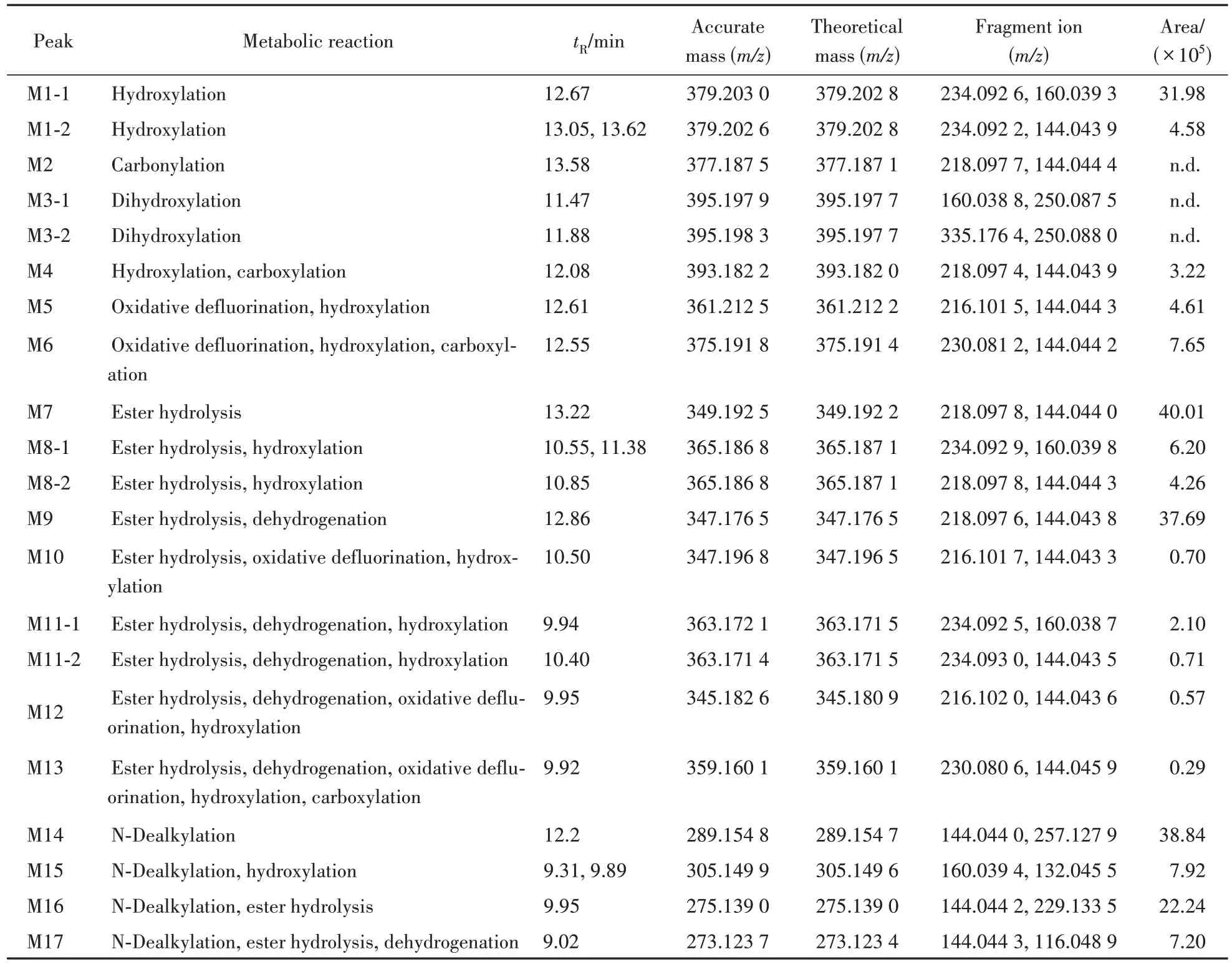
Table 4 Phase I metabolites of 4F-MDMB-BUTICA
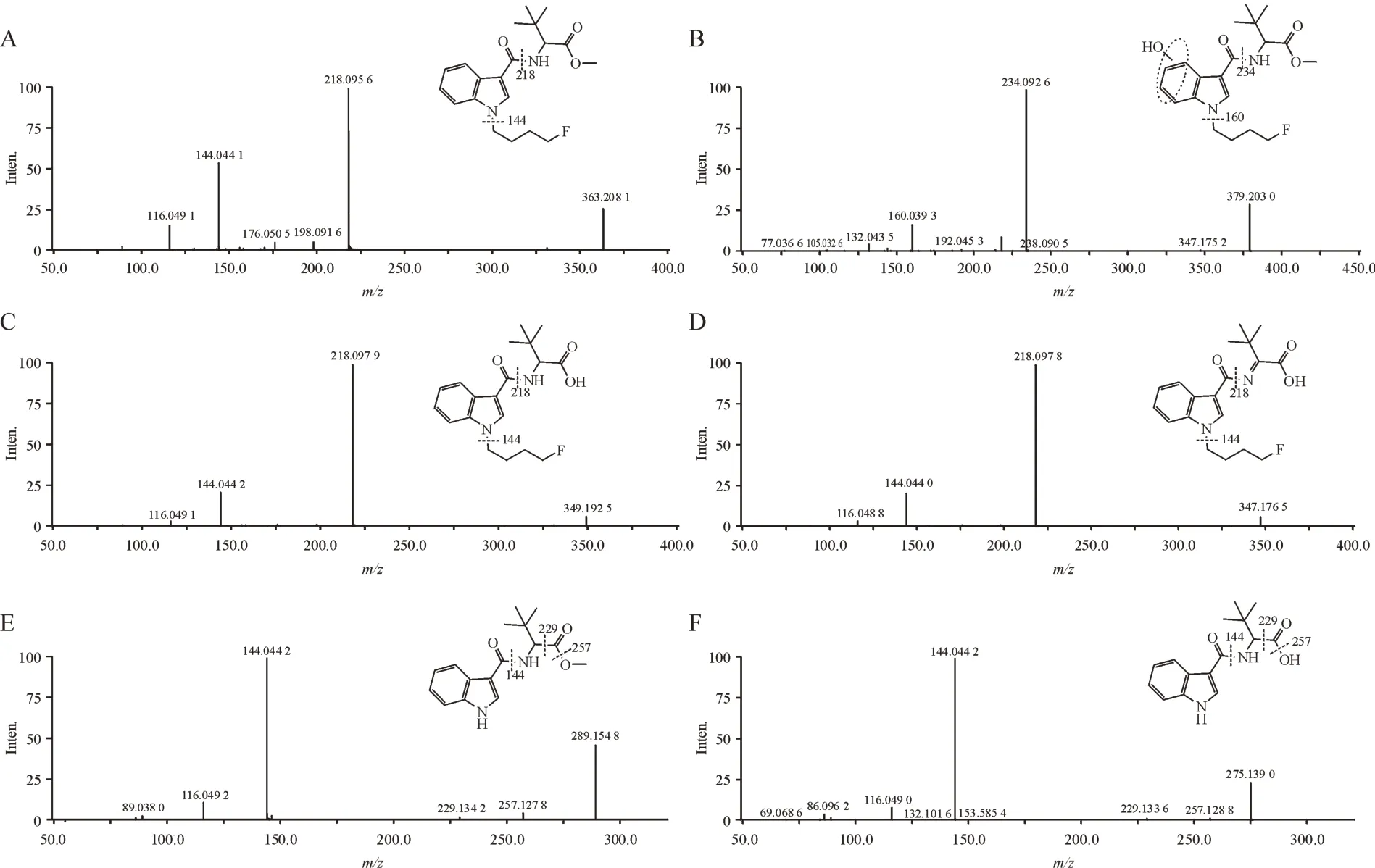
Figure 14 Mass spectrum and fragmentation information of 4F-MDMB-BUTICA and its main metabolites in human liver microsomesA: 4F-MDMB-BUTICA; B:Hydroxylation metabolite (M1-1);C: Ester hydrolysis metabolite (M7); D: Ester hydrolysis and dehydrogenation metabolite(M9);E:N-Dealkylation metabolite(M14);F:N-Dealkylation and ester hydrolysis metabolite(M16)
通过分析4 种酰胺类合成大麻素原型及其61种代谢物的结构特点,得出吲唑酰胺类合成大麻素(ADB-4en-PINACA 和 4CN-CUMYL-BUTINACA)具有m/z 145 的骨架结构,其代谢物具有m/z 145 或161(吲唑环单羟基化)的骨架结构;吲哚酰胺类合成大麻素(5F-EMB-PICA 和4F-MDMB-BUTICA)具有m/z 144 的骨架结构,其代谢物具有m/z 144 或160(吲哚环单羟基化)的骨架结构。在基层公安实践中,可通过扫描特征碎片m/z 144、145、160 和161,来初步筛选酰胺类合成大麻素。
4 总 结
本研究应用UHPLC-HRMS技术筛选并初步鉴定了4 种酰胺类合成大麻素在人肝微粒体孵育模型中的61 种Ⅰ相代谢产物,推测了其化学结构及27 种Ⅰ相代谢途径。该研究结果为新型酰胺类合成大麻素代谢研究提供了参考,为4种酰胺类合成大麻素常规尿液样本分析和污水中该类毒品毒情评估提供了潜在的检测标志物。此外,后续工作一方面可以制备主要代谢物的标准品,进一步对本研究代谢物的结构进行确证;另一方面,在禁毒实践中亟需针对合成大麻素类毒品的Ⅱ相代谢及排泄展开研究,为该类毒品的认定及生物检材中该类毒品检验方法的建立提供依据。
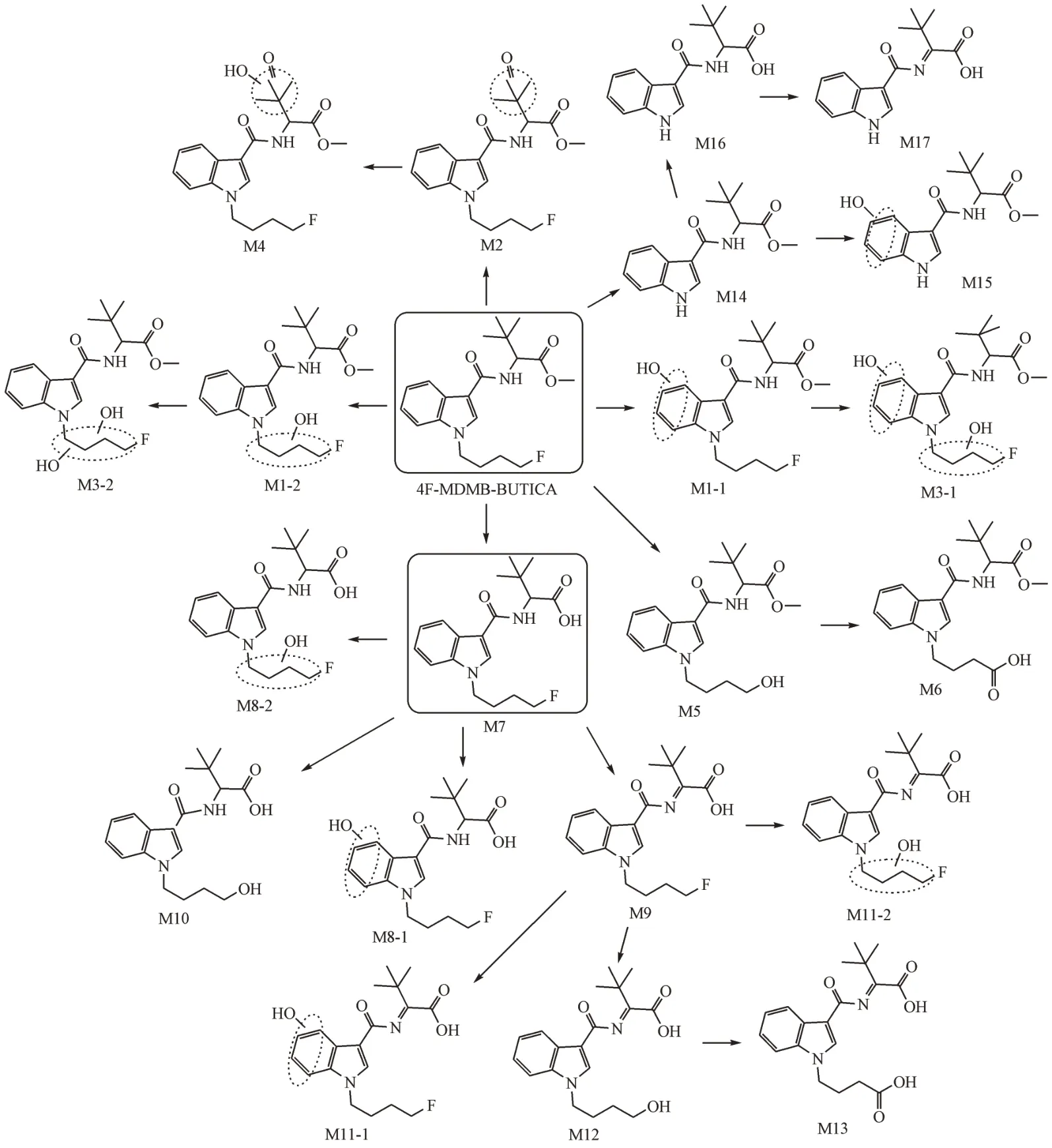
Figure 15 Metabolic pathways of 4F-MDMB-BUTICA in human liver microsomes
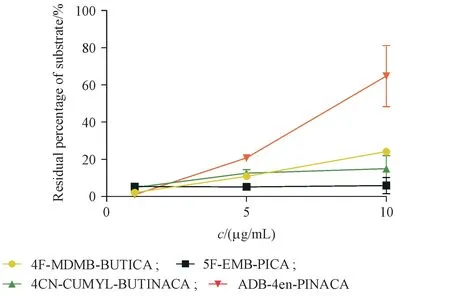
Figure 16 Residual percentage of substrate after treatment with different concentration of four amide synthetic cannabinoids (,n = 3)

