混交对亚热带针叶树根际土壤氮矿化和微生物特性的影响
邬子俊,段晓清,李文卿,陈伏生,2,刘苑秋,2,方向民,2,*
1 江西农业大学鄱阳湖流域森林生态系统保护与修复国家林业和草原局重点实验室,南昌 330045 2 江西农业大学林学院,江西省森林培育重点实验室,南昌 330045
在人工林生态系统,针叶纯林中混交阔叶树是改善地力,提高林地生产力和生态服务功能,促进生态系统正向演替的重要措施[1—2]。研究表明混交不仅可以增加林分生物多样性,还能改善养分循环和土壤肥力,增加林地生产力和碳固存,并且增强森林抵御病虫害等外界干扰的能力[3—4]。土壤养分供应是树木生长和应对外界环境变化的基础[5],针阔混交可以改善林地的整体养分供应状况,一方面通过增加凋落物的量和多样性,促进凋落物的分解,增加土壤养分输入[6];另一方面也可通过改变微生物的生物量和活性[7—8],影响土壤矿质养分的释放。然而,很少研究关注针阔混交林中单个树种,尤其是针叶树的根际养分供应状况,限制了我们对混交效应的全面评估。对于单个树种而言,根际是树木获取土壤养分的主要区域,根际土壤养分的转化及其影响因素能准确反映针叶树养分获取对混交的响应[9]。
氮是树木生长所需的大量元素,也是限制其生长的关键元素。植物不能直接利用土壤有机氮,有机氮只有经过矿化作用转变为无机氮形式,才能被植物直接吸收利用[10—11]。土壤氮矿化连接着植物—土壤的氮素生物地球化学循环,是表征土壤氮转化和供应能力的重要参数。树木可能会通过调整根系凋落物和分泌物的数量和质量,或通过改变土壤有机质的物理和化学稳定性及微生物群落影响土壤氮矿化[12]。研究表明,混交后由于种间相互作用会导致单个树种土壤氮矿化和供应特征发生改变,但混交的影响程度和方向还未得到一致结论[13—14]。例如,一项树种对土壤化学影响的研究表明,在美国红梣(FraxinuspennsylvanicaMarsh.)、北美乔松(PinusstrobusL.)和欧洲云杉(Piceaabies(L.) Karsten)三个树种的混交林中,任一树种的氮矿化速率会受到相邻树种的影响[15],而在热带人工林中,混交和纯林中单个树种根区土壤氮库无显著差异[16]。Dijkstra等发现混交10年后混交林土壤的长期净 N 矿化率显著低于单树种组成的纯林[17],说明混交也可能对养分供应产生不利影响。因此,需要开展更多的研究以降低这种不确定性。
微生物是土壤氮矿化的主要执行者,微生物的数量、群落组成和活性将最终综合反映其他因子对土壤氮矿化的影响[18—19]。根际微生物组成和活性主要受到根际输入有机碳数量和质量的影响[9]。由于阔叶树常具有较大的根系生物量和资源竞争优势,推测混交阔叶树会增加针叶树土壤氮的获取难度,为适应这种环境,针叶树可能会投入更多的碳到根际,以提高微生物生物量和活性,增加土壤有机氮的转化[20];针叶树也可以调整根系分泌物的组成[9],改变根际土壤微生物群落结构,增加土壤氮矿化能力。此外,不同树种可以通过凋落物数量和质量、根际沉积、根共生体和地下凋落物产生的小气候(如温湿度)等的差异对土壤微生物群落和相关过程产生显著影响[21]。当前,许多研究评估了土壤微生物对树种混交效应的响应特征[13—14],但不同树种响应混交的差异及混交后微生物群落组成和活性改变如何影响根际土壤氮转化还不完全清楚。
20世纪80年代,为了减少水土流失,改善生态环境,亚热带地区营造了大面的马尾松(PinusmassonianaLamb.)和湿地松(PinuselliottiiEngelmann)纯林[22—23],而随着时间推移,许多针叶纯林都表现出地力衰退,生态服务功能弱的问题[24]。由于纯林物种丰富度低,抵御外界干扰的能力弱,人工纯林常表现出较低的生态系统稳定性。补植阔叶树成为改善地力、增加生态系统稳定性和提升针叶纯林生态服务功能的有效措施[25],而木荷(SchimasuperbaGardn.et Champ.)作为亚热带常绿阔叶林的建群种则常被使用[26]。研究表明,混交提高了土壤有效养分含量,但混交后针叶树根际土壤氮转化和供应特征还不清楚。为此,本研究选择马尾松和湿地松纯林,马尾松-木荷混交林、湿地松-木荷混交林为研究对象,采集针叶树根际土壤,研究混交对针叶树根际土壤氮矿化和微生物特性的影响,以期探究混交对针叶树根际土壤养分供应的影响,为人工林经营管理提供科学依据。
1 材料与方法
1.1 研究区概况
研究地点位于江西红壤退化区森林植被恢复与重建长期试验基地(26°44′N,115°04′E)。该地点位于江西省泰和县,属于典型亚热带季风气候,雨热同期,年平均气温18.6℃,年平均降水量1726 mm,集中在4—6月,全年无霜期281 d。土壤为典型红壤,成土母质为第四纪红粘土,平均海拔70—130 m。
1.2 试验设计与样品采集
常绿阔叶林是该区的地带性植被,但20世纪80年代前,由于频繁人为活动,如挖蔸、樵采等,该区主要植被类型为次生灌草。1991年,为了改善生态环境和防止水土流失,选择马尾松、湿地松、木荷和枫香(LiquidambarformosanaHance)等针阔叶树种进行植被恢复试验示范,植被恢复总面积为133 hm2,植被恢复前土壤理化性质一致。2006年,为研究针阔树种混交的生态效应,对分布在不同小班的马尾松和湿地松纯林进行间伐,之后补植2年生木荷,以形成针阔混交林,补植后混交林中的针阔比例约为1∶1。2017年7月,选择分布在不同小班的马尾松、湿地松纯林及其与木荷混交形成的混交林设置样地,每种森林类型设置4个样地,共16个,面积为20 m×20 m,相邻2个样地之间至少有20 m的间隔。马尾松纯林、马木混交林、湿地松纯林和湿木混交林的林分密度均值分别为1650、1312、825株/hm2和1068株/hm2,胸径均值分别为11.4、14.1、17.3 cm和13.6 cm,胸段面积均值分别为17.2、20.7、18.5 m2/hm2和15.3 m2/hm2,其他样地信息见徐芷君等(2019)[23]。
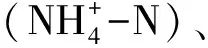
1.3 土壤基本指标测定
1.4 土壤氮矿化测定
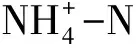
1.5 土壤微生物群落组成
采用磷脂脂肪酸(PLFA)法分析土壤微生物生物量和群落组成。PLFA的提取方法参考Dong等(2015)[19],用气相色谱—质谱联用系统(Agilent GC6890/MS5973,日本)对脂肪酸甲酯进行分离、定量和鉴定。不同的PLFA代表不同的土壤微生物类群。本研究用a13:0,i13:0,i14:0,a15:0,i15:0,i16:0,i17:0,a17:0和i18:0代表革兰氏阳性细菌(G+),14:1ω5c,16:1ω7c,16:1ω9c,cy17:0,17:1ω8c和18:1ω7c代表革兰氏阴性细菌(G-),而细菌总生物量为a13:0,i13:0,14:0,i14:0,14:1ω5c,15:0,a15:0,i15:0,16:0,i16:0,16:1ω7c,16:1ω9c,17:0,i17:0,a17:0,cy17:0,17:1ω8c,18:0,i18:0和18:1ω7c的总和;用16:1ω5c,18:1ω9c,18:2ω6c 和 18:3ω6c代表真菌,其中16:1ω5c代表丛植菌根真菌(AMF),而18:1ω9c和18:2ω6c代表腐生真菌(SA);用10Me16:0,10Me17:0 and 10Me18:0代表放线菌[27]。为分析微生物的群落结构特征,本文分别计算了真菌/细菌,G+/G-和AMF/SA的比值。
1.6 土壤酶活性测定
土壤酶活性用多功能酶标仪(SynergyH4, BioTek,美国)测定。用96孔板测定亮氨酸氨基肽酶(LAP)和β-N-乙酰氨基葡萄糖苷酶(NAG)的活性。在25 ℃下培养2.5 h后,在450 nm发射波长和365 nm激发波长下测量样品的荧光值[19]。
1.7 数据分析
数据统计分析前进行方差齐次性检验。采用双因素方差分析检验混交效应和树种效应对针叶树根际土壤化学指标、氮矿化和微生物特性的影响。当混交效应和树种效应之间有交互作用时,采用独立样本T检验分别计算同一树种在纯林与混交林之间的差异,以及同一林型下马尾松和湿地松之间的差异(α=0.05)。采用皮尔逊相关分析土壤化学指标、微生物特性与氮矿化速率之间的相关性。使用SPSS 22.0软件进行数据处理和统计分析,OriginPro 2016软件作图。文中所有数据为平均值±标准误。
2 结果与分析
2.1 根际土壤速效氮磷含量
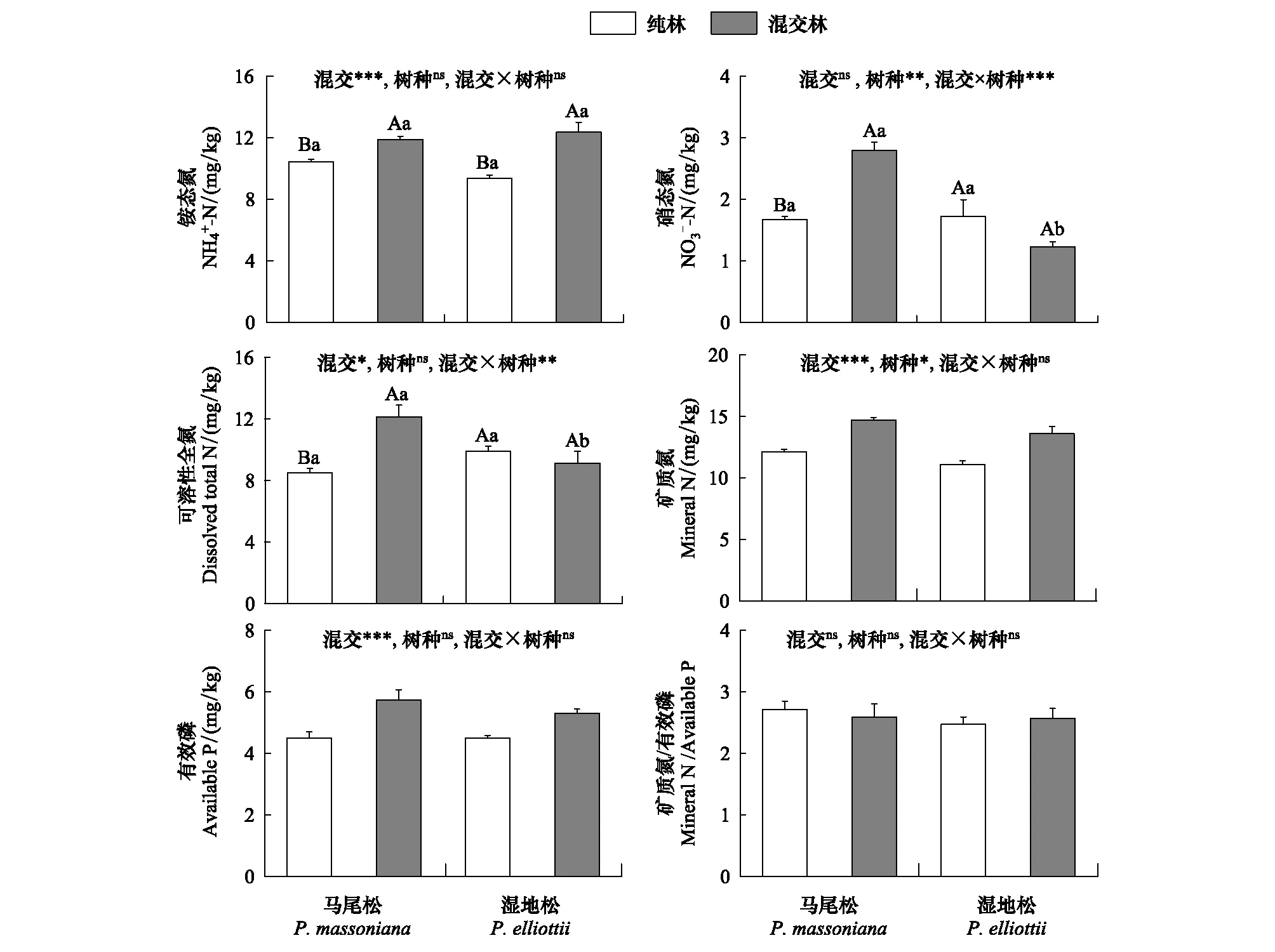
图1 纯林和混交林中针叶树根际土壤速效氮磷含量Fig.1 Rhizosphere soil available nitrogen and phosphorus concentrations of coniferous trees under pure and mixed plantations不同大写字母代表同一树种在纯林与混交林之间差异显著(P<0.05),不同小写字母代表同一林型下马尾松和湿地松之间差异显著(P<0.05);图中列出了混交效应和树种效应的双因素方差结果,ns:无显著差异,* P<0.05,** P<0.01,*** P<0.001下同
2.2 根际土壤氮矿化速率和酶活性
根际土壤氨化速率、硝化速率和净氮矿化速率受混交和树种的影响(图2)。根际土壤氮矿化以硝化作用为主,其速率均值为0.34 mg kg-1d-1,而氨化速率均值为0.14 mg kg-1d-1。混交显著降低了氨化速率,而增加了硝化速率。与纯林相比,混交林中针叶树根际土壤氨化速率降低了27.0%,硝化速率增加了55.4%,平均净氮矿化速率在混交后增加了24.1%。在两个树种间,马尾松根际土壤平均氨化、硝化和净氮矿化速率比湿地松分别高57.5%,21.4%和30.8%。根际土壤硝化速率和净氮矿化速率受混交和树种交互作用的影响。
NAG和LAP酶是与氮矿化相关的水解酶。相比于纯林,混交林中马尾松和湿地松根际土壤NAG酶活性分别增加了48.9%和88.9%。同时,混交后针叶树根际土壤LAP酶活性显著增加了45.6%(图3)。

图2 纯林和混交林中针叶树根际土壤氮矿化速率Fig.2 Rhizosphere soil nitrogen mineralization rate of coniferous trees under pure and mixed plantations
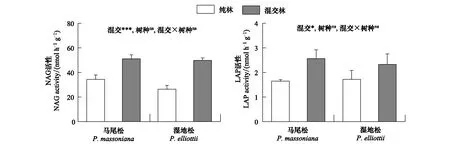
图3 纯林和混交林中针叶树根际土壤氮水解酶活性Fig.3 Rhizosphere soil nitrogen hydrolase activity of coniferous trees under pure and mixed plantations
2.3 根际土壤微生物生物量及群落特征
混交显著提高了针叶树根际土壤真菌、丛枝菌根真菌和总微生物的生物量(PLFAs)(表1)。相比于纯林,混交林中针叶树根际土壤总微生物生物量提高了18.3%,真菌生物量提高了36.8%。混交后针叶树根际土壤细菌生物量有增加趋势,但与纯林相比差异不显著。不同树种间,马尾松根际土壤总微生物、真菌、G-、放线菌、SA和AMF生物量都显著高于湿地松。放线菌和G+生物量不受混交或树种效应的影响,且所有土壤微生物指标均未发现树种和混交的交互效应。
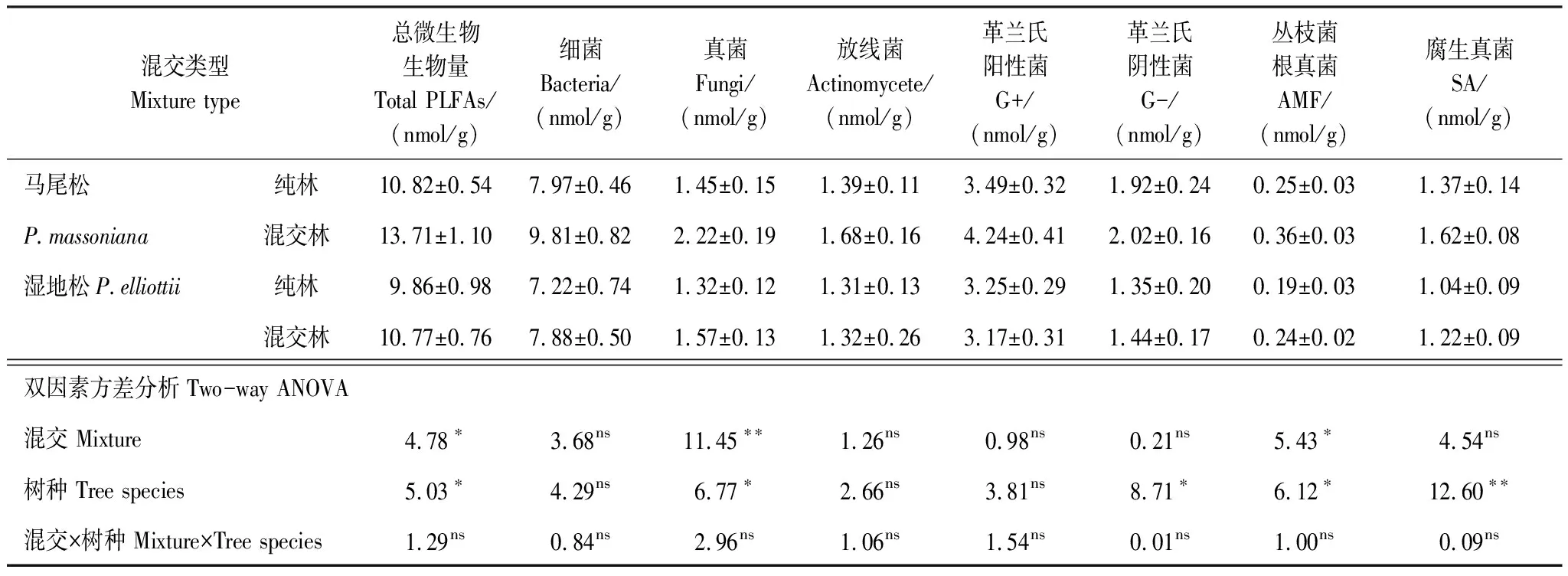
表1 纯林和混交林中针叶树根际土壤微生物生物量
针叶树根际土壤真菌/细菌比在混交后显著增加,混交后针叶树根际土壤真菌/细菌比增加了16.3%,G+/G-和AMF/SA比不受混交或树种效应的影响(图4)。
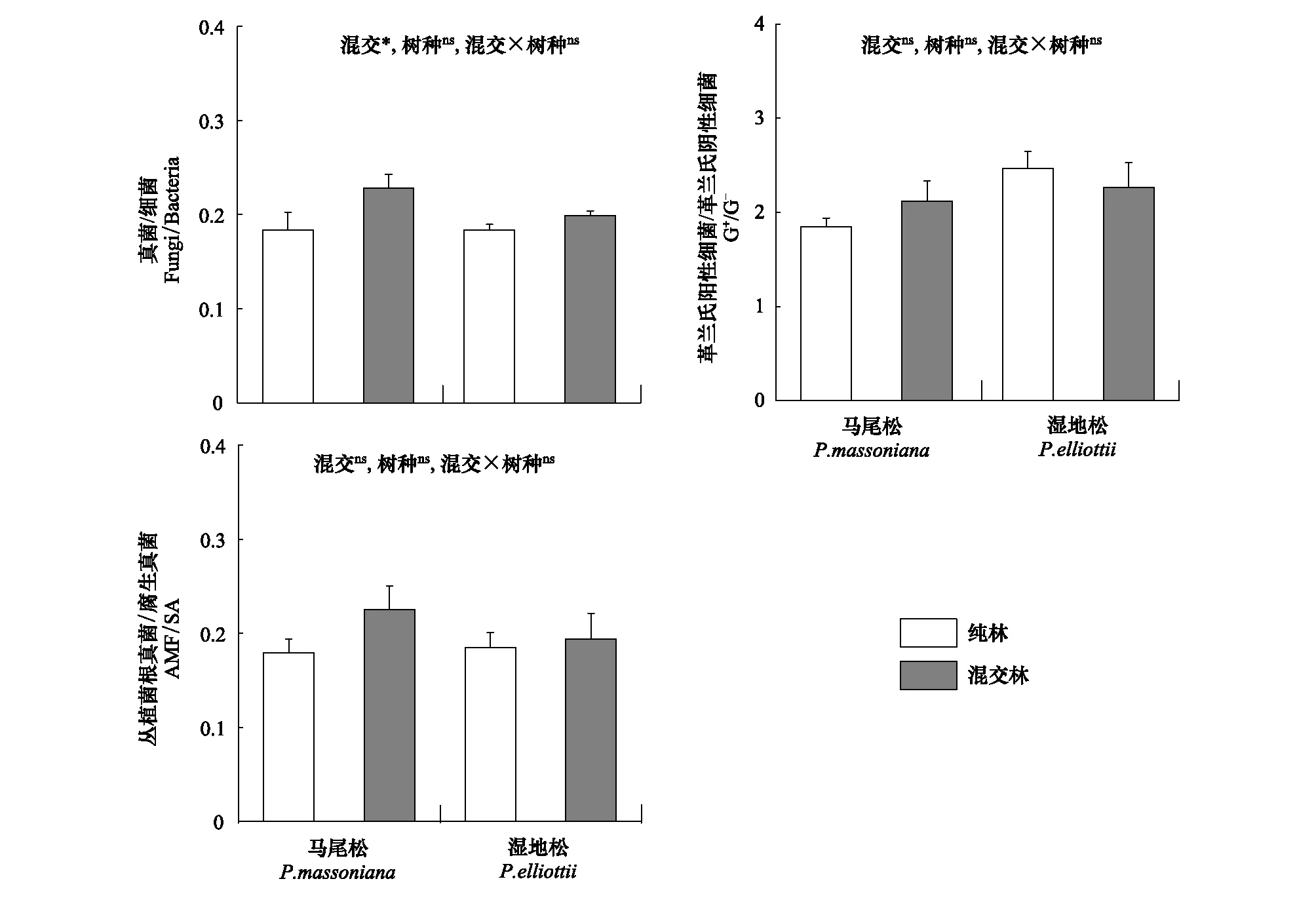
图4 纯林和混交林中针叶树根际土壤微生物群落结构Fig.4 Rhizosphere soil microbial community structure of coniferous trees under pure and mixed plantations
2.4 根际土壤氮矿化和微生物特性的相关性分析
根际土壤氨化速率与土壤微生物指标和酶活性无相关,而土壤硝化速率与NAG酶活性、总微生物生物量、真菌生物量、丛植菌根真菌、腐生真菌生物量及真菌/细菌比呈显著正相关(P<0.05)。同样,土壤净氮矿化速率与总微生物生物量、真菌生物量、丛植菌根真菌、腐生真菌生物量及真菌/细菌比呈显著正相关((P<0.05,图5)。
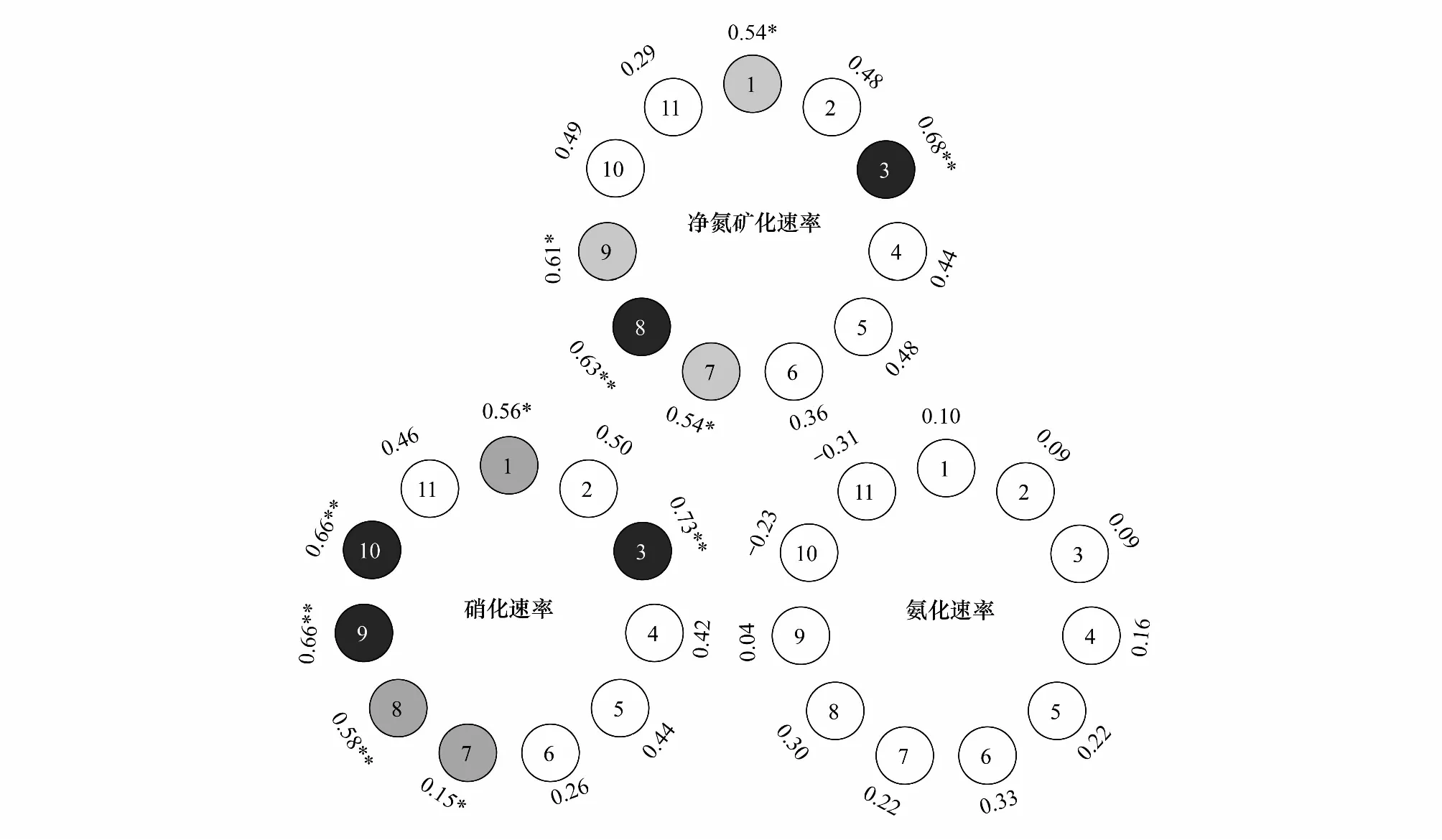
图5 针叶树根际土壤氮矿化速率和微生物特性之间的相关性Fig.5 Correlations between rhizosphere soil nitrogen mineralization rate and microbial characteristics of coniferous trees under pure and mixed plantations1:总微生物生物量;2:细菌;3:真菌;4:放线菌;5:革兰氏阳性细菌;6:革兰氏阴性细菌;7:丛植菌根真菌;8:腐生真菌;9:真菌/细菌;10:β-N-乙酰氨基葡萄糖苷酶;11:亮氨酸氨基肽酶;* P<0.05;** P<0.01
3 讨论
3.1 混交对针叶树根际土壤氮供应的影响
混交整体上增加了针叶树根际土壤的氮供应能力。与纯林相比,混交林中针叶树根际土壤矿质氮含量平均增加21.9%,这有助于增强针叶树的养分获取及其在混交林中竞争力。结果表明,土壤无机氮以铵态氮形式为主,这与黄文娟等[28]在鼎湖山森林土壤中发现的结果一致。土壤 pH 是限制硝化细菌活性的关键因子,硝化细菌适宜的土壤pH为6.7—8.3,而研究区土壤 pH 为5.1—5.2。土壤酸性环境削弱了硝化细菌活性,尽管铵态氮富集增加了土壤硝化速率,但硝态氮的含量仍然较低。此外,硝酸根带负电荷,在土壤中更易淋失,这也是导致土壤硝态氮含量较低的原因之一。
混交显著影响针叶树根际土壤氮矿化过程,混交后针叶树根际土壤氨化速率的下降是由于混交后针叶树根际有机质输入增加,在短时期内通过微生物分解积累了大量铵态氮,但土壤氨化作用对有机质增加的响应具有阈值,较多的铵态氮积累在促进硝化作用的同时,会对氨化作用产生负反馈,通过降低氨化微生物数量和胞外酶活性,抑制土壤氨化作用。根际土壤净氮矿化速率以硝化速率为主,而氨化速率较低,这与扈明媛等[11]研究结果一致。因为相比于温带森林和寒带森林,亚热带地区通常有较快的氮循环,亚热带森林更容易实现铵态氮富集,底物增加致使以硝化作用主导的氮循环加强。
3.2 混交对针叶树根际土壤微生物组成和酶活性的影响
微生物是土壤中最活跃的组成部分,参与有机质分解、养分循环等一系列生态学过程,且影响植物对土壤养分的获取[7,27,29]。本研究中,混交显著增加了针叶树根际土壤总微生物生物量,这与混交后针叶树对土壤养分的竞争压力增加有关。以往研究表明,阔叶树通常具有更大的根系生物量及更强的资源竞争优势,针阔混交林中的针叶树相较于纯林,面临更大的资源获取压力[23]。这时树木可会增加根际碳分配,提高微生物数量和活性,增强微生物对土壤氮磷矿化以获取养分[30]。吴高洋[31]发现与木荷混交后显著增加了马尾松的根系生物量,其中0—10 cm土层细根的生物量增加了95.5%。这说明针叶树对根际土壤碳投入的增大促进了根际微生物生物量的增加。此外,土壤基质也是决定微生物量的关键因素,以往研究发现土壤微生物生物量和土壤养分显著正相关[32],混交后针叶树根际土壤铵态氮、硝态氮和有效磷含量的增加也是微生物量升高的原因。
土壤微生物群落结构和功能同样受到混交的影响。真菌和细菌是土壤中重要的微生物类群,真菌/细菌比可以表征微生物群落结构的变化,比值越高说明生态系统越稳定[33—34]。混交显著提高了土壤真菌/细菌比,这与罗达等[35]的研究结果相同。与纯林相比,混交林中针叶树根际土壤真菌/细菌比显著提高16.3%,说明根际土壤稳定性增加。微生物及其活性是调控根际土壤氮矿化的主要因素,结果显示总微生物,真菌生物量及真菌/细菌比均与土壤净矿化速率显著正相关。土壤真菌/细菌比增加可能是针叶树通过根系分泌物调控微生物群落结构,以适应竞争的一种策略[9]。因为真菌可以与根系共生形成菌根增加树木的养分获取,而细菌则无法实现这种功能[29];此外,真菌相对于细菌具有更高的碳同化效率,对环境胁迫的适应能力更强,可以在碳源相对缺乏的环境下降解难分解有机质以提高土壤矿质氮磷养分供应[34]。混交后针叶树根际土壤丛枝菌根真菌和腐生真菌的数量都有不同程度的增加,丛植菌根真菌是共生真菌,腐生和共生真菌的增加能从以上两个方面增加混交林中针叶树的养分获取。
土壤胞外酶是土壤生物催化剂,其活性是微生物功能和分解潜力的重要参数[19,36—37]。胞外酶活性大小与土壤有机质分解和养分转化过程密切相关[38—39]。混交显著增加了针叶树根际土壤NAG和LAP活性。NAG和LAP都参与土壤中的氮代谢,NAG可降解几丁质和肽聚糖,水解来自壳二糖的氨基葡萄糖,而LAP 可水解亮氨酸、蛋白质和来自多肽氮末端的疏水氨基酸[40]。混交后针叶树根际土壤总微生物和真菌生物量的增加,是酶活性增加的主要原因。土壤酶活性常受微生物生物量的正向调控,较大的微生物生物量意味着较多的NAG酶的产生[41]。例如,Dong等[19]发现NAG酶活性与土壤微生物PLFAs显著正相关。混交林中针叶树根际土壤氮转化酶活性的增加,且NAG酶活性与土壤硝化速率显著正相关,表明混交后微生物产生更多的氮转化酶参与氮水解,增加根际土壤氮供应。
3.3 根际土壤氮供应和微生物特性在树种间的差异
马尾松是我国南方亚热带地区的乡土树种,也是该区群落演替的先锋树种。湿地松为国外引进种,具有生长快特点,已在南方广泛种植[23]。本研究发现马尾松根际土壤矿质氮含量、氨化、硝化和净氮矿化速率等都高于湿地松。同时,马尾松根际土壤总微生物生物量和真菌生物量也高于湿地松,这与两个树种的资源利用策略差异有关。马尾松与湿地松的养分利用和根系生物量存在差异,马尾松发育前期和中期的生长速度低于湿地松林,但其对表层土壤的养分利用率高于湿地松[42],且湿地松会将更多的养分积累在植物体内[43]。这些差异导致它们在氮供应和微生物特性间的不同。湿地松根系分布广而深,而表层土壤中马尾松根系生物量较高[37],这提高了根际土壤中根凋落物的输入,进而增加了微生物生物量和养分含量。
本研究还表明根际土壤氮供应受混交和树种交互作用的影响,尽管混交整体上增加了根际土壤硝化速率和净氮矿化速率,但增加主要发生在马尾松林,而不是湿地松林(图2)。同样,两个树种根际土壤硝态氮含量在纯林中不显著,而在混交林中马尾松林显著高于湿地松(图1)。这些都说明混交对土壤氮供应的影响与树种有关,且马尾松对混交的响应更为敏感。真菌是土壤氮周转的主要驱动者,一项马尾松和湿地松的盆栽研究结果表明在幼苗建立过程中,与外来种湿地松相比,本地种马尾松上的外生菌根真菌表现出较高的氮、磷和纤维素复合降解酶活性[44]。先前的研究也表明马尾松和湿地松人工林表现出不同的生物量和土壤养分储量模式[43],这些差异可能会体现在两个树种应对混交的策略上。推测马尾松生长中倾向于积极性的应对策略,通过增强土壤氮供应以应对外界环境改变,而湿地松倾向于保守型,与马尾松林相比,湿地松林养分循环速率低,通过增加氮周转时间,以适应环境变化。因此,在评价混交对土壤养分循环的影响时,树种的差异应该是需要考虑的因素之一。
4 结论
混交阔叶树作为针叶林改造的重要措施之一,显著增加了针叶树根际土壤氮供应,具体表现为混交增加了针叶树根际土壤矿质氮含量和土壤净氮矿化速率。同时,发现混交后针叶树根际土壤总微生物生物量和真菌生物量、真菌/细菌比和NAG酶活性显著增加,混交通过改变微生物群落组成和酶活性,以促进氮矿化和供应。对比两种针叶树,马尾松根际土壤具有更高的矿质氮含量、净氮矿化速率及微生物生物量,这暗示马尾松具有积极的营养获取策略,而湿地松相对保守,在评价混交效应时,树种差异应受到关注。

