“金花”菌对四种茶叶下脚料中茶多糖含量及抗氧化活性的影响
高 琛,罗 智,刘荣杰,马 玲,戴 栩,周晓红
湖南城市学院 材料与化学工程学院/黑茶“金花”湖南省重点实验室,湖南 益阳 413000
茶作为世界上最受欢迎的天然植物饮料之一,因富含茶多酚、茶氨酸、茶多糖等多种生理活性成分而具有众多有保健功效进而被消费者日渐青睐。茶多糖是茶的功能成分中一种重要的生理活性物质,已被大量文献报道具有抗氧化、降血糖、降血脂、调节免疫、抗肿瘤、降血压、抗辐射、抗凝血和抗疲劳等功效[1-4]。
冠突散囊菌(Eurotium cristatum)是一种茯砖茶发花过程中的优势微生物,因其色泽金黄而俗称“金花”。现有研究表明,冠突散囊菌在生长过程中利用茶叶的营养成分作为生长基质,同时产生各种微生物胞外酶作用于茶叶中的一些大分子物质,如纤维素、果胶质、淀粉、蛋白质等导致其分解、转化和降解成其他物质,从而改善茶叶品质[5-6]。近年来,大量相关研究证明冠突散囊菌所发酵的茶叶或其他代谢产物具有抑菌、抗辐射、降脂、降糖、抗氧化、增强免疫及减肥等保健作用[7-10]。
由于茶多糖和冠突散囊菌突出的保健功效成为众多学者关注的焦点,已有较多研究报道绿茶、红茶、乌龙茶中茶多糖的含量与抗氧化活性以及散茶发花后化学成分的变化[11-14]。但针对茶叶下脚料发花后茶多糖含量及其抗氧化活性的研究目前比较少见。本试验利用“金花”发酵液分别将黑茶、绿茶、红茶和茉莉花茶的下脚料制作成“金花”散茶,提取其中的多糖并对其抗氧化活性进行检测,旨在为提高茶叶下脚料的综合利用及开发新的“金花”散茶提供理论依据。
1 材料与方法
1.1 试验材料
选用四种常规茶的下脚料为原料,其中黑毛茶下脚料来自益阳龙岭黑茶有限公司、茉莉花茶下脚料来自横县星光茶厂、红茶和绿茶的下脚料来自益阳仁和茶业有限公司。冠突散囊菌发酵液菌种由黑茶金花湖南省重点实验室提供。
1.2 试剂与仪器
无水乙醇、葡萄糖、苯酚、硫酸、硫酸亚铁、过氧化氢、水杨酸、铁氰化钾、三氯乙酸、抗坏血酸均为分析纯,来自国药集团化学试剂有限公司;DPPH试剂为优级纯,来自合肥博美生物科技有限公司。
SHZ-B双功能水浴恒温振荡器,江苏金坛亿通电子有限公司;DT5-2B低速台式离心机,北京时代北利离心机有限公司;TP-214电子天平,北京赛多利斯仪器有限公司;XY-200多功能粉碎机,浙江永康市松青五金厂;BKQ-Z30I立式压力蒸汽灭菌锅,山东博科。
1.2 试验方法
1.2.1 样品制备与茶多糖的提取
参考文献方法制备“金花”散茶[15]:称取原茶200 g加入200 mL水混合均匀,置于500 mL培养瓶中,在121℃高压蒸汽锅中灭菌20 min,冷却至室温后迅速转移到已开启紫外灯并保持了15 min后的无菌室中,于无菌操作台采用酒精灯二次手部灭菌后进行接种操作。接种后的茶于28℃恒温培养箱中,待培养瓶中的茶长出“金花”并不再转色后取出,于60℃烘箱下烘干8 h待用。
参考CHEN的研究提取茶多糖[16]:取适量干茶粉碎,过60目筛后于50 mL离心管中准确称量1.00 g茶粉。加入25.0 mL无水乙醇并摇匀。水浴振荡30 min,以4000 r/min离心5 min,在50℃干燥后保留沉淀物,加入30.0 mL蒸馏水,在70℃水浴30 min,以4000 r/min再次离心,保留上清液,并重复两次。将三次离心后保留的上清液混合至100 mL备用。
1.2.2 茶多糖的测定
按苯酚-硫酸法测定茶多糖含量[17]。准确称量105℃下烘干1 h后的无水葡萄糖标准品0.1000 g,少量水溶解后转移至100 mL容量瓶中,定容,制成葡萄糖标准使用溶液。准确移取葡萄糖标准使用溶液配成溶液浓度为0 mg/L、20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L的葡萄糖标准溶液。移取1.00 mL系列标准溶液,加入2.00 mL 5%苯酚溶液和4.00 mL浓硫酸,静置20 min后于490 nm比色测定。空白对照为蒸馏水。横坐标为葡萄糖质量含量、吸光值为纵坐标,绘制标准曲线。
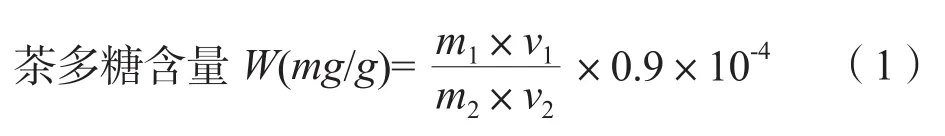
式中:m1为查得的含量,单位为μg;m2为称取的样品质量;V1为样品定容体积,单位为mL;V2为测定液的体积,单位为mL;0.9为换算系数。
1.2.3 DPPH自由基清除率测定
参考文献方法测定DPPH自由基清除率、羟基自由基和总还原力等[18-19]。准确称量DPPH试剂35.0 mg,用无水乙醇溶解后定容到100 mL的容量瓶中。移取1.00 mL上述溶液定容至50.0 mL的容量瓶中,摇匀后得到浓度为0.0178 mmol/L的DPPH溶液,该溶液在冰箱冷藏的条件下可长期使用。取样品溶液2.00 mL加入2.00 mL DPPH 溶液迅速混匀后避光反应30 min,于517 nm下测定。以无水乙醇调零后测定其吸光值。A0为空白样吸光度;A1为样品吸光度。
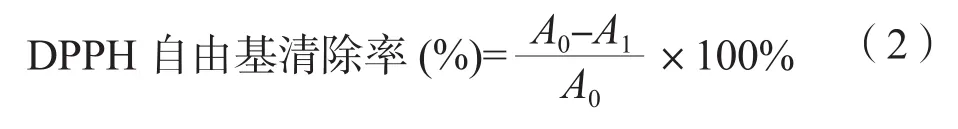
1.2.4 羟基自由基的清除率测定
准确取2.00 mL样液,加2.00 mL浓度为6 mmol/L的硫酸亚铁溶液,再加6 mmol/L等体积的过氧化氢溶液,混匀。再加2.00 mL浓度为6 mmol/L的水杨酸溶液,于37℃水浴中反应25 min。以去离子水为参比,在510 nm波长处测定吸光度Ai。试验同时进行空白对照和样品对照组测定。
式中:Ai为样品吸光值;Aj为样品对照组(样品与空白溶剂混合液)吸光值;Ac为空白对照(水杨酸与溶剂混合液)吸光值。
1.2.5 总还原力测定
总还原力测定采用相当于抗坏血酸的量来衡量。抗坏血酸标曲配置:配制出浓度分别为0 mg/L、20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L的标准样品,准确移取1.00 mL不同浓度待测液试管中,加入2.50 mL(pH6.6、0.2 mol/L)磷酸缓冲溶液,再加入2.50 mL的10 g/L的K3Fe(CN)6溶液,在50℃水浴振荡锅中反应20 min,冷却后再加2.50 mL 100 g/L的三氯乙酸溶液,于离心机中以3000 r/min离心5 min;吸取1.50 mL上清反应液至试管中,再加入1.0 g/L的FeCl3溶液(现配现用)0.50 mL。于暗处静置反应10 min,用去离子水校零。在700 nm波长处测定样品吸光值。
2 结果与分析
2.1 不同“金花”散茶中茶多糖含量
由图1可知,受发花过程的影响,茶多糖含量增加最显著的是茉莉花茶的下脚料,制成的“金花”茉莉花茶茶多糖含量从39.99 mg/g升至78.21 mg/g,获得了95%的提升;黑茶、绿茶在接种冠突散囊菌后获得的“金花”散茶茶多糖含量也获得了明显提升,分别提升43%和65%;提升程度最小的是红茶,提升23%。
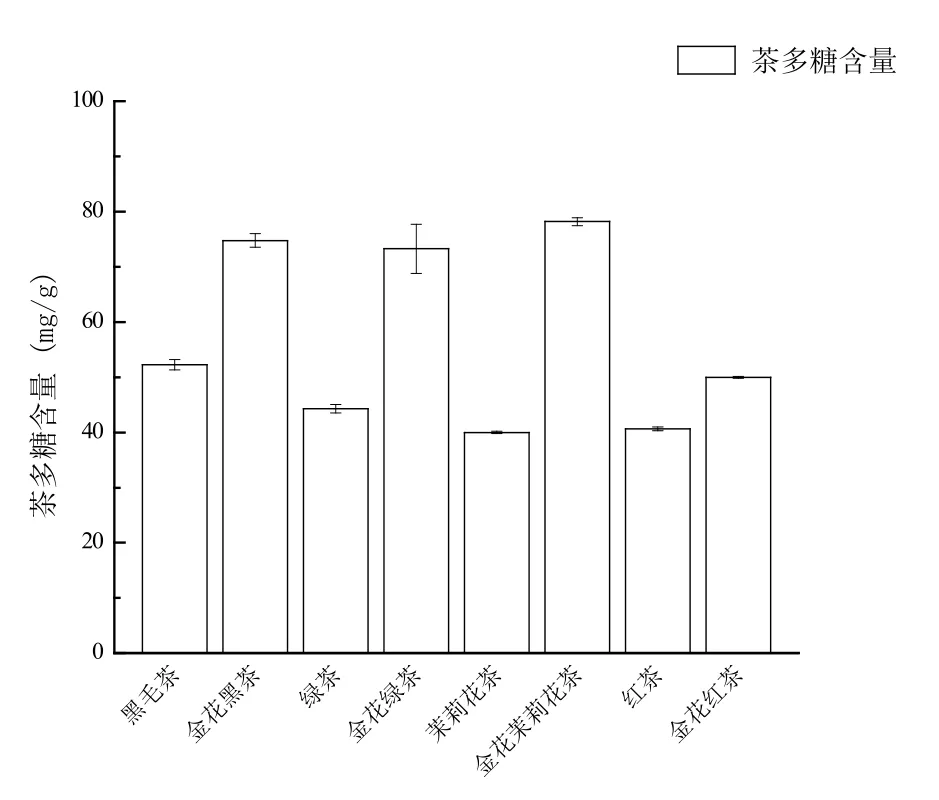
图1 茶叶中茶多糖含量Figure 1 Tea polysaccharides content in tea leaves
2.2 DPPH自由基清除能力
从不同茶叶中提取的茶多糖对DPPH自由基清除能力结果如图2所示。随着茶多糖溶液浓度的增加,对DPPH自由基清除能力增强,当浓度为10.0 mg /mL时,黑毛茶、“金花”黑茶、绿茶、“金花”绿茶、茉莉花茶、“金花”茉莉花茶、红茶、“金花”红茶对应的茶多糖对DPPH 自由基清除率分别为88.30%、94.15%、84.57%、89.36%、81.38%、83.51%、82.98% 和89.36%。相对于接种冠突散囊菌前的茶,从接种冠突散囊菌获得的“金花”散茶中提取的茶多糖对DPPH自由基清除能力都有增强。由图2的数据计算出DPPH自由基清除率为50%时所需不同茶叶茶多糖提取液浓度即其IC50值如图3所示。
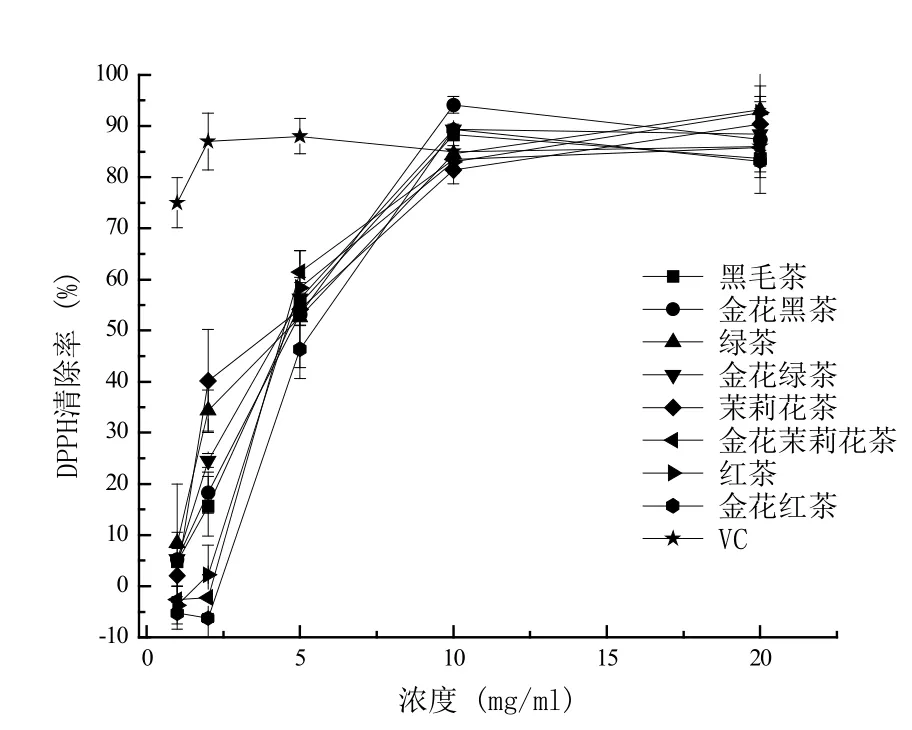
图2 不同茶叶的DPPH清除率Figure 2 DPPH scavenging rate of different tea leaves
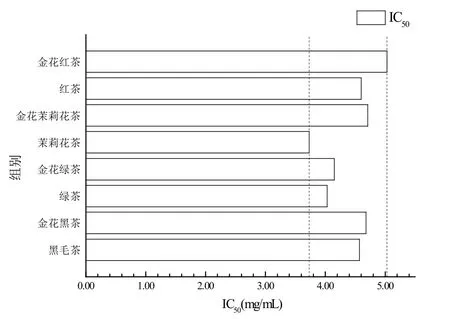
图3 不同茶叶的IC50值Figure 3 IC50 value of different tea leaves
2.3 羟基自由基清除能力
由图4可知,黑毛茶、“金花”黑茶、绿茶、“金花”绿茶、茉莉花茶、“金花”茉莉花茶、红茶、“金花”红茶对应的茶多糖对羟基自由基清除率分别为66.56%、66.00%、63.84%、70.38%、60.69%、76.58%、70.82%和45.29%。黑毛茶接种冠突散囊菌前后对羟基自由基清除率无明显变化;绿茶、茉莉花茶接种“金花”菌后对羟基自由基清除能力得到提高,分别提高6%和16%;红茶接种冠突散囊菌后对羟基自由基清除率有明显下降。
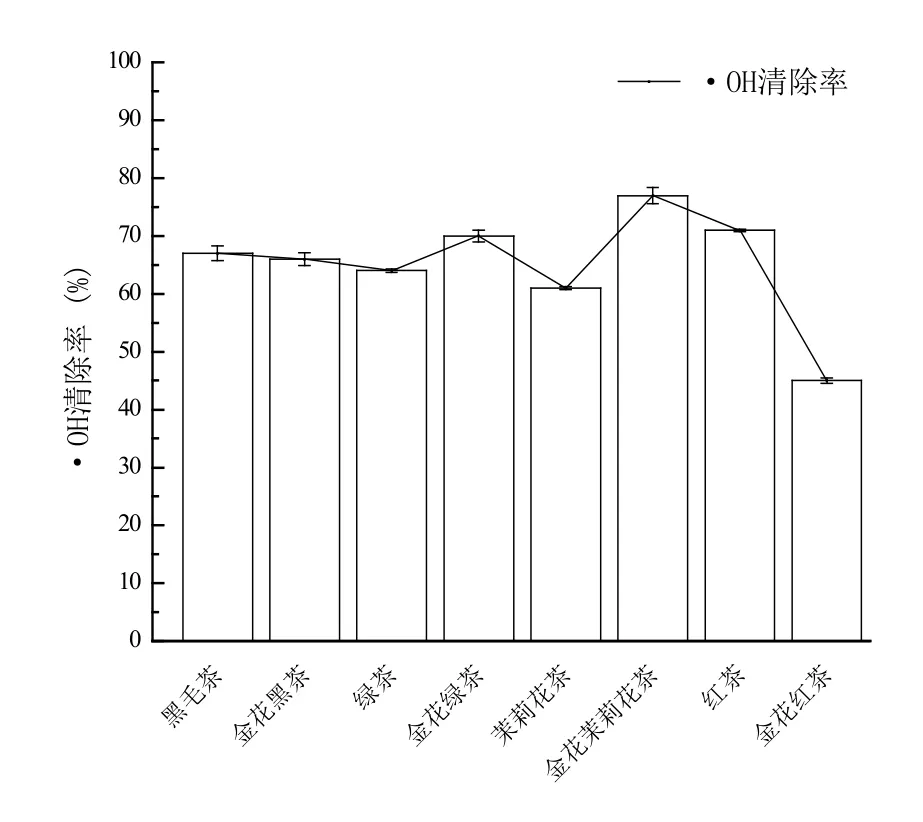
图4 不同茶羟基自由基清除率Figure 4 Scavenging rate of different tea hydroxyl radicals
2.4 总还原能力
由图5可知,8种茶每克的提取液总还原能力相当于浓度为58.5 ~ 79.5 mg/L的抗坏血酸,黑毛茶、“金花”黑茶、绿茶、“金花”绿茶、茉莉花茶、“金花”茉莉花茶、红茶、“金花”红茶总还原能力分别相当于抗坏血酸的量为 63.21 mg/L、72.49 mg/L、75.47 mg/L、74.61 mg/L、79.51 mg/L、75.33 mg/L、58.50 mg/L 和61.34 mg/L。茉莉花茶总还原能力最强,红茶总还原能力最弱。
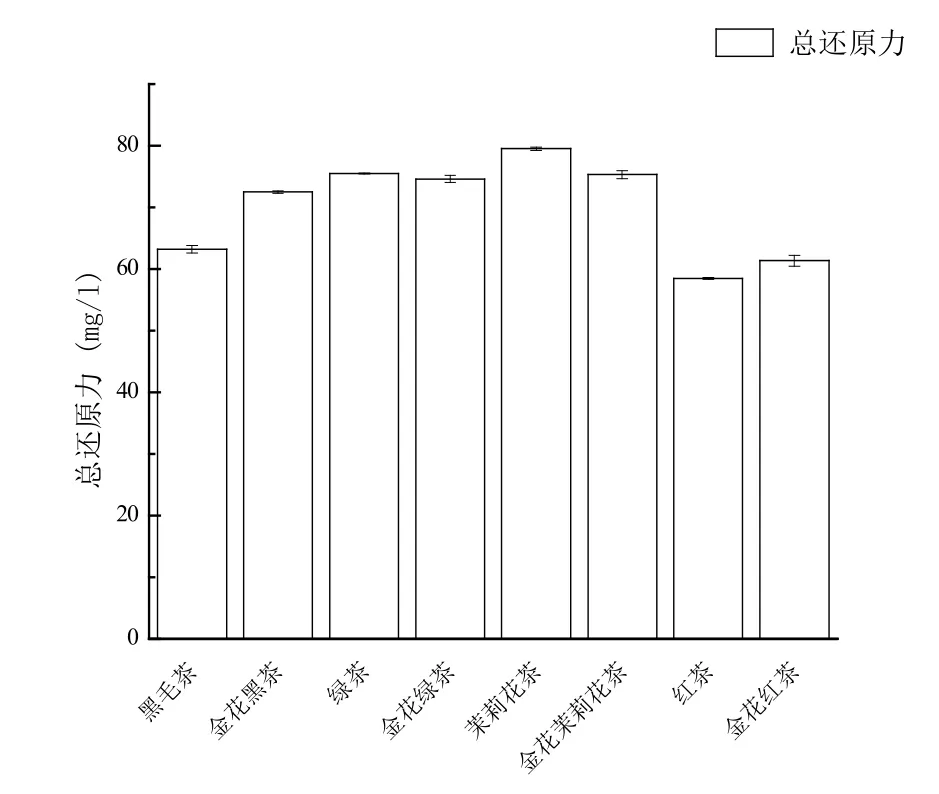
图5 不同茶叶的总还原能力Figure 5 Total reducing capacity of different tea leaves
3 讨论与结论
本试验研究以黑茶、绿茶、茉莉花茶和红茶的下脚料为原料,接种“金花”菌后制备对应的“金花”散茶,对比接种前后茶多糖含量以及抗氧化活性强弱变化,结合各项实验数据获得如图6所示的综合分析图。接种“金花”菌后茶叶中茶多糖含量都得到提升,其可能的原因是接种“金花”菌后冠突散囊菌在快速生长阶段分泌的胞外酶将茶叶中木质纤维素等分解为多糖类物质,使得多糖含量整体出现上升[15],同时冠突散囊菌子囊孢子中含的多糖物质也会使多糖含量出现上升[20]。四种茶发花前后的茶多糖抗氧化活性存在多样性与差异性,与文献报道的茶多糖抗氧化活性与茶种类、茶多糖结构及其蛋白质、多酚含量有关相符[17]。受冠突散囊菌的影响,四种不同下脚料茶茶多糖含量提升率和抗氧化活性的多样性及差异性产生的原因还需要进一步通过深入研究不同茶茶多糖的组成及结构等方面的差异,从而了解其产生差异的机制机理。
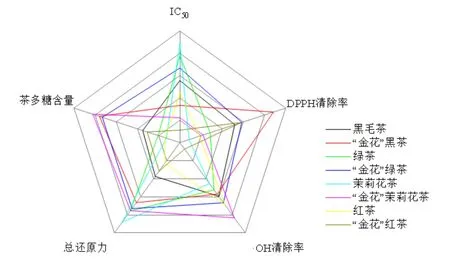
图6 不同茶的综合分析Figure 6 Comprehensive analysis of different tea products

