病死猪无害化处理关键菌株分析
王吉平, 张野, 王瑾, 苏天明, 谢育利,梁芷姮, 甘国勇, 杨振媚, 何铁光*
(1.广西壮族自治区农业科学院 农业资源与环境研究所,广西 南宁 530007;2.广西益谱检测技术有限公司,广西 南宁 530007)
中国是生猪养殖大国,2020年全国肉猪出栏头数达5.27亿头,猪肉产量4 100多万吨,远超牛羊肉类产量[1]。每年因疫病导致的生猪死亡率约为8%~12%[2]。2018年8月以来的非洲猪瘟,更是使生猪的死亡率大幅增加。据统计,中国每年病死猪数量高达6 000万头,未经无害化处理,自食、出售、丢弃等不当处理数量高达60%[3]。病死猪不当处理不仅会对环境造成严重污染,病原体的扩散也会威胁生猪养殖业的可持续发展,甚至增加人畜共患病的隐患[4]。当前,病死猪无害化处理主要包括焚烧法、掩埋法、化制法和生物发酵法。其中生物发酵法由于成本低,污染小的特性,已被广泛应用于病死畜禽无害化处理[5-7]。
病死畜禽生物发酵法无害化处理主要是通过添加微生物菌剂进行发酵。微生物菌剂是无害化发酵处理的重要部分[8-10]。当前,通过环境样品或堆肥样品筛选病死猪降解菌的研究较多。李海龙等[11]通过对锯末和病死猪的发酵堆肥样品中筛选得到两株芽孢杆菌N-3和Y-3,能高效降解蛋白质和脂肪,且接种后病死猪降解率超过96%,显著高于对照;肖翰等[12]从受油脂污染的样品中筛选分离得到6株具有降解油脂的菌株,其中黏质沙雷氏菌(Serratiamarcescens)对油脂的降解率达到57.21%,能显著降低病死猪堆肥后的油脂含量,加快物料腐熟。这些研究均为在未确定目标菌株的情况下,分离培养尽可能多的微生物再进行功能筛选,工作量大且效率不高。当前,已有许多市售商品级的微生物发酵菌剂,但对不同的物料类型和发酵工艺,其效果差异很大。因此,针对特定工艺对广适应型微生物菌剂进行进一步复配优化,对提高病死猪生物发酵法无害化降解处理效率和降低生产成本等具有重要意义。
随着当前生物信息学及高通量测序技术的发展,利用测序来研究环境或堆体中微生物群落组成已成为主流方法[13-14]。其中,细菌微生物群落多样性主要通过扩增16s rRNA基因的保守序列,再利用Illumina或Pacbio测序平台进行高通量测序和分析[15-16]。通过对已有的发酵体系进行微生物群落多样性测序,充分探明发酵过程中微生物群落变化,确定发酵过程中的优势微生物菌群,有针对性地培养分离目标菌株,将能有效提高菌株的筛选效率,对通用型微生物菌剂的再复配具有重要的指导作用。本研究将通过对已有的病死猪生物发酵无害化处理过程进行微生物群落多样性分析,研究不同发酵时期行使主要功能的微生物种类,找出特定工艺下病死猪降解的关键微生物,为病死猪无害化辅热发酵过程机理解析、发酵工艺和菌剂复配优化提供参考依据。
1 材料与方法
1.1 试验材料
试验病死猪由广西洁源动物无害化处理有限公司提供,辅料及其主要参数特性见表1。病死猪破碎后与蔗渣(鲜重)进行1∶1混合。使用的微生物发酵菌剂为多种嗜热好氧微生物复合菌剂。无害化处理发酵罐为卧式机械搅拌发酵罐,并配备完善的尾气废气处理设备。
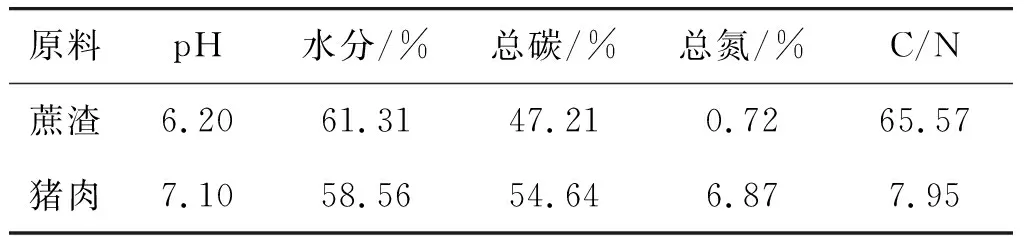
表1 原料主要参数特性Table 1 Main characteristics of raw materials
1.2 试验方法
辅热发酵无害化工艺流程如图1所示(发酵6 h后添加蔗渣充分可吸收血水),发酵前期温度控制在55 ℃,搅拌速率为6~10 r/min,保持17 h,后升温至85 ℃并保持约4 h,出料后进行后腐熟或作为原料与其他废弃物配比后堆制成生物有机肥。发酵过程中,初步混匀(约1 h)取样,升温至55 ℃后(约3 h)间隔1 h取样一次,采集的样品迅速保存在液氮中,用于提取DNA进行16s rDNA测序分析。

图1 病死猪生物发酵法无害化简要工艺流程Figure 1 Brief process of harmless biological fermentation of dead pigs
1.2.1 细菌群落多样性检测
将收集的样品进行总DNA提取,二代高通量测序采用引物341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT扩增16S rDNA的V3+V4区(约466 bp),使用Illumina平台进行测序,测序策略为PE250。三代全长测序采用引物27F:AGAGTTTGATCMTGGCTCAG;1492R:CRGYTACCTTGTTACGACTT扩增16s rDNA全长V1-V9区(约1 500 bp),并采用Pacbio平台进行全长测序。
1.2.2 数据分析
测序原始数据下机后,使用DADA2软件对Reads进行过滤、校正,并输出非冗余的Reads和对应的丰度信息,然后将Reads拼接为Tag,去除嵌合体Tag,获得用于后续分析的Tag序列和丰度,即ASV序列和ASV丰度信息,再对ASV序列进行注释,得到物种注释信息。比对数据库为Silva数据库(Silva Release 138.1,http://www.arb-silva.de)。数据处理及作图使用Microsoft office 2016软件。
2 试验结果
2.1 二代测序下的微生物群落结构随发酵时间变化情况
在基于Illumina平台的二代测序结果中,数据过滤后质量良好,Tags的N90长度约为430 bp,进行聚类和序列比对后,进行不同分类水平下微生物群落结构分析。通过α多样性分析表明,细菌群落的多样性随发酵时间呈现先降低后增加的趋势(见图2),说明发酵过程中,微生物群落的物种数目在发酵中期(11~17 h)最低,发酵中期的微生物菌群存在着优势微生物菌群。对各样本的细菌群落相对丰度进行分析,其中纲水平下不同纲的细菌相对丰度如图3所示,杆菌纲(Bacilli)的微生物相对丰度呈现先升高后降低的态势(7 h样品微生物群落组成发生较大变化,主要由于6 h取样后添加了1份蔗渣所致),且在发酵中期(10~17 h)占绝对优势(接近90%)。此外,发酵前期γ-变形杆菌纲(Gammaproteobacteria)为主要优势菌群,说明初始物料中含有较丰富的γ-变形杆菌纲的微生物;发酵前期放线菌纲(Actinobacteria)、梭菌纲(Clostridia)和α-变形菌纲(Alphaproteobacteria)的微生物相对丰度也较高,但随着发酵进程的进行,其相对含量不断降低。17 h后发酵罐升温至85 ℃时,Bacilli纲的微生物相对丰度出现下降态势,说明高温处理会使得发酵中期的优势菌群减少,从而导致其他菌群相对丰度上升。

图2 微生物群落丰富度指数随发酵时间变化Figure 2 Microbial community richness index changed with fermentation time
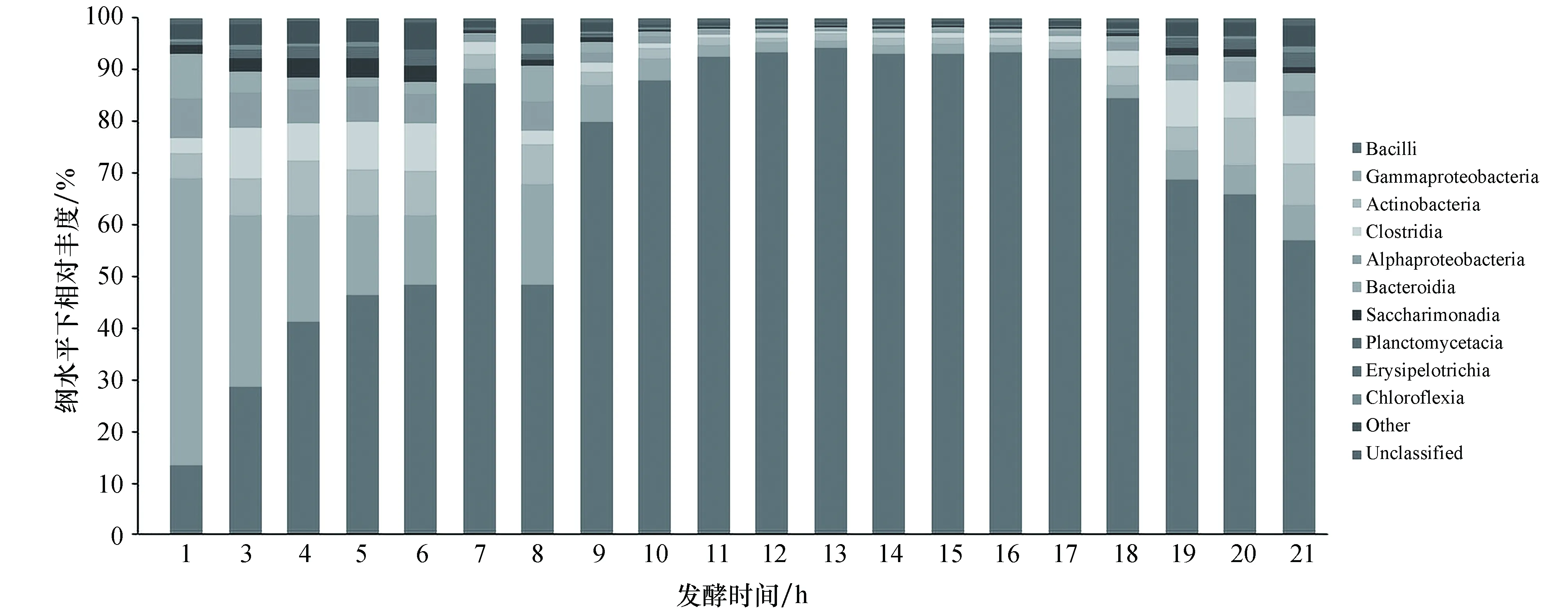
图3 纲水平下细菌群落相对丰度随发酵时间的变化Figure 3 Variation of relative abundance of bacterial community with fermentation time at class level
属水平下,发酵前期未分类和其他属的细菌相对丰度超过50%(见图4)。发酵初期,埃希氏-志贺氏菌属(Escherichia-Shigella)的微生物相对含量为21.62%,为单一属含量最高的细菌群落,这主要是病死猪肠道内携带的微生物。假交替单胞菌属(Pseudoxanthomonas)、假单胞菌属(Pseudomonas)和丛毛单胞菌属(Comamonas),7 h和8 h的样品分析结果表明,辅料蔗渣中主要携带的是假交替单胞菌属、其他属和未分类属的微生物。在发酵中期,芽孢杆菌属(Bacillus)的微生物相对丰度呈现先升高后降低的态势,且在发酵中期占绝对优势(接近90%)。综合纲水平和属水平下的分析结果表明,发酵过程中杆菌纲下芽孢杆菌属在降解病死猪的过程中起主要作用。

图4 属水平下细菌群落相对丰度随发酵时间的变化Figure 4 Variation of relative abundance of bacterial community with fermentation time at genus level
2.2 基于不同测序平台和策略下种水平的微生物群落结构分布和差异
在二代测序结果的基础上,选择1 h、6 h、14 h和21 h的DNA样品进行16s rDNA全长序列扩增,并采用Pacbio平台进行测序,对测序结果进行注释分析得到种水平下的物种组成。与二代测序的结果相比,三代测序鉴定到种水平的物种更多,且精细化程度更高。其中,二代测序结果中,14 h的样品中凝结芽孢杆菌(B.coagulans)占比达89.50%,具有绝对优势(见图5A);在三代测序结果中,芽孢杆菌属下种水平下鉴定到凝结芽孢杆菌和凝结芽孢杆菌A(B.coagulansA),分别占比61.21%和36.90%(见图5B)。另外,在发酵时间为1 h的样品中,二代测序结果丰度最高的为埃希氏-志贺氏菌属下的宋内志贺氏菌(S.sonnei),而三代测序结果丰度最高为大肠埃希氏杆菌(Escherichiacoli)和大肠杆菌福氏志贺菌(E.flexneri),说明三代测序由于其能测定16s rDNA的全长,在菌种鉴定,尤其是种水平上的鉴定具有更高的质量和准确度。同时,两次测序的结果在总体上是一致的,这为后续病死猪发酵菌株的筛选提供了可靠的研究基础。
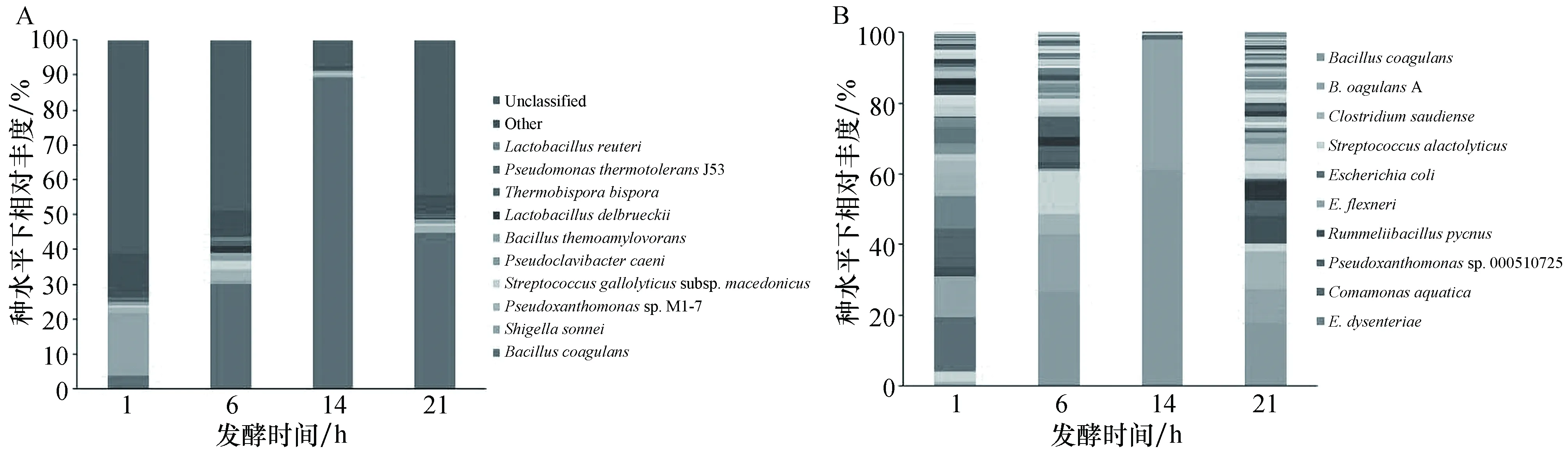
图5 不同测序策略的种水平下细菌群落相对丰度随发酵时间的变化Figure 5 Changes of relative abundance of bacterial community with fermentation time at species level of different sequencing strategies
2.3 微生物群落功能预测
对二代测序结果的微生物群落功能进行预测分析,利用PICRUSt2软件结合KEGG数据库的功能分类层级,分析代谢水平(Metabolism level)下的不同类型化合物代谢功能途径的丰度(用count值表示)。结果表明,发酵过程中,总代谢功能丰度随时间先增高后降低,其中碳水化合物代谢、氨基酸代谢、辅因子和维生素代谢、其他氨基酸代谢及脂质代谢等的功能丰度较高(见图6)。病死猪无害化发酵过程中,主要的代谢功能包括碳水化合物代谢、氨基酸代谢和脂质代谢。综合分析芽孢杆菌属的相对丰度和与病死猪无害化发酵降解有关的代谢途径的功能丰度,发现二者之间存在着较强的一致性,均呈现出随着发酵时间先增加后减少的趋势(见图7)。因此,综合发酵过程中的优势菌群和功能预测,我们判断在整个病死猪无害化过程中,起关键性重要作用的微生物种类为芽孢杆菌属,尤其是该属中占比约90%的凝结芽孢杆菌。

图6 微生物群落代谢功能丰度随发酵时间的变化Figure 6 Changes of metabolic function abundance of microbial community with fermentation time

图7 病死猪降解主要代谢功能丰度与Bacillus细菌群落相对丰度随发酵时间变化Figure 7 The main metabolic functions abundance and the relative abundance of Bacillus bacterial community changed with fermentation time of degradation in dead pigs
3 讨论与结论
病死猪生物发酵无害化处理过程中,微生物菌剂是提高处理效率的关键因素[17-19]。但不同的物料配方和处理工艺下最优微生物菌剂的复配有着较大差异。因此,针对不同物料配比和处理工艺,对添加复合菌剂发酵过程中关键功能微生物菌株进行分析,是指导菌剂优化复配、提高菌剂专一性和发酵降解效率的重要策略。通过对蔗渣和病死猪高温辅热好氧生物发酵无害化过程进行微生物群落多样性分析,我们发现发酵过程中微生物群落的丰富度指数呈现先降低后增加的趋势,这与户青青[20]接种微生物强化好氧堆肥微生物α多样性在发酵中期降低的研究结果一致。且微生物多样性结果表明,纲水平下杆菌纲和属水平下芽孢杆菌属微生物在发酵中期占绝对优势,是发酵降解病死猪等原料的主要功能微生物菌株。
综合二代和三代测序分析,相同分析策略下种水平微生物三代测序数据能鉴定得到的微生物种类更多,这是由于三代测序具有更长的读长,从而使其注释更为准确。两种测序结果均表明在种水平下,发酵中期(14 h)凝结芽孢杆菌类微生物为绝对优势的微生物种群。
对微生物群落功能的预测结果表明,发酵过程中代谢通路的功能丰度集中在病死猪和蔗渣降解的代谢途径上,且碳水化合物代谢、氨基酸代谢、脂质代谢等通路的代谢功能丰度与芽孢杆菌属的微生物相对丰度变化趋势一致。该结果充分表明在病死猪生物发酵法无害化处理过程中,凝结芽孢杆菌是其关键微生物,是后续菌剂优化复配的主要部分。下一步研究将通过增加凝结芽孢杆菌在微生物发酵菌剂的含量,加快优势菌群的形成速度,提高病死猪降解效率,降低菌剂生产成本。本研究为病死猪无害化处理过程机理解析、发酵工艺和菌剂复配优化提供了重要参考依据。

