土霉素治疗猪附红细胞体病小鼠模型的初步建立和验证
王 洋 韩金成 于 天 梁喜植 薛书江
(延边大学农学院动物医学系,吉林 延吉 133002)
0 引言
猪附红细胞体是引起猪传染性贫血的重要病原体之一,患病猪常表现出黄疸、贫血、发热、生殖障碍等临床症状。猪附红细胞体对所有年龄段的猪都易感。急性感染的仔猪在临床上常因溶血性贫血及低血糖发生急性死亡。在自然条件下,猪附红细胞体的急性感染情况较少,多为慢性感染。慢性感染的猪存在轻度贫血、生长速度降低、生殖性能变差等症状,并对呼吸系统和肠道系统的病原体有更高的易感性。另有研究表明,感染猪附红细胞体会引起母猪生殖能力下降、发情期延长、乳汁分泌障碍等。猪附红细胞体病多呈隐性感染,患病动物表现出的临床症状不明显,因此,该病常常被忽视,从而继发感染其他病原体。继发感染其他病原体的患病动物表现出复杂的临床症状,给临床诊断带来挑战,且预后效果不佳,易复发,直接影响养殖业的经济效益。因此,加强猪附红细胞体病防治研究意义重大。
相关文献资料表明,土霉素是治疗猪附红细胞体病比较理想的抗生素药物。然而,养殖中滥用抗生素会带来诸多危害,如使病原体产生耐药性,引起动物免疫机能下降,甚至畜产品药物残留会威胁人类健康,因此,深入研究猪附红细胞体病治疗机制,找到猪附红细胞体病无抗疗法替代抗生素治疗有重要意义。鉴于此,该试验初步建立土霉素治疗猪附红细胞体病小鼠模型,为猪附红细胞体病抗生素替代药物筛选和治疗机制的深入研究提供助力。
1 试验材料与方法
1.1 试验试剂和仪器
质粒提取试剂盒(Plasmid Mini Kit I)、血液DNA提取试剂盒(Gel Extraction Kit)和菌体DNA全基因提取试剂盒购自OMEGA公司。猪外周血淋巴细胞分离液购自索莱宝公司。肝素锂抗凝管、血液生化试剂盘购自吉林省博爱乐康商贸有限公司。胰蛋白胨、酵母淀粉、NaCl、琼脂粉、枸橼酸钠、柠檬酸和葡萄糖等均购自宝生物工程(大连)有限公司。盐酸土霉素购自上海生工生物有限公司。
1.2 试验动物与病原
清洁级4周龄昆明种小白鼠45只,体质量在(23±1)g,购自延边大学实验动物中心;猪附红细胞体阳性血液采自延边州某猪场;猪附红细胞体分离和纯化参照华修国采用的方法。弗格森埃希菌JL菌株由延边大学预防兽医学实验室分离鉴定及 保存。
1.3 试验动物分组与处理
对小鼠进行尾尖采血,提取血液DNA,并进行PCR检测。将PCR检测鉴定无猪附红细胞体感染的昆明种小白鼠平均分为3组,每组15只。A组为空白对照组,腹腔注射100 μL生理盐水;B组为阴性对照组,腹腔注射100 μL浓度为1×10个/μL的猪附红细胞体;C组为治疗模型组,腹腔注射100 μL浓度为1×10个/μL的猪附红细胞体,经PCR检测确认感染,在接种猪附红细胞体第4天肌内注射土霉素,连续注射3 d(时间分别为接种猪附红细胞体第4天、第5天、第6天),注射剂量为0.016 65 mg/g。
1.4 小鼠一般性临床症状观察
从接种第1天开始计,观察整个试验周期(30 d)内昆明种小白鼠的精神状态及临床症状。利用电子天平在接种第1天、第5天、第10天、第15天、第20天、第25天、第30天测量昆明种小白鼠的体质量,记录并计算每5 d昆明种小白鼠的平均日增质量。利用电子体温计在接种第1天、第4天、第7天、第10天、第13天、第16天、第19天、第21天、第24天、第27天、第30天测量昆明种小白鼠耳内温度,记录整个试验周期昆明种小白鼠体温变化情况。对平均日增质量和体温变化进行统计学分析。
1.5 小鼠血液样本的PCR检测
对各组昆明种小白鼠在接种后第1天、第3天、第5天、第7天、第14天、第21天、第28天、第30天进行尾尖采血。根据血液DNA提取试剂盒说明书提取DNA。采用于啸洋建立的猪附红细胞体PCR诊断方法对血液样本进行PCR检测,确定各组小鼠的猪附红细胞体感染情况。
1.6 小鼠的血液学指标检测
在接种第7天,分别在A、B、C组随机选取5只昆明种小白鼠进行眼球采血。小鼠血液用肝素锂抗凝,使用普朗医疗血液常规分析仪检测小鼠血常规。用移液器吸取100 mL EDTA抗凝全血加入生化试剂盘中,将试剂盘放入斯马特全自动生化分析仪中检测各组小鼠血液生化指标。
1.7 小鼠继发感染弗格森埃希菌试验
根据相思宇对弗格森埃希菌LD的测定结果,在接种猪附红细胞体第7天,分别在A、B、C组随机选取5只昆明种小白鼠注射LD剂量的(2.944×10CFU)弗格森埃希菌,记录各组动物数、死亡数,计算死亡率并进行统计学分析。
1.8 数据处理
采用EXCEL 2010与SPSS统计软件对所得数据进行方差分析,试验数据以“平均值±标准误”表示。根据统计结果,当0.01<<0.05时,表示差异显著;当<0.01时,表示差异极显著;当>0.05时,表示差异不显著。
2 试验结果与分析
2.1 小鼠一般性临床症状观察
在整个试验周期内,A组(空白对照组)小鼠无临床症状;B组(阴性对照组)小鼠出现精神萎靡、扎堆、被毛逆立等临床症状;C组(治疗模型组)经土霉素治疗后小鼠临床症状消失,恢复正常。
如表1所示,接种后5~10 d,与A组相比,B组小鼠平均日增质量减少,差异极显著(<0.01);C组与A组相比平均日增质量差异不显著(>0.05)。其他时间,各组平均日增质量均差异不显著。结果表明,经土霉素治疗后,C组小鼠日增质量减少有显著改善。

表1 各组小鼠平均日增质量测定结果 g/d
如表2所示,与A组相比,B组在接种后第4天体温降低,第7~19天体温升高,差异显著 (<0.05);C组与A组相比体温变化均差异不显著。结果表明,经土霉素治疗后,C组小鼠体温变化有显著改善。
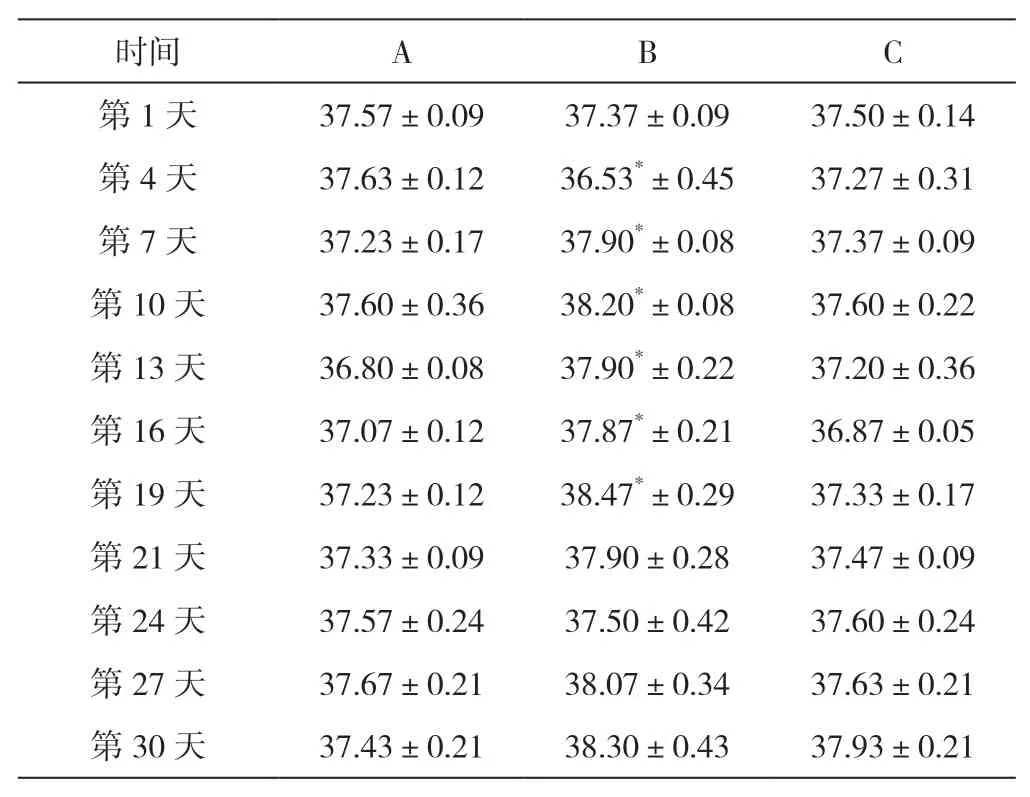
表2 各组小鼠体温测定结果 ℃
2.2 小鼠血液样本的PCR检测
以模型小鼠血液DNA为模板进行PCR扩增,结果显示,A组在整个试验周期内并未检测到特异性条带,B组出现特异性条带,C组治疗前出现特异性条带,治疗后条带消失,与预期结果相符。
2.3 小鼠的血液学指标检测
对各组昆明种小白鼠进行眼球采血,并进行血常规及血液生化指标检测。如表3所示,与A组小鼠相比,B组小鼠白细胞数、淋巴细胞数、粒细胞数、血红蛋白含量及血小板含量降低,差异极显著 (<0.01);淋巴细胞百分比、血小板压积减小,差异显著(<0.05);血小板分布宽度增大,差异显著 (<0.05)。与B组小鼠相比,C组小鼠血红蛋白含量和血小板含量显著升高(<0.01)。与A组小鼠比较,C组小鼠白细胞数量降低,差异极显著 (<0.01);淋巴细胞数、粒细胞数降低,差异显著 (<0.05)。结果表明,猪附红细胞体感染会引起小鼠白细胞数量、淋巴细胞数、粒细胞数、血红蛋白含量及血小板含量降低,淋巴细胞百分比、血小板压积减小,血小板分布宽度增大,经土霉素治疗,淋巴细胞百分比、血红蛋白含量、血小板含量、血小板压积等指标恢复正常,但白细胞数、淋巴细胞数、粒细胞数均未恢复正常。

表3 各组小鼠血常规检测结果
如表4所示,与A组小鼠相比,B组小鼠球蛋白、丙氨酸氨基转移酶和碱性磷酸酶含量显著升高(<0.05),白球比显著降低(<0.05);与B组相比,C组小鼠球蛋白、丙氨酸氨基转移酶和碱性磷酸酶含量降低,差异显著(<0.05)。结果表明,猪附红细胞体感染会引起球蛋白、丙氨酸氨基转移酶和碱性磷酸酶含量降低,白球比升高,可能对昆明种小白鼠肝脏造成损伤,从而引起机体黄疸,而土霉素针对猪附红细胞体感染引起的症状能起到良好的治疗作用。
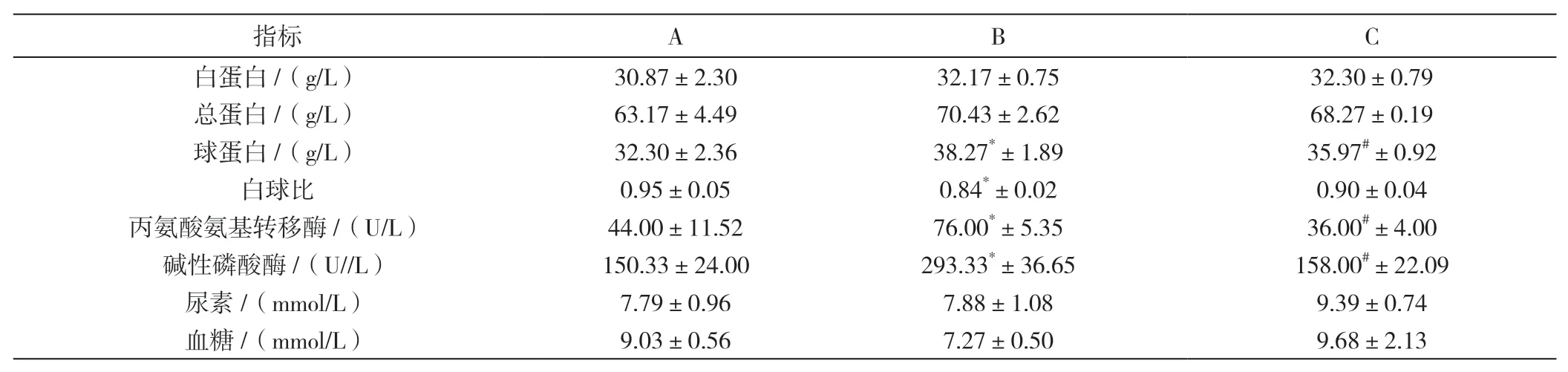
表4 各组小鼠血液生化指标检测结果
2.4 各组小鼠继发感染弗格森埃希菌试验
如图1所示,在感染高峰(猪附红细胞体接种后第7天),与A组、C组相比,B组小鼠死亡率显著升高(<0.01)。结果表明,猪附红细胞体感染后继发感染弗格森埃希菌会提高昆明种小白鼠的死亡率,而经土霉素治疗后死亡率显著降低。

图1 猪附红细胞体感染第7天继发感染弗格森埃希菌 对昆明种小白鼠死亡率的影响
3 讨论
该试验采用分离纯化的猪附红细胞体感染未切脾的昆明种小白鼠,猪附红细胞体感染剂量为1×10个/只。对整个试验周期的昆明种小白鼠进行精神状态、体质量及体温监测,结果发现,昆明种小白鼠感染猪附红细胞体后出现精神萎靡、扎堆、被毛逆立等临床症状;B组在猪附红细胞体感染后5~10 d平均日增质量显著低于其他组,表明猪附红细胞体感染导致昆明种小白鼠的日增质量下降,与Messick等的研究结果一致;体温监测结果表明,猪附红细胞体感染能够使昆明种小白鼠体温异常,与前人研究一致。另外,Hoelzle等认为传统的抗生素和卫生管控方法不能将猪附红细胞体从感染猪体内完全清除,虽然其临床症状消失,但仍是猪附红细胞体的隐性携带者。该试验感染猪附红细胞体的昆明种小白鼠经土霉素治疗后,PCR检测未出现特异性条带。
血常规检测结果显示,昆明种小白鼠感染猪附红细胞体后,白细胞数、淋巴细胞数、粒细胞数、血红蛋白含量及血小板含量降低,其余指标无显著性变化,治疗模型组治疗后白细胞数、淋巴细胞数和粒细胞数并未恢复,其余指标恢复正常。与王洋等研究不同的是,该试验B组小鼠血常规检测中白细胞数量减少。猪附红细胞体本身属于血液系统疾病,主要侵害红细胞,可使患病动物免疫力下降,且该试验使用分离纯化的猪附红细胞体为感染源对昆明种小白鼠进行急性感染,白细胞数量减少常出现于血液系统疾病和自身免疫系统疾病中,一些急性感染也可导致白细胞数量减少。因此,该试验检测到的B组小鼠白细胞数量减少可能是由上述原因造成的。血常规检测结果表明,猪附红细胞体主要侵害骨髓和红细胞,导致造血功能低下,出现贫血,这与Hoelzle等研究结果一致。以往研究并未对猪附红细胞体感染小鼠的血液生化指标进行检测,多进行血常规检测,该试验对各组小鼠进行贫血和黄疸相关血液生化指标检测,以便更加全面地验证土霉素治疗猪附红细胞体病小鼠模型。B组小鼠的碱性磷酸酶(ALP)显著升高,病理学观察发现B组小鼠皮下轻微黄染,C组和A组小鼠无黄染现象,证明猪附红细胞体能够导致动物体出现黄疸的临床症状,经土霉素治疗后指标恢复正常。这也进一步说明该研究初步建立的土霉素治疗猪附红细胞体病小鼠模型是成功的。
猪附红细胞体多呈隐性感染,容易继发感染其他病原体,继发感染其他病原体的患病动物表现出复杂的临床症状,为该病的诊疗带来极大的困难。为了模拟现实中的继发感染,该试验设计了小鼠继发感染试验。由于弗格森埃希菌具有致病力弱、环境常在、人畜共患、条件致病等特点,更能凸显出治疗猪附红细胞体病对小鼠的影响,且更接近现实环境,因而选择弗格森埃希菌作为再次感染病原。结果表明,经土霉素治疗后,感染猪附红细胞体的小鼠死亡率与未感染猪附红细胞体的小鼠死亡率差异不显著。这也进一步验证该研究初步建立的治疗模型是成功的。
综上,该研究初步建立了土霉素治疗猪附红细胞体病小鼠模型,并在一般指标、临床症状、血液学指标和继发感染等方面验证了土霉素治疗猪附红细胞体病小鼠模型的成功。该模型可为猪附红细胞体病治疗药物的筛选和该病治疗机制的研究提供参考数据。

