外源油菜素内酯对美乐葡萄光合特性和果实品质的影响
乔子纯,贺琰,代红军,梁新华
(1宁夏大学农学院,宁夏银川 750021;2宁夏大学生命科学学院,宁夏银川 750021)
0 引言
【研究意义】绿色植物90%~95%的干物质来源于光合作用生成的有机物,因此,提高光合作用效率可实现增加作物产量的目的(王启泉,2020)。植物内部因素和外界环境条件因素均会影响其光合速率(吴杨等,2021),可通过调控植物的内在因素如叶绿素浓度和碳循环中关键酶活性等来提高光能吸收、传递和转换效率,在实际生产过程中,可通过对植物喷施外源植物生长调节剂提高光合速率(李进春,2013)。油菜素内酯类化合物(Brassinosteroids,BRs)不仅在植物生长发育中具有重要的调控作用,还可提高植物在逆境中的抗性(栾丽英,2014),缓解极端环境对植株光合作用的影响,提高果实品质,同时减轻农药毒害,促进农药代谢(沈瑛和陈振宇,1999),且BRs物质的活性非常高,是目前世界上公认的高效、广谱、无毒的植物生长调节剂(Bajguz and Hayat,2019),因此BRs在实际生产中具有广阔的应用前景。宁夏贺兰山东麓是我国酿酒葡萄的重要栽培产区之一,也是我国优质酿酒产区代表(达海莉和张治华,2015),美乐(Vitis vinferaL.cv.Merlot)是该产区主栽的中晚熟品种,其果实品质一直受种植者和酿酒师的重点关注。但随着全球气候变暖,宁夏的气候也发生了较明显变化,极端天气的发生对贺兰山东麓的酿酒葡萄产区有一定影响。因此,研究2,4-表油菜素内酯(2,4-epibrassinolide,EBR)在酿酒葡萄上的应用具有非常重要的意义。【前人研究进展】已有研究表明,对网纹甜瓜喷施BR后,可显著提高甜瓜的净光合速率(张永平等,2012);BR可增强沙棘苗木的抗旱性,推测可能是由于BR促进气孔关闭(韩刚和李凯荣,2011);EBR可缓解大豆幼苗(魏鑫等,2016)和烟草(丁丹阳等,2018)在干旱胁迫下、紫花苜蓿(覃凤飞等,2020)在高温弱光胁迫下对光合速率的影响,提高光合速率和抗氧化酶活性;此外,BR还可提高番茄幼苗在低温逆境条件下的抗氧化能力、保护光合系统和维持渗透平衡(王光正等,2021),从而提高植物的抗逆性。有研究发现,对草莓幼叶喷施一定量的BR后,可促进果实可溶性总糖积累,果实提前成熟,显著提高果实品质(Aaby et al.,2012);在种植前用不同浓度BR浸泡半夏块茎,可改善其品质,提高产量(肖雨申等,2021)。冯晓雪(2014)研究发现在幼果期和果实膨大期喷施不同浓度的BRs能提高红地球葡萄的坐果率,促进花粉发芽,提高可溶性糖并降低可滴定酸,提高葡萄的产量和品质。Vergara等(2018)、Babalık等(2019)、Zheng等(2020)研究表明,BR处理可提高葡萄果实的含糖量,降低可滴定酸含量,促进花色苷积累。【本研究切入点】近年来,有关BRs对酿酒葡萄的研究主要集中在调控葡萄花色苷的合成及对葡萄内源激素的影响(马立娜,2012;张晖,2014),但关于BRs对酿酒葡萄生理生化及品质影响的基础研究较少。【拟解决的关键问题】以美乐葡萄为试材,研究EBR处理对其光合特性和果实品质的影响,筛选出EBR有利于酿酒葡萄提高果实品质的合理浓度,为BRs在酿酒葡萄上的应用提供理论依据。
1 材料与方法
1.1 试验地概况及试验材料
于2019年6—10月,在国家葡萄产业技术体系水分生理与节水栽培岗位科学家试验基地(东经106°01′43″,北纬38°14′25″)进行,该基地位于宁夏贺兰山东麓产区,属中温带干旱气候区,昼夜温差较大,全年活动积温3400~3800℃,平均无霜期160~180 d,光照充足,适宜酿酒葡萄的生长。该地区引黄河水灌溉,年降水量180~200 mm,风沙土土壤,土层深40~100 cm,土壤pH<8.5。以11年生美乐葡萄为供试材料,倒L形整形,东西行向,株行距为0.5 m×3.0 m,采用正常的田间管理。EBR购自大连美仑生物科技有限公司。
1.2 试验方法
试验设3个浓度的EBR(纯度>90%)处理,分别为0.2、0.4和0.6 mg/L;以吐温-80作展开剂,利于EBR在98%乙醇中溶解,再分别稀释至相应的3种浓度,最终,溶液中乙醇和吐温-80的浓度均为0.1%(v/v)。选取120株长势一致的植株,于2019年7月5日(花后30 d,果实膨大期)进行处理,将配制好的EBR溶液分别均匀喷施至果树叶幕上,直至叶幕滴水为止,以喷施清水作对照(CK),每个浓度处理设3次重复,每个重复10株葡萄。
分别在花后40、50、60、70、80、90和100 d采样,随机采集果粒和结果枝上从基部往上4~6片的功能叶,之后液氮速冻,于-80℃冰箱保存备用。采集果粒用于测定葡萄果实着色率和品质各项指标,采集叶片用于测定叶绿素含量和RuBP羧化/加氧酶(Rubisco)活性,各处理随机选择3株长势一致植株,对已标记的叶片进行光合参数测定。
1.3 测定项目及方法
1.3.1 光合参数测定在果实膨大期(2019年7月11日)、转色期(2019年8月11日)和成熟期(2019年9月15日)各选取1 d,于9:00、11:00、13:00、15:00和17:00分别对已标记的叶片进行光合指标测定,使用3051D光合测定仪(浙江托普云农科技股份有限公司)测定叶片的光合参数,包括净光合速率、蒸腾速率和气孔导度3项指标。
1.3.2 叶绿素a、b和类胡萝卜素含量及Rubisco活性测定用80%丙酮∶95%乙醇=1∶1的直接浸提法(潘静和韩蕾,2017)提取比色,测定叶绿素a、叶绿素b、叶绿素ab和类胡萝卜素含量,根据公式得出:叶绿素a浓度,Ca=12.7×A663-2.69×A645;叶绿素b浓度,Cb=22.9×A645-4.86×A663;叶绿素ab浓度,Cab=8.02×A663+20.20×A645;类胡萝卜素浓度,Cx·c=(1000×A470-2.05×Ca-114.8×Cb)/245。
参照Cheng和Fuchigami(2000)的方法并稍作修改,测定Rubisco活性。在紫外分光光度计酶动学功能下,以不加酶提取液为参照,340 nm读取吸光值,每隔30 s自动读取一次,共3 min。
1.3.3 果实着色率、果实品质及花色苷含量测定参照马文婷(2015)的方法记录果实着色率;参照高俊凤(2006)的方法,分别采用蒽酮硫酸法、间苯二酚闭塞法和3,5-二硝基水杨酸法测定果实可溶性总糖和还原糖含量;参照GB/T 12456—2008《食品中总酸的测定》,采用指示剂法测定可滴定酸含量;采用Follin-Danies法(柳巧禛,2018)测定果实单宁含量;采用Folin-Ciocalteus法(柳巧禛,2018)测定果实总酚含量;采用pH示差法(刘洪梅等,2009)测定果实花色苷含量。
1.4 统计分析
采用DPS 7.05对试验数据进行统计分析,Origin 8.0制图,以LSD法进行多重比较并检测差异显著性,并对净光合速率与光合关键酶活性及光合色素进行相关分析。
2 结果与分析
2.1 喷施不同质量浓度EBR对美乐葡萄不同生育期光合特性的影响
2.1.1 对净光合速率日变化的影响如图1所示,对美乐葡萄的叶幕进行不同浓度EBR处理后,其叶片在果实膨大期、转色期和成熟期的净光合速率均呈现出典型的双峰型曲线“午休”特征。在果实膨大期和转色期测定净光合速率日变化的过程中,0.2 mg/L EBR处理的净光合速率均显著高于对照(P<0.05,下同),0.6 mg/L EBR处理的净光合速率在果实膨大期9:00显著低于对照。在果实膨大期,0.2和0.4 mg/L EBR处理的净光合速率平均值较对照分别提高24.05%和18.38%,而0.6 mg/L EBR处理的净光合速率平均值较对照降低3.56%;在转色期,0.2、0.4和0.6 mg/L EBR处理的净光合速率平均值较对照分别提高20.72%、8.00%和5.18%;在成熟期,3个浓度处理的净光合速率平均值较对照分别提高6.65%、13.87%和4.37%。可见,0.2 mg/L EBR处理在果实膨大期和转色期对美乐葡萄净光合速率的提高效果较好,而0.4 mg/L EBR处理在成熟期对净光合速率的提高效果较好;3个浓度处理在转色期和成熟期均可提高美乐葡萄的净光合速率,而0.6 mg/L EBR处理在果实膨大期会降低净光合速率。
2.1.2 对蒸腾速率日变化的影响如图2所示,对美乐葡萄的叶幕进行不同浓度EBR处理后,果实膨大期、转色期和成熟期上午的蒸腾速率峰值明显高于下午,成熟期的双峰型曲线特征与其他2个时期相比不明显。在果实膨大期测定蒸腾速率日变化的过程中,0.2和0.4 mg/L EBR处理均显著高于对照,其中在11:00和15:00,0.4 mg/L EBR处理显著高于其他处理,0.6 mg/L EBR处理的蒸腾速率除了在11:00与对照差异不显著(P>0.05,下同),其余时间点均显著高于对照;在转色期测定蒸腾速率日变化的过程中,0.4 mg/L EBR处理的蒸腾速率始终显著高于对照。在果实膨大期,0.2、0.4和0.6 mg/L EBR处理的蒸腾速率平均值较对照分别提高41.89%、69.59%和32.43%,在转色期较对照分别提高18.13%、48.35%和19.23%,在成熟期较对照分别提高14.36%、27.23%和15.84%。因此,对美乐葡萄进行不同浓度的EBR处理后,各处理在果实膨大期、转色期和成熟期均可提高蒸腾速率,其中0.4 mg/L EBR处理的提高效果较好。
2.1.3 对气孔导度日变化的影响如图3所示,对美乐葡萄的叶幕进行不同浓度EBR处理后,3个物候期上午的气孔导度峰值均明显高于下午。在果实膨大期9:00,0.2 mg/L EBR处理的气孔导度显著高于其他处理,在13:00、15:00和17:00,各处理均显著高于对照。在转色期和成熟期的11:00,0.2和0.4 mg/L EBR处理的气孔导度显著高于对照,在9:00和15:00,各处理气孔导度均显著高于对照。在果实膨大期,0.2、0.4和0.6 mg/L EBR处理的气孔导度平均值较对照分别提高17.34%、20.87%和5.08%,在转色期较对照分别提高11.26%、22.28%和11.18%,在成熟期较对照分别提高6.44%、16.41%和9.45%。因此,对美乐葡萄进行不同浓度的EBR处理后,0.4 mg/L EBR处理在3个时期对气孔导度的提高效果均较好;在果实膨大期,0.2 mg/L EBR处理对气孔导度的提高效果与0.4 mg/L EBR处理接近,在成熟期,0.6 mg/L EBR处理的提高效果优于0.2 mg/L EBR处理。
2.2 喷施不同质量浓度EBR对美乐葡萄叶片光合关键酶活性和光合色素的影响
2.2.1 对Rubisco活性的影响如图4所示,对美乐葡萄的叶幕进行不同浓度EBR处理后,在花后40 d,0.2和0.4 mg/L EBR处理的Rubisco活性显著高于对照,分别提高21.74%和31.30%,而0.6 mg/L EBR处理显著低于对照,降低36.90%;在花后60~90 d,3个浓度EBR处理的Rubisco活性均显著高于对照。结果表明,在处理前期,0.6 mg/L EBR处理会降低美乐葡萄Rubisco活性,在成熟过程中,0.4 mg/L EBR处理较其他2个处理对Rubisco活性提高效果较好。
2.2.2 对光合色素的影响如表1所示,对美乐葡萄的叶幕进行不同浓度EBR处理后,在花后40 d,各处理的叶绿素a、叶绿素ab和类胡萝卜素含量与对照相比差异不显著;在花后50 d,各处理的叶绿素a含量均显著高于对照,其中0.2 mg/L EBR处理显著高于其余处理,0.4 mg/L EBR处理的叶绿素b和类胡萝卜素含量显著高于对照;在花后60 d,0.4 mg/L EBR处理的叶绿素a、叶绿素b和叶绿素ab含量均显著高于对照,分别提高8.24%、9.04%和14.41%;在花后70 d,0.2和0.4 mg/L EBR处理的类胡萝卜素含量显著高于对照,分别提高12.76%和9.38%;在花后80和90 d,0.4 mg/L EBR处理的叶绿素b、叶绿素ab和类胡萝卜素含量均显著高于对照,在花后80 d,0.6 mg/L EBR处理的类胡萝卜素含量显著高于对照,在花后90 d,0.2 mg/L EBR处理的叶绿素b和类胡萝卜素含量显著高于对照;在花后100 d,0.4和0.6 mg/L EBR处理的叶绿素a含量显著高于对照,0.6 mg/L EBR处理的叶绿素ab含量显著高于对照,各处理均显著提高类胡萝卜素含量。结果表明,美乐葡萄经不同浓度的EBR处理,在转色期前,0.4 mg/L EBR处理对叶绿素b和类胡萝卜素含量的提高效果较好,0.2 mg/L EBR处理对叶绿素a和叶绿素ab含量的提高效果较好,0.4 mg/L EBR处理在转色期均可提高叶绿素a、叶绿素b、叶绿素ab和类胡萝卜素含量,0.6 mg/L EBR处理在转色期会减少叶绿素b和叶绿素ab含量,在成熟期对4个指标均有一定的提高效果。

表1 不同浓度EBR在果实膨大期前处理对美乐葡萄光合色素的影响(mg/g)Table 1 Effects of EBR treatments of different concentrations on photosynthetic pigments of Merlot grape before fruit expansion stage(mg/g)
2.2.3 净光合速率与光合关键酶活性和光合色素的相关分析如表2所示,对美乐葡萄的叶幕进行不同浓度EBR处理后,与对照相比,各处理均可增加净光合速率与Rubisco活性及叶绿素a、叶绿素b、叶绿素ab和类胡萝卜素含量的相关性。其中,0.2 mg/L EBR处理的净光合速率与叶绿素a、叶绿素b、叶绿素ab和类胡萝卜素含量均呈显著相关;0.4 mg/L EBR处理的净光合速率与类胡萝卜素含量呈极显著相关(P<0.01),与叶绿素a、叶绿素b和叶绿素ab含量呈显著相关;0.6 mg/L EBR处理的净光合速率与Rubisco活性及叶绿素b、叶绿素ab和类胡萝卜素含量呈显著相关。因此,与其他处理相比,0.4 mg/L EBR处理对净光合速率与各个光合色素相关性的提高效果较好。

表2 不同浓度EBR处理下美乐葡萄叶片净光合速率与光合关键酶和光合色素的相关分析Table 2 Correlation analysis of correlation between net photosynthetic rate of Merlot grape leaves and photosynthetic key enzymes and pigments under EBR treatments of different concentrations
2.3 喷施不同质量浓度EBR对美乐葡萄果实品质的影响
2.3.1 对果实着色率的影响在花后60 d,EBR处理均显著提高美乐葡萄果实着色率,其中0.6 mg/L EBR处理最高,果实着色率达22.41%,是对照的2.42倍;在花后70 d,0.6 mg/L EBR处理的果实着色率显著高于对照,而0.2和0.4 mg/L EBR处理与对照无显著差异;在花后80 d,0.2和0.4 mg/L EBR处理的果实着色率显著高于对照,在花后90 d,各处理的果实均已完成转色(表3)。
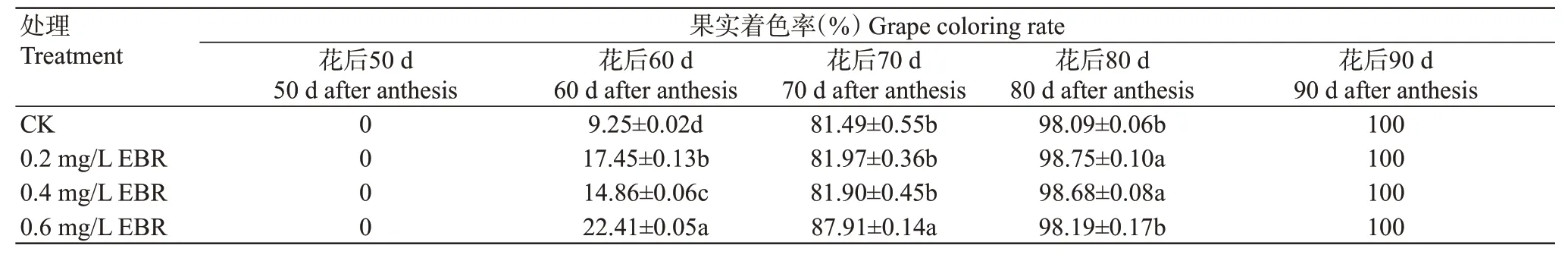
表3 不同浓度EBR处理对美乐葡萄果实着色率的影响Table 3 Effects of EBR treatments of different concentrations on the fruit coloring rate of Merlot grape
2.3.2 对成熟期果实品质的影响成熟期不同浓度EBR处理对美乐葡萄果实品质的影响如表4所示。在果实采收期,各EBR处理的可滴定酸含量均显著低于对照;0.2 mg/L EBR处理可促进可溶性总糖和还原糖的积累,0.6 mg/L EBR处理的可溶性总糖和还原糖含量低于对照;各EBR处理均可显著降低总酚和单宁含量,其中0.4 mg/L EBR处理的总酚和单宁含量含量最低,分别为5.26和7.59 mg/g;各EBR处理均促进浆果花色苷的积累,但与对照相比差异不显著。

表4 成熟期不同浓度EBR处理对美乐葡萄果实品质的影响Table 4 Effects of EBR treatments of different concentrations on fruit quality of Merlot at maturing stage
3 讨论
3.1 喷施不同质量浓度EBR对美乐葡萄光合特性的影响
净光合速率反映植物同化CO2的能力(徐飞等,2007),不仅受植物自身因素的影响,还受外界环境如光照强度、温度和水分等因素的影响,EBR可显著提高黄瓜(胡文海等,2006;Xia et al.,2009)、山杏(韩刚和李凯荣,2011)和番茄(李翔等,2016)等植物的光合作用,缓解高温、干旱、盐胁迫和农药等逆境条件对光合速率的影响。本研究中,各EBR处理在美乐葡萄转色期和成熟期均可提高净光合速率、蒸腾速率和气孔导度日变化的平均值,其中0.4 mg/L EBR处理的提高效果较好,与冯晓雪(2014)研究发现0.4 mg/L BR处理对红地球葡萄蒸腾速率和气孔导度提高效果较好的结果一致。Yu等(2004)研究发现,EBR可增加卡尔文循环中CO2同化能力,主要是由于Rubisco初始活性的增加;林竹等(2016)研究表明,BR可解除光抑制,显著提高桃树叶片Rubisco羧化最大速率和PSⅡ的光合电子传递效率;本研究发现,0.2和0.4 mg/L EBR处理可提高美乐葡萄叶片的叶绿素浓度和Rubisco活性,与上述前人研究结果一致。有研究发现,喷施0.10 mg/L EBR能显著提高樱桃番茄的净光合速率,但对番茄叶片气孔导度和胞间二氧化碳浓度无显著影响,表明并非通过调节气孔因素来提高光合效率,可能是通过调节非气孔因素如提高碳酸酐酶和Rubisco活性来提高番茄的光合作用(李蒙等,2015);而在本研究中,0.6 mg/L EBR处理在美乐葡萄果实膨大期会降低叶片净光合速率,减小Rubisco活性,降低叶绿素b和叶绿素ab含量,可能是由于较高浓度的EBR处理抑制了与光合作用相关的酶活性和减少叶绿素含量,从而降低葡萄的光合速率。也有研究发现EBR能显著提高芥菜的胞间二氧化碳浓度和气孔导度,促进光合作用(Fariduddin et al.,2009),而对黄瓜喷施EBR能提高其气孔导度,对胞间二氧化碳浓度无显著影响(胡文海等,2006),可能是由于作物种类或浓度不同而产生的差异。农药会造成叶片生理形态受损,进而破坏光合色素和光合系统,但通过喷施0.01 mg/L EBR可使葡萄叶片的净光合速率、气孔导度和胞间二氧化碳浓度显著提高,减缓农药对葡萄叶片光合作用的影响(彭小琴,2014)。
3.2 喷施不同质量浓度EBR对美乐葡萄果实品质的影响
BR从被发现到实际生产中的应用,最先是在草本植物草莓(吴少华等,1992;忻雅等,2015;李园园,2017;Zahedipour-Sheshglani and Asghari,2020)上应用较多;相关研究表明在苹果(张钰娴,2006)、鲜食葡萄(冯晓雪,2014)和香蕉(刘转霞,2018)等植物上也得到广泛应用。有研究发现,用BR喷布葡萄叶面和浸蘸果穗,均可提高坐果率,增加果粒重及含糖量(周秀梅等,2003);使用BRs抑制剂处理葡萄果实,会降低可溶性糖含量,且延缓果实的成熟与着色(Symons et al.,2006)。本研究在美乐葡萄果实膨大期前进行EBR处理,结果表明,0.2和0.4 mg/L EBR处理均可促进还原糖的积累,0.6 mg/L EBR处理在花后70 d显著提高葡萄果实着色率,0.2和0.4 mg/L EBR处理则在花后80 d效果较明显;而冯晓雪(2014)研究发现,不同浓度的BR处理均可提高红地球葡萄果实的纵横径、单穗重和单果重,但各处理对果皮中花青素含量的影响不明显,可能是由于气候条件及鲜食葡萄品种与酿酒葡萄品种的不同所造成的差异。王利廷等(2018)研究发现,外源EBR处理可促进酿酒葡萄赤霞珠果实的还原糖积累,但在成熟期,处理与对照间无显著差异。而本研究结果表明,在转色期前和果实膨大期前进行EBR处理,0.4 mg/L EBR处理均可促进还原糖积累,且提高还原糖在成熟期的最终含量,这一不同可能是由于气候条件与田间管理的差异所导致。本研究结果还表明,在果实膨大期前进行EBR处理,各处理均显著降低美乐葡萄果实的可滴定酸含量,在葡萄成熟过程中,0.4 mg/L EBR处理的单宁和总酚含量始终低于对照。
4 结论
0.6 mg/L EBR在果实膨大期会通过降低Rubisco活性和光合色素含量影响净光合速率,0.4 mg/L EBR通过提高净光合速率、Rubisco活性和光合色素提高植株光合作用,可促进美乐葡萄果实总糖和总花色苷的积累,降低可滴定酸、单宁和总酚含量,从而提高果实品质。

