大麦幼苗抗氧化酶系统对低高温胁迫的差异响应
安兵壮,李 博,徐 乐*,徐延浩
(1.长江大学农学院,湖北 荆州 434025;2.湖北省农业科学院粮食作物研究所,湖北 武汉 430064)
每种植物都有其生长发育的最适温度,异常高温或低温对植物生长和代谢均具有破坏性影响。由高温或低温引起的各种细胞变化导致有毒化合物的过量产生,尤其是导致产生氧化应激的活性氧(reactive oxygen species,ROS),包括超氧阴离子自由基(O)、羟基自由基(·OH)和过氧化氢(HO)等。胁迫引起的ROS毒性被认为是导致全球作物产量降低的主要原因之一,过量的ROS会诱导蛋白质氧化、DNA损伤、膜脂质过氧化[丙二醛(malondialdehyde,MDA)含量增加]和色素破坏,同时还会改变植物激素的产生和信号传导过程,引起转录组的重编程和机体代谢紊乱。
为避免氧化应激造成的损伤,植物形成了多样而复杂的抗氧化防御机制来清除有毒ROS。抗氧化酶系统主要包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、谷胱甘肽还原酶(glutathione reductase,GR)等。在极端温度条件下,植物倾向于通过诱导抗氧化系统作为它们的防御系统来对抗ROS的产生,并维持它们的氧化还原稳态。李辰彦等观察到低温胁迫期间,水稻中SOD、POD、CAT活性显著上升。Yu等观察到甘薯在高温胁迫下SOD活性先上升后下降,POD活性先下降后上升。Ignatenko等研究发现小麦低温胁迫下SOD与POD活性持续上升,CAT活性先上升后下降。然而,植物抗氧化酶系统响应低温与高温的模式可能存在差异。小麦低温胁迫下POD、CAT活性显著上升,而高温胁迫下活性显著下降;玉米低温胁迫下SOD活性显著下降,而高温胁迫下显著上升。由于这些研究结果来源于不同的试验,因此植物抗氧化酶系统对低温与高温的响应模式还需要进一步研究。
作物苗期遭遇温度胁迫,会导致幼苗发育迟缓或者死亡,影响其群体构建,最终影响其产量。增强作物苗期对多种非生物胁迫的耐受性将使作物更好地生长,从而获得更高的产量。大麦(L.)是全球最重要的谷类作物之一,是食品加工、牲畜饲料和饮料的重要原料。自然条件下,大麦幼苗的生长受多种环境胁迫的限制,尤其是面对越来越明显的气候变化,温度对其影响越发显著。大麦最适宜的生长温度为20~25℃。Zhu等研究发现,温度低于15℃或高于37℃会对大麦的生长发育产生明显的影响。本研究选用大麦品种鄂啤2号为试验材料,以最适温度[22℃(昼)/18℃(夜)]为对照,研究苗期大麦在低温[14℃(昼)/10℃(夜)]与高温[38℃(昼)/34℃(夜)]处理下的SOD、POD、CAT等关键酶活性以及相关基因表达的变化,结合生理生化与基因表达研究结果,分析大麦幼苗抗氧化酶系统对低温与高温胁迫的响应模式及差异,旨在为大麦苗期的耐低温与耐高温研究提供理论基础,为我国大麦生产的防灾减灾与提质增效提供理论参考。
1 材料与方法
1.1 试验材料
本试验以湖北栽培大麦鄂啤2号为供试材料,由长江大学提供。该材料属春性品种,全生育期195~205 d,具有茎秆粗壮、耐肥和抗倒伏等优良特性。
1.2 试验方法
1.2.1 试验设计。选取饱满度一致的种子,在自来水流水浸泡3 h后,用2%的次氯酸钠溶液灭菌25 min,最后用无菌水冲洗3次。将种子置于22℃培养箱(上海佳语科学仪器有限公司提供)中进行黑暗催芽,培养2~3 d后,选取长势一致、露出小芽的种子放入垫有滤纸的发芽盒(13 cm×19 cm×9 cm)中,每盒100粒,分别置于(昼/夜)14℃/10℃、22℃/18℃和38℃/34℃的培养箱中进行处理。分别在处理前(0 d),处理的第1天(1 d)、第2天(2 d)、第3天(3 d)、第4天(4 d)对各处理下的幼苗嫩叶(芽苗期)进行取样。每个试验均设置3次生物学重复。
1.2.2 活性氧含量及抗氧化酶活性的测定。使用1、2、3、4 d的样品测定活性氧含量及抗氧化酶活性。O含量采用羟胺氧化法测定;HO含量参考林植芳等的方法测定;MDA含量采用硫代巴比妥酸法测定;SOD活性采用氮蓝四唑(NBT)光还原法测定;POD活性采用愈创木酚法测定;CAT活性采用过氧化氢还原法测定;APX活性参考Nakano等的方法测定;GR活性参考Omar等的方法测定。每个生理指标测定3次作为技术重复。
1.2.3 抗氧化酶相关基因表达量的测定。使用0、1、3 d的样品测定抗氧化酶相关基因的表达量。采用Trizol试剂法(TIANGEN,北京)提取总RNA,使用1%琼脂糖凝胶电泳和Nanodrop 2000 c检测RNA的质量和浓度。使用反转录试剂盒(TaKaRa,M1701)合成cDNA第1链。实时荧光定量PCR反应采用SYBR Green PCR试剂盒(Thermo Fisher,4385614),以为参照,采用2法计算基因相对表达量。
目的基因与序列及其引物序列设计参考Zvobgo等的研究,与序列及其引物序列参考Chen等的研究(表1)。

表1 引物序列
1.3 数据处理
使用DPS 8.01软件进行统计分析,采用单因素方差分析及最小显著差异法(LSD)分析不同处理间的差异显著性。使用Excel 2019对数据进行整理与作图。
2 结果与分析
2.1 不同温度胁迫下大麦幼苗叶片活性氧分子(ROS)与MDA含量变化
2.1.1 超氧阴离子(O)含量变化。由图1-A可知,3个温度下O平均含量分别为32.73[14℃(昼)/10℃(夜),低温]、21.71[22℃(昼)/18℃(夜),对照,下同]、37.87 μmol/g[38℃(昼)/34℃(夜),高温]。其中,高温下平均含量最高,分别高于低温、对照15.70%、74.44%;其次为低温,高于对照50.76%。处理第1天,对照、低温与高温胁迫下O含量均较低,分别为4.10、10.36、3.50 μmol/g(图1-A)。第2—4天,对照O含量在23.89~32.56 μmol/g浮动变化,低温下O含量持续升高,第3、4天显著高于对照,分别高于对照37.01%、98.01%。高温下O含量第3天开始为同时期最高,第3、4天分别高于低温与对照52.01%、108.26%与22.30%、142.18%。
2.1.2 过氧化氢(HO)含量变化。由图1-B可知,处理期间,高温下HO含量始终低于对照,低温下HO含量第1—2天同时期最低,第3天猛然升高为同时期最高,而第4天再次下降为同时期最低。低温、对照与高温胁迫下HO的平均含量分别为8.09、12.33、10.40 μmol/g,低温与高温分别低于对照34.41%和15.65%。处理过程中,低温下HO含量逐渐升高,第4天轻微下降。第1、2、4天低温下HO含量均显著低于对照,第4天差异最大,低于对照47.83%。高温处理下HO含量逐渐升高但始终显著低于对照,第1天与对照差异最大,低于对照28.36%,第3天差异最小,低于对照11.37%。高温处理下HO含量第1、2、4天均显著高于低温处理,第4天差异最大,高于低温66.46%。
2.1.3 丙二醛(MDA)的含量变化。由图1-C可知,3个温度下MDA含量均呈下降—上升—下降的趋势。对照MDA含量分布在1.09~3.11 μmol/g,平均含量为2.04 μmol/g。低温处理下MDA含量分布在1.95~4.01 μmol/g,平均含量为2.92 μmol/g,高于对照43.14%。高温MDA含量分布在1.67~4.16 μmol/g,平均含量最高,为3.17 μmol/g,分别高于对照和低温55.39%、8.56%。低温处理下第1—3天始终显著高于对照,第2天与对照差异最大,高于对照126.97%,第4天含量降至与对照差异不具统计学意义。而高温下MDA含量始终显著高于对照,第3天开始超过低温处理,为同时期最高,第4天显著高于对照和低温处理,且整个处理期间差异达到最大,分别高于对照和低温108.30%、96.71%。
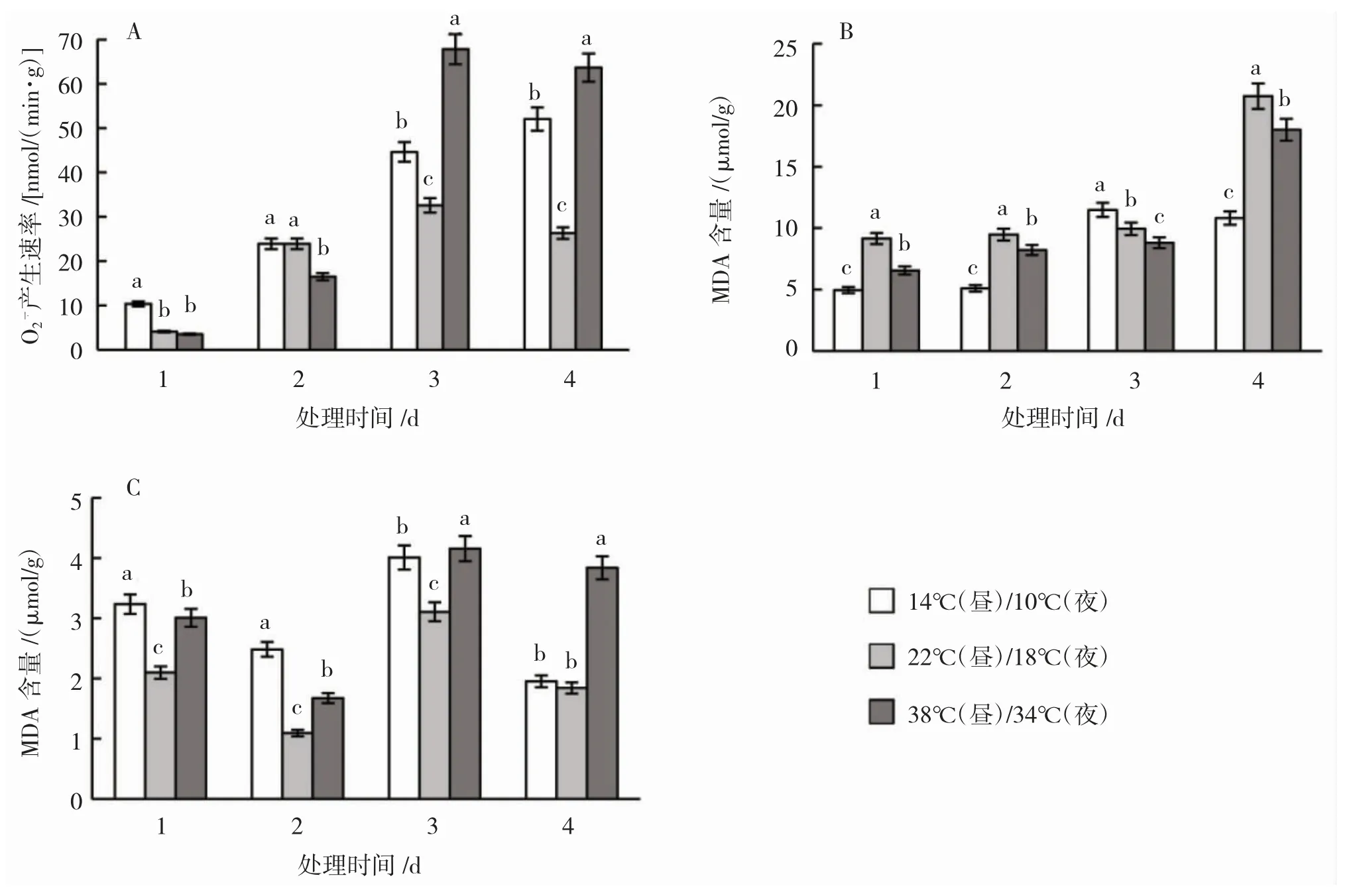
图1 不同温度处理下O2÷含量(A)、H2O2含量(B)、MDA含量(C)变化
2.2 不同温度下抗氧化酶的活性分析
2.2.1 超氧化物歧化酶(SOD)活性分析。由表2可知,对照与低温SOD活性分别在113.44~129.01 U/(g·min)与121.51~130.83 U/(g·min)小幅度波动变化。低温下SOD活性平均为124.52 U/(g·min),高于对照[119.04 U/(g·min)]4.60%。高温下SOD活性在136.17~173.83 U/(g·min)波动变化,平均活性最高,为155.26 U/(g·min),分别高于低温与对照24.69%和30.43%。低温下第1天SOD活性最高,为130.83 U/(g·min),显著高于对照15.32%,而后活性逐渐降低,第4天与对照差异不具统计学意义。高温下SOD活性始终高于对照与低温,第1天活性最低,第2天上升后至第3天轻微下降,第4天再次上升达到最大,分别显著高于对照与低温45.47%和42.94%。
2.2.2 过氧化物酶(POD)活性分析。由表2可知,与SOD相似,对照与低温下POD活性在小幅度波动变化,高温下POD活性先上升后轻微下降,第4天活性达到最高。对照、低温与高温SOD活性分别在49.42~67.71、43.35~67.67、58.19~124.46 U/(g·min)变化。对照平均活性最低,为58.49 U/(g·min);其次为低温,为61.02 U/(g·min);高温下最高,为86.19 U/(g·min)。低温下第1、2天POD活性显著上升,分别高于对照14.02%、8.23%。随着处理时间的延长,第3、4天与对照差异不具统计学意义。高温下POD活性始终高于对照和低温且逐渐上升,第4天达到最大,显著高于对照与低温83.93%、83.43%。
2.2.3 过氧化氢酶(CAT)活性分析。由表2可知,对照CAT活性在722.90~1 299.39 U/(g·min)浮动,平均活性为980.34 U/(g·min)。低温下CAT活性在1 169.83~1 679.76 U/(g·min)浮动,平均活性为1 502.47 U/(g·min),高于对照53.26%。高温下CAT活性分布在2 078.50~3 445.05 U/(g·min),平均活性为2 650.24 U/(g·min),分别高于对照和低温170.03%、76.39%。低温下第1天CAT活性最高且与对照活性差异最大,高于对照132.36%;第2天降至与对照间的差异不具有统计学意义;第3天活性上升,显著高于对照98.14%;第4天与对照间的差异再次减小,高于对照21.05%。高温下CAT活性始终显著高于对照与低温,且随处理时间持续上升,第4天达到最大,分别高于对照和低温165.13%、119.03%。
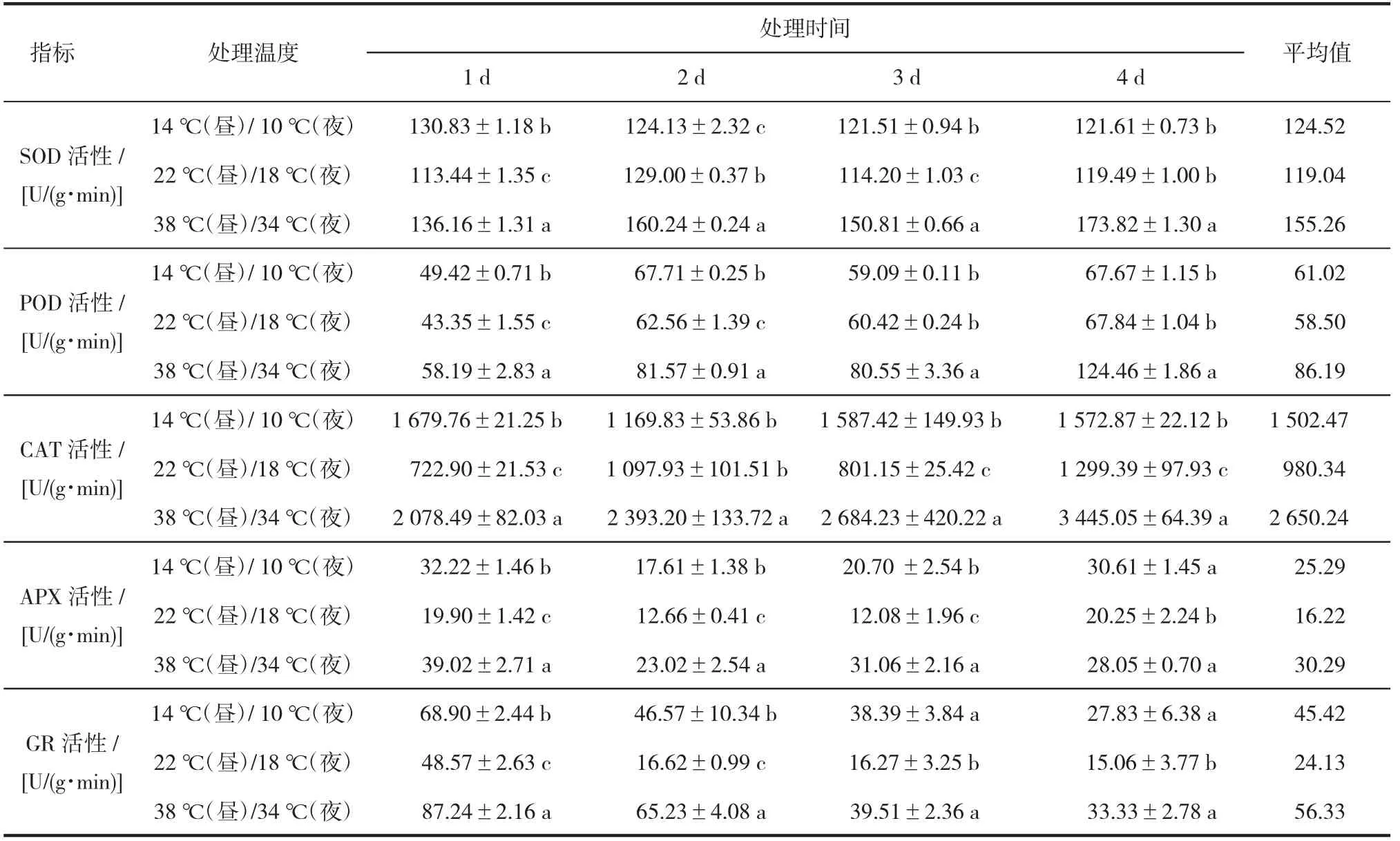
表2 不同温度处理下酶活性变化
2.2.4 抗坏血酸过氧化物酶(APX)活性分析。由表2可知,处理期间,对照与低温APX活性均先下降后上升,对照第3天活性最低,为12.08 U/(g·min),第4天活性最高,为20.25 U/(g·min),平均活性为16.22 U/(g·min)。低 温 下 第2天 活 性 最 低,为17.61 U/(g·min),第1天活性最高,为32.22 U/(g·min),平均活性为25.29 U/(g·min),高于对照55.92%。高温下APX活性呈下降—上升—下降趋势,第2天活性最低,为23.02 U/(g·min),第1天活性最高,为39.02 U/(g·min),平均活性为30.29 U/(g·min),分别高于对照和低温86.73%、19.78%。第1~3天3个温度下APX活性大小呈高温>低温>对照,第3天各温度间差异均达到最大,低温高于对照71.39%,高温分别高于对照和低温157.21%、50.07%,均差异显著。第4天,低温与高温无显著差异,但均显著高于对照,分别高于对照165.13%、119.03%。
2.2.5 谷胱甘肽还原酶(GR)活性分析。由表2可知,对照、低温与高温下GR活性均呈下降趋势,第1天最高,分别为48.57、68.90、87.24 U/(g·min),第4天最低,分别为15.06、27.83、33.33 U/(g·min)。对照平均活性最低,为24.13 U/(g·min);其次为低温,为45.42 U/(g·min),高于对照88.23%;高温下最高,为56.33 U/(g·min),分别高于对照和低温133.44%、24.02%。低温与高温下GR活性始终显著高于对照,第1、2天高温下GR活性最高,第3、4天低温与高温下GR活性差异不具统计学意义。低温和高温均在第2天与对照差异最大,分别高于对照180.13%、292.41%,而后差异逐渐减小,第4天分别高于对照84.74%、121.30%。
2.3 抗氧化酶相关基因的转录表达
由图2可知,与对照相比,低温与高温胁迫诱导抗氧化酶相关基因表达量显著上调,且高温较低温的表达水平更高。低温与高温下、、表达量随处理时间的延长持续上升,第3天达到峰值,分别高于对照235.12%和397.62%、185.93%和442.96%、221.05%和467.49%。低温与高温下与在第1天表达量最高,分别高于对照103.8%和178.33%、51.43%和126.29%,第3天开始下降,但仍显著高于对照,分别高于对照136.76%和108.09%、30.37%和37.78%。
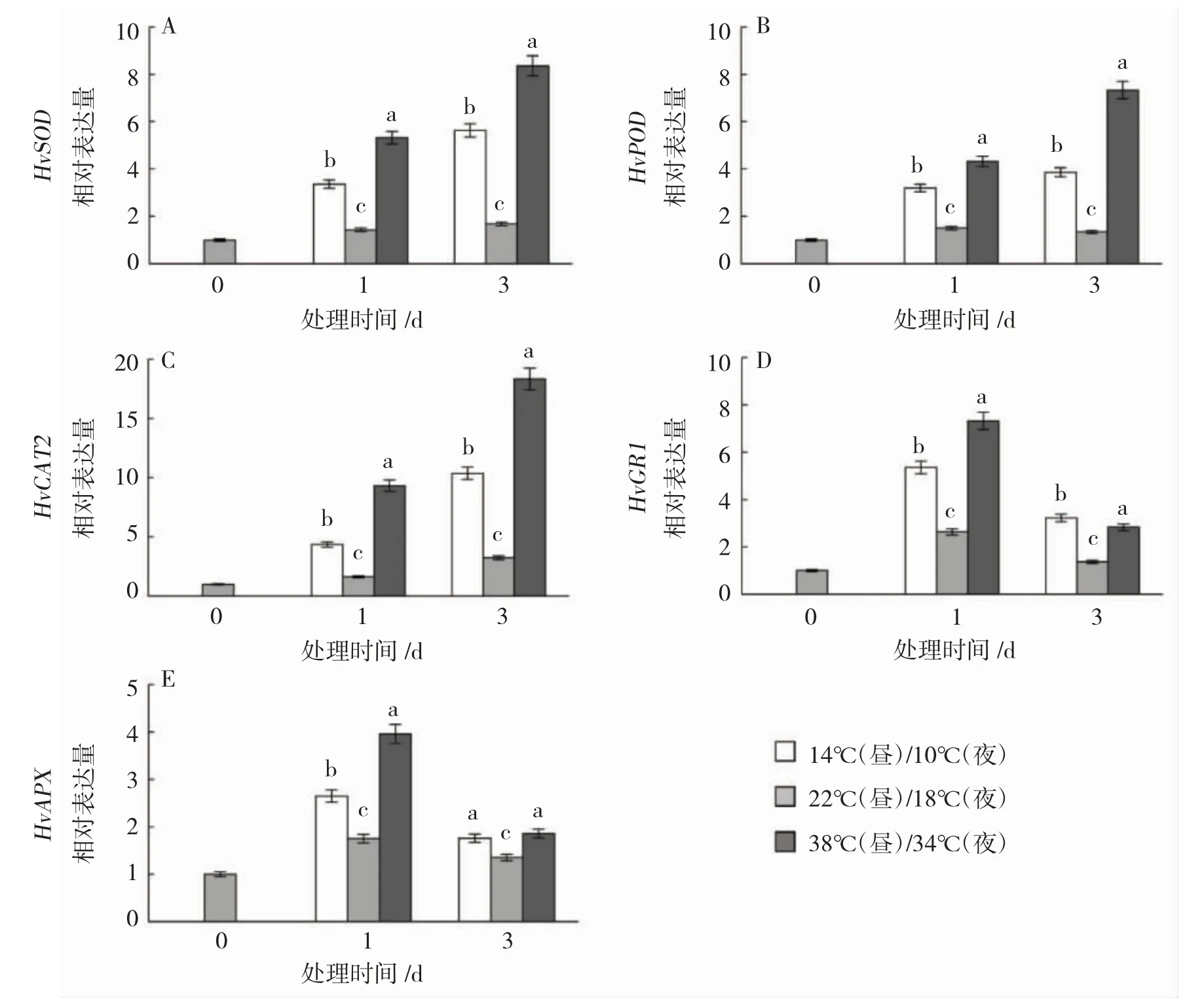
图2 不同温度处理下HvSOD(A)、HvPOD(B)、HvCAT2(C)、HvGR1(D)、HvAPX(E)的转录表达
3 讨论
高等植物生长发育会产生ROS,正常情况下,其产生与清除处于代谢平衡状态,冷热胁迫会打破平衡导致ROS(如O、HO、·OH等)代谢失调而过量积累。本研究中,低温与高温胁迫诱导了O含量显著升高,表明温度胁迫会显著诱导大麦幼苗ROS的产生。然而,HO含量较对照显著下降,这与大多数胁迫研究的结果不同。在甜菜的盐胁迫研究中,Hossain等认为,HO含量的降低可能是由于盐胁迫下甜菜通过抗氧化酶将细胞氧化还原环境调节到比在对照条件下更低的氧化应激水平。APX与GR参与的AsA-GSH循环是清除HO的主要途径之一,在非生物胁迫中扮演着重要的角色。在早期对拟南芥的低温胁迫研究中发现,HO含量低于对照时伴随着APX与GR含量的上升。本研究中,低温与高温降低HO含量的同时也显著诱导了APX与GR活性的上升。因此,大麦幼苗中HO含量的降低可能与抗氧化酶调节的细胞氧化还原环境有关,而APX与GR可能是其中主要的参与者,关于HO含量下降的具体原因还有待进一步研究。
ROS极具活性且能够参与细胞区室相互作用,脂质过氧化被降解是其负面影响之一,最终导致结构破坏和细胞损伤。MDA是磷脂中不饱和脂肪酸过氧化的最终产物,通常用作脂质过氧化水平的指标,以评估应激条件下的细胞膜损伤水平。抗氧化酶是细胞抵御氧化应激系统的主要成分,在清除ROS保护植物免受氧化损伤方面具有重要作用。处理初期,MDA含量与各抗氧化酶活性均显著提升,表明低温与高温对大麦幼苗造成了氧化应激,酶促防御系统迅速启动,调节抗氧化酶活性显著升高。水稻的温度胁迫研究中,低温与高温胁迫显著诱导了水稻叶片中SOD、POD、CAT活性的上升,这与本研究结果类似。随着处理时间的延长,低温下MDA含量与氧化酶活性逐渐趋于对照,表明低温胁迫下抗氧化酶积极发挥作用,参与氧化还原过程,氧化损伤在缓慢修复。张军等也有类似发现:5个小麦品种在低温处理后,有3个品种在2 d的持续低温后,通过自身的适应调节,其质膜部分得以修复。然而,高温下抗体氧化酶活性始终处于较高水平且显著高于低温与对照,MDA含量持续升高。这表明高温下胁迫程度较低温更高,较高的抗氧化酶活性更有助于缓解胁迫带来的氧化伤害。高温下,15种水稻材料中,耐热和强耐热品种的抗氧化酶活性显著高于非耐热品种。此外,推测38℃高温胁迫超出了大麦幼苗的耐受胁迫“阈值”,致使质膜系统持续受到损伤。Yu等在甘薯的高温胁迫研究中发现,高温早期阶段植株会产生过量的ROS,SOD活性迅速增强以应对胁迫,但不足以消除过量的ROS,植物膜脂的过氧化程度持续增加,表明已超出植株的自我调节能力。
研究表明,低高温胁迫下抗氧化酶活性与其基因表达密切相关。抗氧化酶活性变化背后的基因表达可能促进植物的分子适应,并且维持较高水平的抗氧化酶转录本可以在保护植物免受氧化应激方面发挥关键作用。He等研究发现,SOD、CAT、POD相关基因的表达有助于提高枳橙的耐旱性,Kaur等研究发现,抗氧化酶基因表达的上调是缓解芸薹极端温度胁迫下氧化应激的重要手段。本研究发现,低温与高温显著诱导了、、、与表达上调且高温下增幅更高,表明抗氧化酶基因的高表达有利于提高大麦幼苗对极端温度的耐受性,且表达水平会随着其胁迫程度的加深而升高。舒必超等研究发现,低温诱导狗牙根叶片抗氧化酶基因的上调表达,且随着处理温度的下降,其表达水平呈上升趋势。高温下抗氧化酶基因的表达与其酶活变化一致,表明高温下抗氧化酶基因的表达量与其酶活变化相关且可能呈正相关关系。低温下抗氧化酶的活性并不完全随着其基因的表达变化而变化,低温下SOD、CAT的活性第3天较第1天下降,POD的活性第3天与对照间的差异不具统计学意义,而、2和的表达量始终显著高于对照且呈上升趋势。这种酶活与基因表达的差异可能是由于低温与高温胁迫类型的差异,也可能是由于存在不同的抗氧化酶异构体。此外,基因表达调控的机制复杂,抗氧化酶相关基因的表达也并不能与其活性直接相关。抗氧化酶基因与酶活变化的复杂调控网络还有待进一步探索。
4 结论
低温与高温诱导大麦幼苗产生氧化应激,导致ROS积累显著增加,引起膜脂过氧化。抗氧化酶系统通过提高关键酶活及相关基因的表达积极响应低温与高温胁迫并参与调解。相较于38℃(昼)/34℃(夜)高温,大麦幼苗对14℃(昼)/10℃(夜)低温耐受性更强,抗氧化酶系统有效缓解了14℃(昼)/10℃(夜)低温下膜脂过氧化损伤,而38℃高温诱导了较低温更高的抗氧化酶活性及相关基因的转录水平,但氧化损伤程度仍持续升高,已无法有效缓解胁迫带来的氧化伤害。

