花生乳组成对姜黄素生物利用率的影响
余 聪,方晓峰,彭盛峰
(1.江西省药品检查员中心,330029,南昌;2.食品科学与技术国家重点实验室,330047,南昌)
0 引言
黄素(Curcumin)是姜黄和其他植物根茎中发现的一种亲脂性的多酚类物质,也是姜黄中最具生物活性的成分。大量研究表明,其具有抗炎、抗氧化等广泛的药理活性,且毒性低、不良反应小[1-7]。姜黄素在世界范围内得到多种不同形式的认可和使用,如印度,含有姜黄素的姜黄被用于咖喱中;在泰国,它用于化妆品;在中国,它被用作着色剂;在美国,除了胶囊剂和粉末剂外,它还用于芥末酱、奶酪、黄油和薯片中,作为防腐剂和着色剂。姜黄素是目前世界上销量最大的天然食用色素之一,但单独摄入姜黄素不会带来相关的健康益处,这主要是由于吸收不良、新陈代谢与消除迅速所致,且其在水中的溶解性也极差,这些缺点极大地限制了其在食品、化妆品和医药等行业的应用与发展[8]。
植物乳是用含蛋白质和脂肪的植物种子(如大豆、核桃、花生等)或果实(如椰子等)鲜榨后得到的制品,其中存在植物油体和多种植物蛋白。油体(oil body)是子叶细胞内甘油三酯的储存形式,其核心由疏水性甘油三酯构成,周围包裹着一层磷脂,其中嵌入了各种两亲性的蛋白。油体蛋白通过在油体的疏水成分和亲水细胞质之间形成一个界面来稳定油体,其所提供的静电斥力和电阻滞力对油体的完整性和稳定性起着关键作用[9-10]。因此,油体存在的疏水核心和稳定的结构使其极为适合作为包埋姜黄素的天然载体。植物乳中还存在有多种天然的植物蛋白,可作为天然的乳化剂对姜黄素进行包埋。然而目前关于植物乳中单独组分对姜黄素的包埋研究较少,且对负载姜黄素后的产品的消化特性也尚不清晰。
因此,本研究以花生乳为研究对象,分离得到花生粗、精油体、全脂乳和脱脂乳,测定不同产物的油水含量。采用pH驱动的方法,对姜黄素进行溶解包埋,测定其粒径与电位,并通过体外消化模型对其在体外消化过程中消化特性进行研究。本研究的结果有助于更有效的姜黄素营养保健品的设计和开发。
1 实验方法
1.1 实验材料
花生(山东谷悦食品有限公司);姜黄素(C400222)(上海阿拉丁生化科技股份有限公司);牛胆盐、口腔粘膜蛋白(M2378)、胃蛋白酶(P7125;酶活力≥400 U/mg)、胰酶(P1750;4×USP specifications)、脂肪酶(L3126;酶活力 100~400 U/mg)均购买于中国上海Sigma Aldrich 公司;氢氧化钠标准滴定液等试剂均为分析纯,购自西陇化工股份有限公司。
1.2 实验仪器
MasterSizer 3000微米粒度仪(英国Malvern公司);UV-1600PC紫外分光光度计(上海美谱达公司); SHJ-4A水浴锅(江苏东鹏仪器制造有限公司);907 Titrando pH-stat自动电位滴定仪(瑞士万通中国有限公司);共焦扫描激光显微镜(尼康D-Eclipse C1 80i,梅尔维尔)。
1.3 油体的提取、纯化与样品制备
根据Tzen等[11]的方法对花生油体进行提取与纯化,并进行了以下改进。将200 g花生在pH为8.0的磷酸缓冲液(PBS)中按1:7 (w/w)的比例在4 ℃下浸泡16 h,然后丢弃浸泡培养基[12]。以1:7 (w/w)的比例在破壁机中破碎90 s。研磨后的浆液用3层纱布过滤。滤液转移至400 mL管中,在4 ℃下以1 000 g离心30 min。上层用抹刀分离,在滤纸上沥干(Whatman, 5级),称为粗油体。将制备的粗油体分散于pH为8.0的PBS中,1:7(w/w),离心10 000 g,30 min。重复上述操作3次,离心后取面霜层,所得物称之为精油体。破壁之后经3层滤布所得浆液称之为全脂乳,离心后中间层称之为脱脂乳。所有样品保存于4 ℃下,24 h内完成分析。
1.4 油含量的测定
采用索氏提取法进行油含量测定。称取2~10 g 样品于蒸发皿中,加入约20 g海沙,于沸水浴上干燥,再于105 ℃下烘干,研细,转移至滤纸筒中。搭好索氏提取装置,将滤纸筒放入抽提管中,加入石油醚至2/3处。在60 ℃恒温水浴抽提10 h。抽提回流结束后,回收石油醚,将收集瓶置于105 ℃下烘干至恒重,冷却后称量。
油含量(%)=(收集瓶与样品所含脂肪质量-抽提瓶质量)/样品质量× 100%
1.5 水分测定
取洁净铝制扁形称量瓶2个,置于105 ℃干燥箱中,瓶盖斜盖于瓶口,加热1 h,取出盖好,置于干燥器内冷却0.5 h,称量,重复干燥至恒量m1。称取2份2 g样品,分别放入2个称量瓶中(以下以“瓶1”“瓶2”标号),样品厚度约5 mm。加盖,精密称量m2后,至105 ℃干燥箱中,瓶盖斜盖于瓶口,干燥4 h后,盖好取出,放入干燥器内冷却0.5 h后称量。然后再放入105 ℃干燥箱中干燥1 h左右,取出,放干燥器内冷却0.5 h后再称量m3。至前后2次称量差不超过2 mg,即为恒量。水分含量由公式(1)计算:
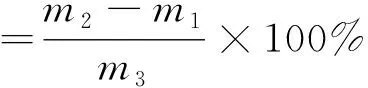
(1)
1.6 pH驱动法载入姜黄素
将称取的姜黄粉末完全溶解于的氢氧化钠溶液(0.1 N NaOH)中,制备出10 mg/g的姜黄素原液。然后将碱性姜黄素原液加入到花生粗、精油体、全脂乳和脱脂乳中(1:10 w/w),用盐酸溶液快速调节,最终pH值为6。将添加姜黄素的乳液用双蒸馏水稀释,得到含有2%油的最终体系,在室温下搅拌10 min,以保证均匀性。最后,在体系中加入非食品级防腐剂叠氮化钠(0.02%),以抑制微生物的生长。需要注意的是,pH驱动的方法会在最终样品中形成一些NaCl,因为使用NaOH生成碱性溶液,然后加入HCl中和。根据初始NaOH浓度(0.1 M)和稀释倍数(1:10),预计最终样品的NaCl水平在10 mM左右。
1.7 粒径
粒径的大小由商用的静态光散射仪器在常温下测定[13]。粒度数据被报告为表面加权平均直径(d32),样品用相对应pH值的去离子水稀释。
1.8 负载姜黄素的油体及其副产物的体外消化特性
参考André等[14]的方法并作略微修改,利用模拟胃肠道模型开展其体外消化实验,口腔:将饼干与口腔液(含3 mg/mL粘液素)按1:1比例混合,调节pH至6.8,孵育10 min;胃部:将口腔消化液与胃液(含3.2 mg/mL胃蛋白酶)按1:1比例混合,调节pH至2.5,孵育2 h;小肠:在胃消化食糜(30 mL)中加入肠液、胆盐,再调节pH至接近7.0,加入脂肪酶,通过pH恒定滴定仪恒定pH至7.0。
游离脂肪酸消化速率:通过pH恒定滴定仪的NaOH滴定量表征其游离脂肪酸消化速率,由公式(2)计算:
FFA%=100×(VNaOH×mNaOH×Mlipid)/2Wliquid
(2)
式中:FFA为游离脂肪酸消化速率;VNaOH是中和脂质分解出的酸所需的滴定液的体积,mNaOH是氢氧化钠的物质的量浓度,Mlipid是所使用的油的分子量,2表示一个甘油三酯释放2个游离脂肪酸,Wliquid是消化系统中油脂的质量(g)。
稳定性和生物可接受率:体外消化模型结束后,将肠液以12 000 g离心30 min,收集中间胶束相。提取的含姜黄素溶液用紫外可见分光光度计在420 nm处检测分析。使用事先准备好的标准曲线确定姜黄素浓度。生物可接受率(B*)与稳定性(S*)测量由公式(3)、(4)计算:
B*=100×CMicelle/CDigesta
(3)
S*=100×CDigesta/CInitial
(4)
式中:CMicelle表示混合胶束层中姜黄素的浓度,CInitial表示在初饼干中姜黄素的浓度,CDigesta表示在总的小肠消化结后消化液中姜黄素的浓度。
1.9 共聚焦(CLSM)
使用共聚焦扫描激光显微镜200倍放大(20物镜10目镜)对样品的显微结构进行表征。以尼罗红溶液(将尼罗红溶解于乙醇中,最终浓度为1 mg/mL)的形式加入疏水荧光染料对样品中的油区进行染色。
1.10 数据处理
每个实验进行3次,以平均值±标准差的形式表示,采用SPSS 22分析软件对数值进行方差分析,通过Origin 9.0软件作图。
2 结果与讨论
2.1 含油量与含水量
由表1可知,花生粗油体的含油量77.65%,略低于精油体的78.01%,含水量也呈现相似趋势,粗油体中的含水量为18.13%,略低于精油体的19.23%。这些结果表明,精油体中除油、水外的物质显著低于粗油体,这可能是由于碱性的PBS在洗涤过程中除去了油体表面的杂蛋白[15]。全脂乳中油含量为4.99%,而脱脂乳中的油含量仅为0.13%。这些结果对体外消化过程中原样品的初始油含量的标定具有重要意义。

表1 花生油体及其副产物的含油量与含水量
2.2 载入姜黄素的花生油体及其副产品的体外消化特性
2.2.1 油体及其副产品的游离脂肪酸释放 通过pH驱动的方法使用油体负载姜黄素,以同样加入姜黄素的全脂乳和脱脂乳为对照,考察姜黄素在不同载体运输下的体外消化特性。游离脂肪酸释放结果如图1所示,粗、精油体的游离脂肪酸释放结果无显著性差异,这表明采用碱性PBS对油体进行纯化不会影响其游离脂肪酸的释放。全脂乳中游离脂肪酸释放速率最快,2 h后FFA值高达91.22%。而脱脂乳由于其油脂含量过低,在前30 min,游离脂肪酸基本完全释放。
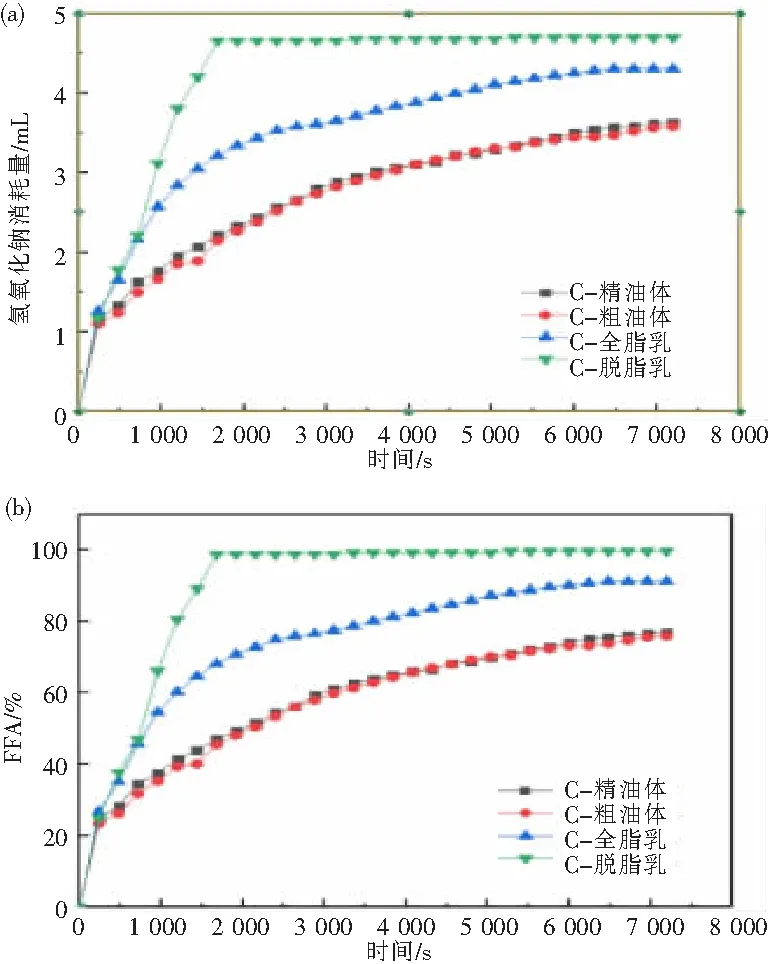
图1 (a)NaOH的消耗量;(b)FFA释放曲线
2.2.2 不同载体对姜黄素稳定性与生物可接受率的影响 由图2可知,脱脂乳中姜黄素的稳定性最好为88.17%,显著高于精油体(62.46%)、粗油体(64.96%)和全脂乳(73.96%)。精油体中姜黄素的生物可接受率为52.10%,显著高于粗油体的39.92%。这归因于纯化过程中碱性PBS能够去除油体中受污染的蛋白质[15],维持和增强油体界面蛋白膜的完整性和稳定性,缓解其在胃环境下的蛋白水解[16],从而提高姜黄素的生物可接受率。全脂乳中姜黄素的生物可接受最高为76.31%,这可能与油体的乳化性能有关,油体制备过程中残留的油体具有较好的乳化能力[17],加入姜黄素后,能够形成较为稳定的乳液,从而提升了姜黄素的生物可接受率和稳定性。脱脂乳中姜黄素的生物可接受率仅为28.25%,这可能与姜黄素存在的形态有关,结晶形式的姜黄素生物利用度极低[18]。这些结果表明,花生油体具有包埋和保护姜黄素的能力,通过碱性溶液的纯化可进一步提升姜黄素的生物可接受率。

图2 姜黄素标准曲线
2.2.3 负载姜黄素的不同颗粒在消化过程中的变化 由图3可知, 不同种负载姜黄素的粒子在各消化阶段的粒径变化趋势相近,口腔消化过程中,粒子的粒径无明显变化,而在肠消化阶段发生明显聚集,粒径显著增大,在肠消化末期,粒径也略有增大。这可能是由于在胃部环境下,油体界面上部分蛋白质发生水解[16],降低和破坏了油体的稳定性,从而导致粒子发生聚集现象。过酸的胃部环境也会使得姜黄素析出,形成结晶,颗粒增大。使用共聚焦扫描激光显微镜对粒子各消化阶段的微观结构进行观察,结果如图4所示,在胃消化阶段,粒子的粒径明显增大,这一结果也印证了粒径测量结果的准确性,在肠消化阶段,粒子进一步聚集,大部分物质被消化。

图3 不同载体中姜黄素的稳定性和生物可接受率
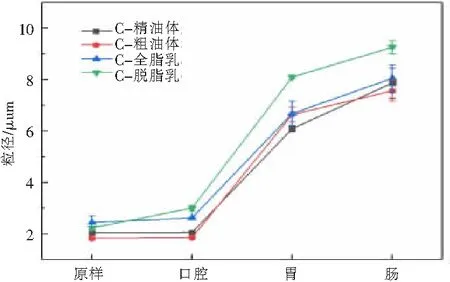
图4 消化过程中负载姜黄素的粒子的粒径变化

图5 消化过程中粒子的微观图像
3 结论
本文制备了花生粗油体、精油体、全脂乳和脱脂乳,测定花生油体及其副产物的油水含量。采用pH驱动的方法,对姜黄素进行溶解包埋,测定其粒径与电位,并通过体外消化模型对其在体外消化过程中消化特性进行研究。结果表明,碱性PBS的洗涤能够有效去除油体中受污染的蛋白。负载姜黄素的全脂乳中游离脂肪酸的消化速率最高,2 h后达到91.22%,油体的纯化对油体的游离脂肪酸消化速率无明显影响。负载姜黄素的油体及其副产物在胃消化过程中有明显聚集。纯化后的油体表现出更高的生物可接受率。研究的结果有助于更有效的姜黄素营养保健品的设计和开发。

