发酵剂对鲟鱼糜中生物胺的影响
才让卓玛,曾诗雨,张效平,李小义,刘霆,赵凤*
(1.贵州省农业科学院水产研究所,贵阳 550025;2.贵州省特种水产工程技术中心,贵阳 550025)
鲟鱼为鲟形目鱼类的总称,是现存起源最早的脊椎动物之一,生长快、病害少,因肉质鲜美,无肌间刺,具有抗癌、美容养颜的作用,深受广大消费者的喜爱。2019年全国鲟鱼养殖量为102042 吨,其中,贵州的养殖量达14101 吨[1]。目前贵州省内的鲟鱼多以鲜销为主,经济附加值较低。
发酵作为一种用于贮藏食品并增强食品风味的加工技术,可以提高食品的风味与营养品质[2]。发酵食品是让益生菌进入体内的良好方式[3],但与此同时,发酵制得的食品会产生包括生物胺在内的有毒物质[4],为食用者带来健康隐患,其中,富含生物胺的发酵肉制品以发酵香肠和水产品为主[5]。生物胺(biogenic amines,BAs)是一种低分子量、有生物活性的含氮化合物的总称[6]。微量生物胺对机体无害,但是当过量摄入时,会引发一系列的不良反应,如发烧、过敏反应、神经毒性[7-9]。因此,控制食品中的生物胺含量可有效提高食品的安全性。有研究表明,将对人体无害的有益菌种接种到鱼体中能抑制生物胺的合成[10-12];植物乳杆菌可提高发酵食品的风味和安全性[13-14]。但是单一菌种发酵过程中会出现生物胺累积的风险,而复配发酵剂可弥补该缺陷,使各菌种发挥其优势[15]。
鱼糜制品是将鱼肉绞碎后加盐擂溃、调味,进行水煮、油炸等处理而制得,是优质蛋白质的重要来源[16],且拥有广阔的市场前景[17]。利用发酵工艺制得的鱼糜制品可赋予产品良好的品质和保健功能,目前市场上发酵鲟鱼糜制品较少。本研究以杂交鲟鱼为原料,探讨鲟鱼糜在发酵过程中生物胺含量的变化情况,为鲟鱼的精深加工提供理论参考,并在一定程度上推动鲟鱼加工产业的发展。
1 材料和方法
1.1 材料与试剂
杂交鲟鱼:贵州省水产研究所惠水基地;食盐、玉米淀粉、胡椒粉、白砂糖、料酒、葱姜粉:食品级,采购于贵阳市合力超市花溪店。
植物乳杆菌(Lactobacillusplantarum)、戊糖片球菌(Pediococcuspentosaceus):广东省微生物菌种保藏中心;MRS培养基:青岛日水生物技术有限公司;组胺、精胺、亚精胺、尸胺、苯乙胺、腐胺、色胺、酪胺(均为色谱级):美国Sigma-Aldrich公司;正己烷、丙酮、乙腈(均为色谱级):美国Fisher 公司;丹磺酰氯(纯度97%)、三氯乙酸(纯度99%):上海萨恩化学技术有限公司;氨水(分析纯)、甲酸铵(LC-MS级):上海阿拉丁试剂有限公司;碳酸氢钠、氢氧化钠(均为分析纯):上海易恩化学技术有限公司。
1.2 仪器与设备
LC-20a高效液相色谱仪 日本岛津公司;T-25匀浆机 德国IKA公司;LDZF-50L立式高压蒸汽灭菌锅 上海申安医疗器械厂;SW-CJ-1F垂直流洁净工作台 吴江市伟峰净化设备有限公司;WPL-125电热恒温培养箱 天津市泰斯特仪器有限公司;Milli-Q IQ7000纯水仪 德国密理博公司;SQP电子天平 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 发酵剂的制备
无菌条件下,分别吸取0.3 mL的无菌水,滴入植物乳杆菌和戊糖片球菌冻干管中,轻轻振荡至溶解,吸取全部菌悬液,分别接种于MRS固体培养基上,37 ℃纯化培养,得实验用发酵菌株。用麦氏比浊法将发酵菌株用无菌生理盐水稀释成108CFU/mL的菌悬液,即得发酵剂。
1.3.2 样品的制备及处理
冷冻鲟鱼肉于4 ℃解冻,漂洗2次,沥干水分,用绞肉机绞成鱼肉糜,以鱼糜总量百分比计,加入2%食盐、8%玉米淀粉、2%白砂糖及适量香辛料(料酒、胡椒等)、1%发酵剂(植物乳杆菌∶戊糖片球菌为1∶1),搅拌均匀,真空包装,未接种发酵剂组作为对照组。26 ℃发酵培养,发酵0,12,24,36,48,60 h时测定生物胺含量,每个样品平行测定3次。
1.3.3 生物胺标准溶液的配制
称取色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺 8种标准品各5.1,13.9,3.1,8.3,2.1,1.7,3.5,1.3 mg,然后用0.1 mol/L的盐酸分别定容到10 mL,并分别稀释为510,1390,310,830,210,170,350,130 μg/mL的母液,分别稀释100,80,50,25,20,10倍,配制成混标溶液。
1.3.4 生物胺的柱前衍生
取1 mL混标液,依次加入200 μL 2 mol/L NaOH 溶液、300 μL饱和NaHCO3缓冲溶液、丹磺酰氯2 mL,转移至5 mL的容量瓶中,40 ℃避光反应45 min,加入100 μL 25%的氨水于暗处静置30 min,终止衍生反应后用乙腈定容至5 mL,用0.22 μm滤膜过滤备用。
1.3.5 样品衍生化
取5 g样品,加入15 mL 5%三氯乙酸溶液,均质,于4 ℃以10000 r/min 离心10 min,取上清液,加入10 mL 三氯乙酸溶液重复1次,合并上清液,定容至50 mL。将其过滤后取滤液10 mL,加入1/2倍体积的正己烷萃取除脂,分层后去除有机相,重复处理2次。取1 mL除脂后的生物胺提取液依次加入200 μL 2 mol/L的氢氧化钠、300 μL的饱和碳酸氢钠溶液及1 mL的丹磺酰氯溶液,混合均匀后于40 ℃避光反应45 min,加入100 μL 25%氨水避光保存30 min,终止反应后用乙腈定容到5 mL,以3000 r/min离心5 min,上清液用0.22 μm滤膜过滤,于4 ℃备用。
1.3.6 生物胺的测定
InsertSustain AQ-C18色谱柱(4.6 mm×250 mm×5 μm,日本岛津公司),柱温30 ℃,流动相A:0.1 mol/L醋酸铵,流动相B:乙腈,流速0.8 mL/min,进样量50 μL,检测波长254 nm,梯度洗脱程序见表1。

表1 梯度洗脱程序
1.3.7 数据处理
每个实验重复3次,采用SPSS 19.0进行数据分析,Origin 2018作图。
2 结果与分析
2.1 生物胺检测的标准曲线
分别以生物胺浓度和峰面积为横、纵坐标,绘制标准曲线,得到8种生物胺的线性回归方程和相关系数,见表2。

表2 标准曲线的回归方程
由表2可知,8种生物胺的相关系数R2均大于0.995,表明这8种生物胺的质量浓度和峰面积之间线性关系良好。
2.2 发酵过程中鲟鱼糜生物胺含量的变化
生物胺的含量与水产品的品质密切相关,当腐败微生物使水产品中的游离氨基酸发生脱羧反应时,会生成大量生物胺,从而影响产品质量[18]。检测鲟鱼糜在26 ℃下从0 h发酵至60 h的过程中发酵组和对照组中生物胺含量的变化情况,结果见图1。
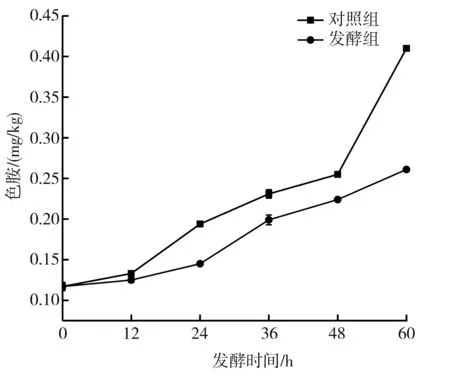
a.发酵过程中色胺含量的变化
由图1中a 可知,发酵初期,色胺含量为0.117 mg/kg,发酵至60 h时,对照组和发酵组的色胺含量分别为0.410 mg/kg和0.261 mg/kg,发酵组的色胺含量低于对照组,这一结果可能是所用的发酵剂抑制了色胺的积累[19]。韦宗卉[20]也发现了类似规律,经乳酸菌发酵,辣椒酱中色胺和腐胺的含量有所降低。
苯乙胺作为一种芳香族生物胺,可被单胺酶氧化分解。当人体摄入过量苯乙胺时,会出现失眠、头痛等不良反应[21]。由图1中b可知,发酵初期,对照组和发酵组均未检出苯乙胺。当发酵至48 h时,对照组中检测到少量苯乙胺;发酵至60 h时,对照组中的苯乙胺含量由0.073 mg/kg增加至0.494 mg/kg。发酵组中,当发酵至60 h时,苯乙胺含量仅为0.035 mg/kg。因此对于短期的鲟鱼糜发酵,苯乙胺或不适合作为评价其腐败变质的指标。
腐胺由鸟氨酸发生脱羧反应形成,普遍存在于水产类食品中[22],其能直接参与生物体的部分生理活动,摄入过量会引起头痛等症状[23]。由图1中c可知,发酵初期腐胺的含量为0.708 mg/kg,随着发酵时间的延长,呈现出递增的趋势。发酵至48 h后,对照组和发酵组中的腐胺含量均有所降低,其原因可能是随着发酵的进行,部分腐胺作为前体物质转化成了亚精胺和精胺[24]。
尸胺和腐胺类似,对人体没有直接的健康威胁,而是通过抑制组胺代谢酶如单胺或二胺氧化酶和组胺甲基转移酶的活性来增强组胺和酪胺的毒性效应[25],它们能够与食品中的亚硝酸盐反应生产致癌物亚硝基胺,因此仍需关注这两种生物胺在鲟鱼糜发酵过程中含量的变化情况。由图1中d可知,发酵初期,尸胺的含量为0.266 mg/kg,随着发酵时间的延长,对照组和发酵组的尸胺含量均有所增加。发酵至60 h时,对照组和发酵组的尸胺含量分别为24.150 mg/kg和18.627 mg/kg,发酵组较对照组含量有所下降。Simion等[26]以植物乳杆菌和酿酒酵母菌混合发酵香肠,发现最终香肠中腐胺和尸胺含量下降。本研究也得到类似规律,当发酵至60 h时,发酵组中的腐胺和尸胺含量较对照组均有所下降,与前人的研究结果相似。
酪胺的毒性被认为仅次于组胺[27],酪胺引起的食源性胺中毒常被称为“奶酪反应”,欧盟规定酪胺在食品中的限量为 100 mg/kg[28]。由图1中g可知,发酵至60 h时,对照组和发酵组的酪胺含量分别为5.144 mg/kg和4.264 mg/kg,发酵组的酪胺含量较对照组低,该结果可能是发酵剂中的植物乳杆菌对鲟鱼糜产生的酪胺进行了一定程度的降解所致,与前人研究的从火腿中分离出的植物乳杆菌和干酪乳杆菌可以不同程度地降解酪胺结果相似[29]。
随着发酵的进行,对照组和发酵组的亚精胺含量和精胺含量并未呈现出一定的规律性(见图1中e和f),产生这种现象可能是亚精胺和精胺这两种生物胺本身的性质不稳定易分解所致[30]。
组胺是水产品发酵过程中所产生的生物胺中对人类健康影响最大的一种[31]。青皮红肉类鱼等鲭科鱼类因富含组氨酸从而易产生组胺,因此组胺中毒又称鲭科鱼类中毒。 GB 2733-2015《鲜、冻动物性水产品》规定,鲐鱼、鲹鱼、金枪鱼及沙丁鱼等青皮红肉海水鱼组胺含量不得超过 400 mg/kg,而其他海水鱼类组胺含量不得超过 200 mg/kg。FDA规定进口水产品中组胺含量不得超过50 mg/kg[32],EFSA规定水产品和食品中组胺含量不得高于100 mg/kg[33]。田甜等[34]研究发现,接种戊糖片球菌、肉葡萄球菌、木糖葡萄球菌、汉逊德巴利酵母、清酒乳杆菌5种微生物制备成的复合发酵剂的广味香肠的组胺含量较自然发酵的降低了10.14%,提高了香肠的食用安全性。本研究中发酵60 h时,发酵组和对照组中的组胺含量分别为0.521 mg/kg和0.680 mg/kg,发酵组较对照组的组胺含量低23.38%,与前人的研究结果类似。
3 结论
水产品中的生物胺在存储过程中,过高的温度和较差的生产条件都会增加水产品中生物胺的积累。Chong等[35]研究发现,印度鲅鱼在25~29 ℃贮藏过程中,除亚精胺和精胺外,其他生物胺的含量均显著增加。本研究也得出类似规律,色胺、苯乙胺、尸胺、酪胺、组胺这5种生物胺随着发酵时间的延长其含量均呈现出逐渐升高的趋势。
本研究中,发酵初期,除精胺与亚精胺之外的6种生物胺含量均较低,说明原料鲟鱼较新鲜。同时,在发酵过程中,各时间点发酵组中的生物胺含量均低于对照组,说明复合发酵剂对鲟鱼糜中生物胺的生成有一定抑制作用,其原因可能是乳酸菌发酵产生的代谢产物抑制了其他有害微生物的生长。翟钰佳等[36]以植物乳杆菌为发酵剂,发现羊肉发酵香肠中生物胺的形成被显著抑制。此外,还有学者发现分离自食物的植物乳杆菌、戊糖片球菌、乳酸片球菌等菌株可在体外降解酪胺和组胺[37],这与本研究结果相似。
本研究结果表明,复合发酵剂有助于抑制鲟鱼糜中生物胺的产生,提高食用安全性,为工业化安全生产发酵鲟鱼制品提供了一定的数据支持,同时也为发酵技术在鲟鱼加工中的应用提供了一定参考。

