腐生葡萄球菌和植物乳杆菌复配对发酵香肠品质和风味的影响研究
尹忞强,焦宇知,黄露怡,袁华平,田青*
(1.江苏食品药品职业技术学院,江苏 淮安 223001;2.昆山市计量测试所,江苏 昆山 215300)
根据参考文献,肉制品最早源于古巴比伦和中国,已有3500年的历史。不同地域地理环境、气候条件、宗教、经济、饮食习惯等因素的差异,使各地形成许多不同形状、质地、外观和具有独特风味的肉制品[1]。千百年来,传统肉类发酵过程中微生物的作用机制并没有被充分了解,而这些作用机制与不同发酵肉类产品的各种质量属性直接相关。自19世纪中叶以来,细菌、酵母菌及霉菌在发酵食品生产中的重要作用逐渐被人们所了解,促使产品发酵过程更加可控和高效[2]。国内著名的浙江金华火腿、江苏如皋火腿、哈尔滨红肠、广东和湖南等地的腊肉和腊肠、贵州及江西一带的酸肉、上海的咸肉等因其具有诱人的色泽、独特的风味和造型等特点深受当地消费者的喜爱[3],正是由于发酵给肉制品带来诱人感官、独特风味及丰富营养的特点,发酵肉制品在国内的研究热度和消费者喜爱程度越来越高。
近年来,发酵肉制品中常用的发酵剂包括乳酸菌、酵母菌、葡萄球菌属、霉菌等[4]。乳酸菌(lactic acid bacteria, LAB)及过氧化氢酶阳性、凝固酶阴性的葡萄球菌(coagulase negative Staphylococci, CNS)是最活跃的微生物发酵剂[5]。微生物发酵剂产酸较高和快速促使香肠水分活度(Aw)下降的能力有利于缩短香肠发酵成熟周期,抑制香肠中腐败及致病微生物生长繁殖,提高香肠卫生品质,也可促进亚硝酸盐与肌红蛋白结合形成亚硝肌红蛋白,提高香肠红度色泽,分解蛋白形成低阈值、良好风味的挥发性化合物[6]。本研究的目的是以腐生葡萄球菌CGMCC 3475和植物乳杆菌CGMCC 18217复配研究肌原纤维蛋白降解对风味物质的影响,对改善发酵香肠风味和品质提供了理论基础,对改进发酵香肠生产与发展具有重要的作用。
1 材料和方法
1.1 材料
腐生葡萄球菌CGMCC 3475菌株、植物乳杆菌CGMCC 18217菌株:由扬州大学筛选及鉴定保藏;猪背部肌、猪肥膘、香辛料:扬州欧尚超市;盐渍肠衣:江苏省如皋市坝新肠衣公司。
1.2 试剂
MRS培养基:青岛海博生物有限公司;葡萄糖、磷酸二氢钠二水、磷酸氢二钠十二水、SDS、β-巯基乙醇、甘油、稳定型Lowry法试剂盒等:生工生物工程(上海)股份有限公司;亮氨酸(食品级):浙江一诺生物科技有限公司;预染蛋白质分子量标准:赛默飞世尔科技有限公司。
1.3 主要仪器与设备
Sorvall ST 16R高速冷冻离心机 美国Thermo Fisher科技有限公司;WFZ UV-2100紫外可见分光光度计 尤尼柯(上海)仪器有限公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;Mini-PROTEAN Tetra Cell电泳仪 美国Bio-Rad公司;手持式CR-400色差仪 日本Konica Minolta公司;手持式Testo 205 pH计 德图Testo公司。
1.4 方法
1.4.1 菌种活化
将1%的腐生葡萄球菌CGMCC 3475菌株和植物乳杆菌CGMCC 18217菌株的接种量接种于MRS液体培养基中,37 ℃培养24 h,活化2次。
1.4.2 发酵香肠制作及处理组制备
每1 kg猪肉按肥∶瘦为3∶7混合,加7%糖、3%盐、0.2%味精、0.1%五香粉、0.15%生姜粉、20 mL/kg大曲,菌株接种量为107CFU/g,斩拌、混料均匀后灌肠,最后发酵28 d,发酵条件为自然风干。3组香肠取样时间分别是0,7,14,21,28 d,每次每组各取样50.0 g。
1.4.3 发酵香肠处理组设置
第1组:香肠不接菌(CK组);第2组:香肠接腐生葡萄球菌CGMCC 3475(L组);第3组:香肠接腐生葡萄球菌CGMCC 3475∶植物乳杆菌CGMCC 18217为1∶1(LS组)。
1.4.4 发酵香肠挥发性风味测定
香肠样品10.0 g除去肠衣并切碎置于250 mL锥形瓶中,加入内标溶液20 μL(取0.02 g的辛酸甲酯用甲醇溶液稀释至10-2),在60 ℃水浴锅预热5 min后插入SPME萃取头吸附40 min,然后在气质联用仪的气相色谱进样口解吸5 min,用于进一步检测。
检测条件:气相条件:非极性柱DB-5MS(30 m×0.25 mm×0.25 μm),载气为高纯氮气(99.999%),恒流且流量为1.0 mL/min,不分流进样。辅助载气为高纯氢气(99.999%),检测器温度280 ℃,进样口温度250 ℃。初始温度40 ℃,保持1 min,以5 ℃/min升温至10 ℃,保持8 min,再以8 ℃/min升温至240 ℃,保持5 min;质谱条件:离子化方式为EI+,电子能量70 eV,扫描时间0.2 s,检测器电压500 V,扫描范围30~500 m/z。
1.4.5 发酵香肠质构测定
发酵香肠质构测定参考刘浩等[7]的方法。将香肠样品切成1 cm3的正方体,质构仪感应源1000 N,初始力0.3 N,压缩比60%,测定前速度2 mm/min,测定中速度2 mm/min,测定后速度1 mm/min,循环2次,测定指标有硬度(N)、弹性(mm)、咀嚼性(mJ)、黏附性(mJ)。
1.4.6 发酵香肠感官评价
感官评价参考曹辰辰等[8]的方法。感官评价人员由10名食品专业的研究生组成(5男5女),具体的评分标准见表1。此过程香肠切片厚度为0.3 cm,样本采用三位数编号,香肠提供顺序随机。

表1 发酵香肠感官评分标准表

续 表
1.4.7 数据处理与统计分析
数据处理采用Microsoft Excel 2016,图表的绘制采用Origin 2018。统计学分析采用SPSS 13.0,显著性差异的分析选择Duncan法进行多重比较,并表示为平均值±标准差。显著性水平为P<0.05。
2 结果与分析
2.1 香肠发酵过程中pH的变化
发酵过程中微生物分解乳糖生成乳酸降低pH是香肠发酵必不可少的步骤,低pH能抑制不良微生物的生长,降低蛋白质的持水能力,从而降低水分活度,增加发酵香肠红度值,确保干燥过程。发酵过程中香肠的pH变化见图1。
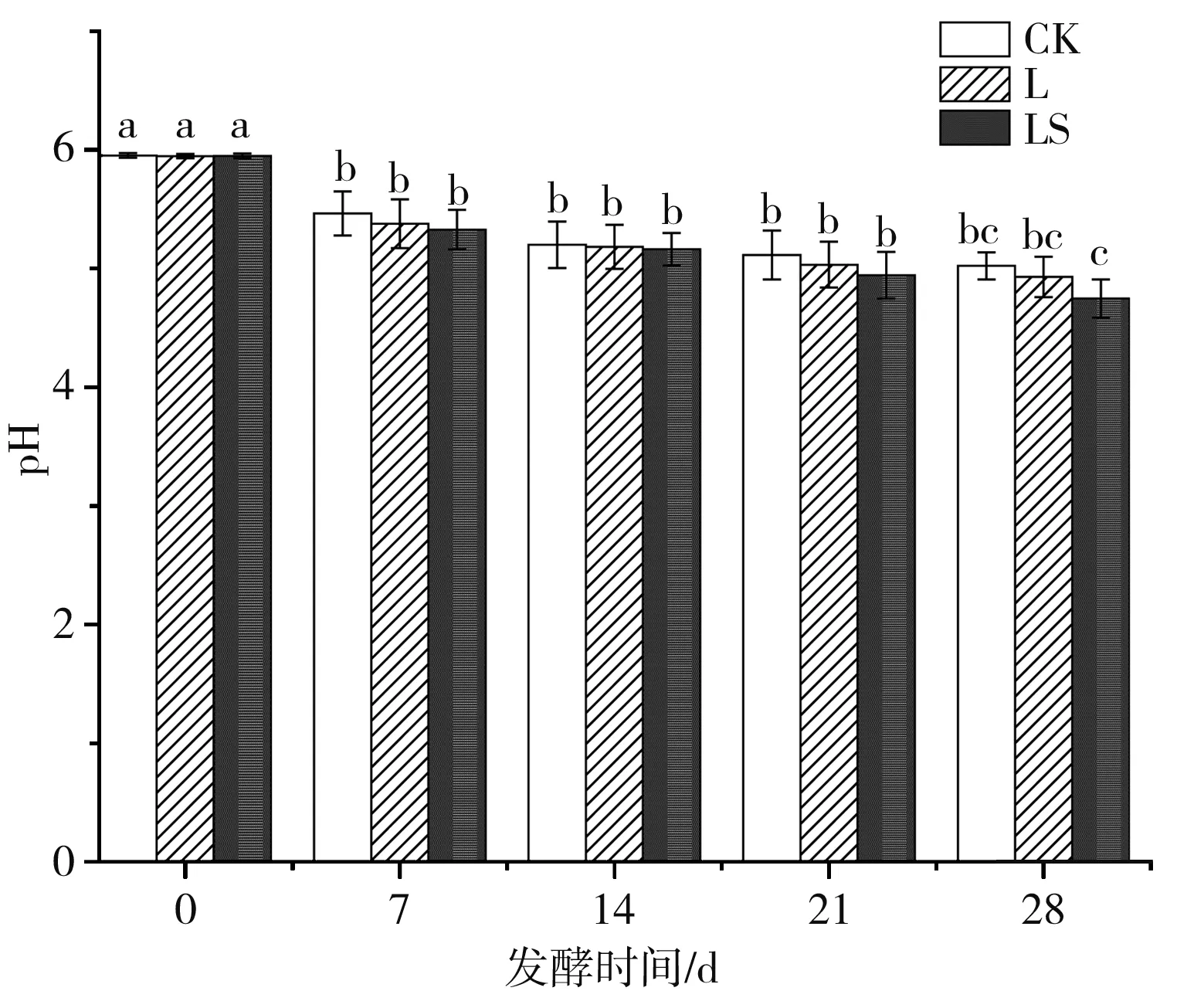
图1 发酵香肠pH的变化
由图1可知,发酵起始,各处理组的pH在5.94~5.96之间,差异不显著(P>0.05),香肠发酵28 d后,各处理组的pH逐渐下降至最小值5.02,4.93,4.85,且LS组与L组和CK组有明显差异,可能是由于植物乳杆菌CGMCC 18217和腐生葡萄球菌CGMCC 3475的生长和代谢形成的有机酸累积导致pH的下降,其他研究也发现接菌香肠由于LAB发酵剂具有很强的酸化活性,因此显示出最低的pH值[9]。
2.2 香肠发酵过程中色泽的变化
颜色对发酵香肠的成熟度起着重要的作用。在发酵成熟过程中,发酵香肠的L*、a*和b*的内部颜色变化见表2,所有的样品均表现出发酵香肠的典型颜色特征。
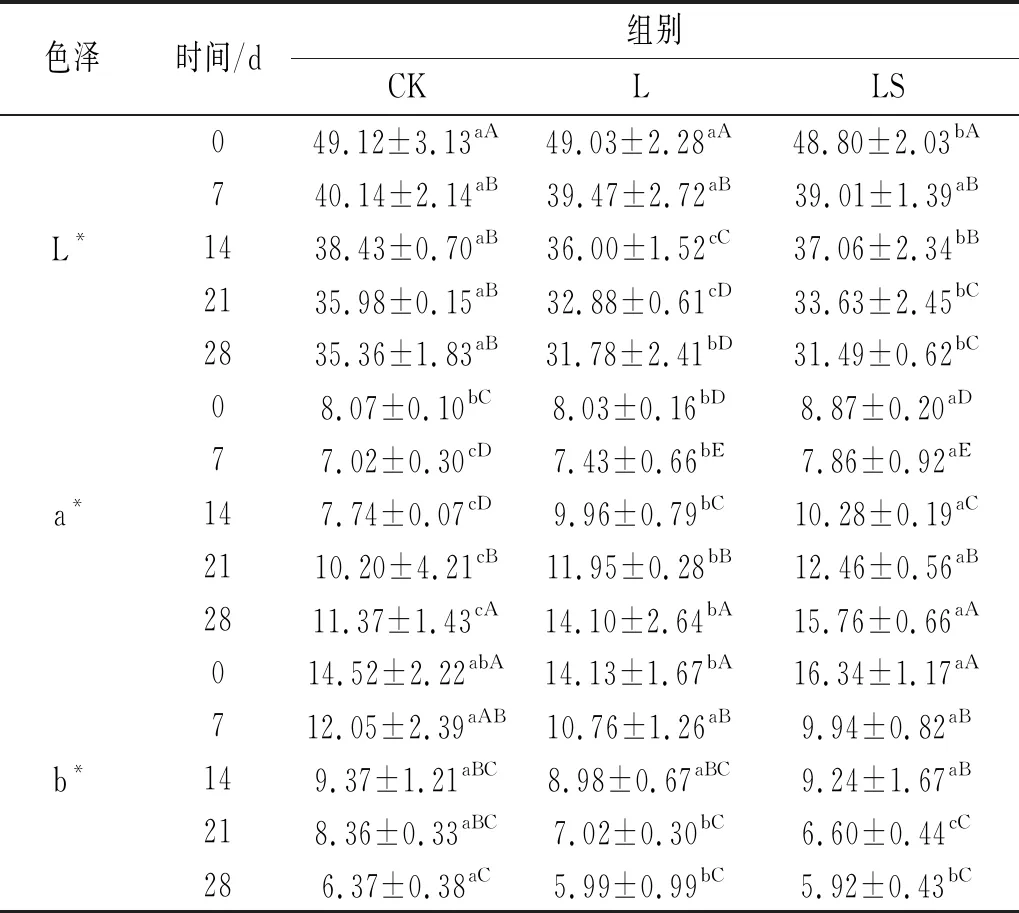
表2 发酵香肠L*、a*、b*值
由表2可知,发酵过程中亮度值(L*)呈现下降的趋势,各处理组受发酵时间的影响显著(P<0.05),数值从49下降到31。Casaburi等[10]也发现香肠的L*值随着发酵时间的延长而降低。同样,Kayaardi等[11]发现sucuk香肠的L*值普遍在成熟过程的15 d内下降,L*的降低是由于水分的流失而形成深色。从各处理组看,发酵28 d时,接菌处理组L和LS的L*显著低于对照组CK(P<0.05)。
在成熟期间,红度值(a*)呈现先下降后上升的趋势,0~7 d轻微下降(P<0.05),14 d时开始上升。而a*值的降低可能是亚硝基红蛋白因为乳酸的产生发生变性[12]。该结果与Ge等[13]的研究结果相一致,在探究植物乳杆菌NJAU-01对发酵香肠品质影响时发现a*值先下降后上升。从各处理组看,发酵结束时,接菌组L和LS的a*值显著高于对照组CK(P<0.05)。
在成熟期间,黄度值(b*)呈现下降的趋势,各处理组受发酵时间的影响显著(P<0.05),数值从16下降到5。b*值的降低表明香肠的颜色趋于蓝色,而不是变成黄色。这可能是由于褐变反应产生具有褐色的黑色素。西班牙的干腌香肠的b*在发酵和成熟阶段呈下降趋势[14],b*值的下降是由于微生物消耗氧气,导致氧合肌红蛋白减少,而氧合肌红蛋白是呈黄色的重要组成部分。从各处理组看,发酵10 d后,接菌组LS的b*值与显著低于对照组CK(P<0.05)。
2.3 香肠发酵过程中质构的变化
质构(TPA)是发酵香肠感官品质最重要的指标之一。硬度是指第一个压缩循环中的峰值力,单位为N。受发酵时间的影响,香肠的硬度值显著增加(P<0.05)。
由表3可知,在发酵0 d时各组间硬度差异不显著(P>0.05)。发酵的28 d,接菌组L、LS的香肠硬度显著高于对照组CK(P<0.05),主要是由于pH值的降低会逐渐诱导蛋白质的聚集,从而形成有序的蛋白质网络,增加硬度[15]。
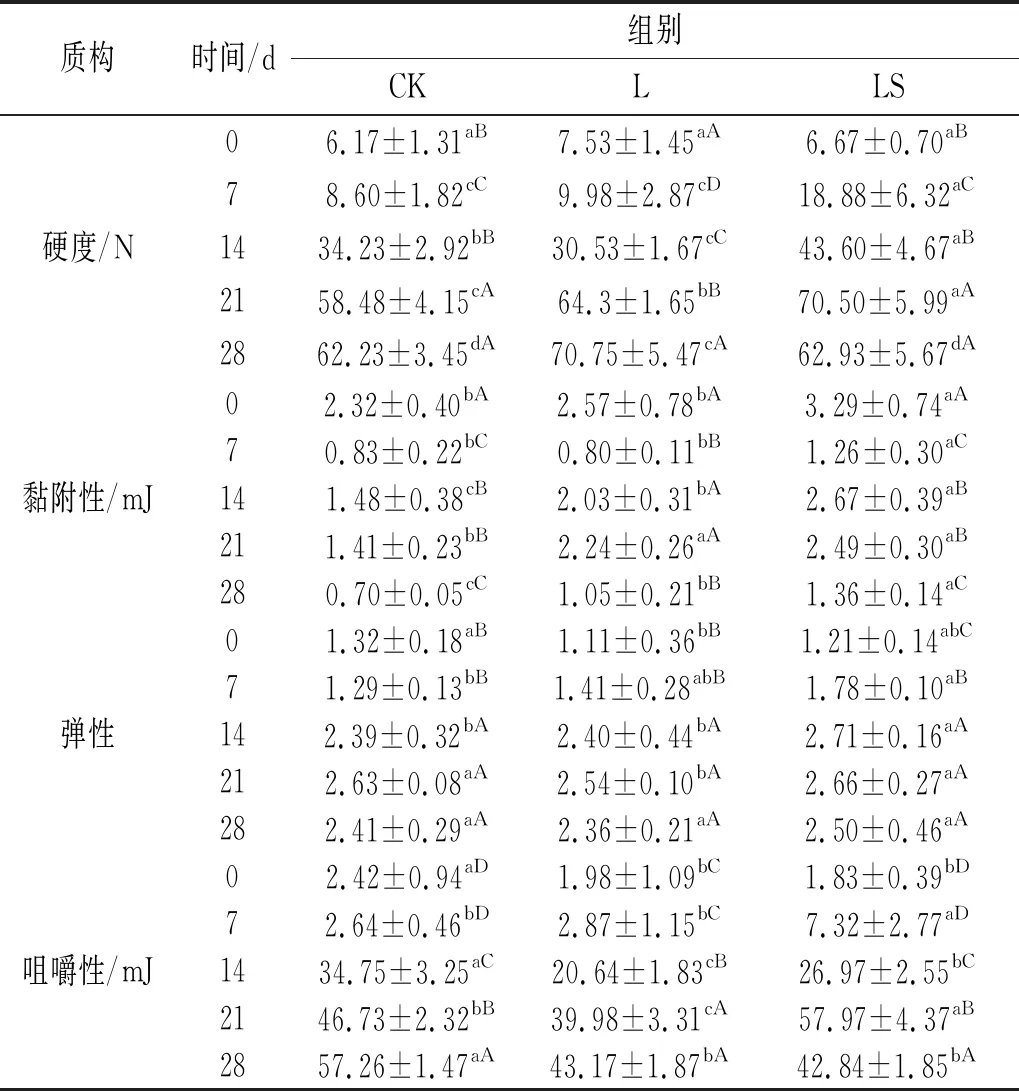
表3 发酵香肠质构分析结果
黏附性是指第一次压缩曲线达到零点到第二次压缩曲线开始之间的曲线负面积,反映探头由于测试样品的黏着作用所消耗的功,单位为mJ。在发酵过程中以0 d的黏附性最大;7 d时黏附性最小;14~21 d黏附性显著增加(P<0.05);在28 d时,黏附性又减小。从各个处理组看,发酵28 d时,所有接菌组的黏附性均显著高于对照组CK(P<0.05),接菌组L和LS的黏附性显著高于对照组CK(P<0.05)。
弹性是指食物在第一次咬合结束到第二次咬合开始之间恢复的高度。从发酵时间上看,14 d时各处理组弹性显著增加(P<0.05),发酵的21 d和28 d弹性保持不变。从各处理组看,添加发酵剂并没有影响弹性变化(P>0.05)。
咀嚼性是硬度和胶黏性的乘积,单位为mJ。随着发酵时间的延长,由于咀嚼性的变化不仅受硬度的影响也与水分活度呈负相关,各处理组的咀嚼性显著增加(P<0.05)。从处理组看,发酵28 d时,接菌组LS和L的咀嚼性要显著低于对照组CK(P<0.05),可能是由于菌株对蛋白水解的作用减小了咀嚼性。
2.4 发酵香肠肌原纤维蛋白变化
0,7,14,21,28 d发酵过程中肌原纤维蛋白有轻微的降解,见图2中(a)~(e)。

图2 发酵香肠肌原纤维蛋白变化
由图2可知,在10~28 kDa处条带强度略有增加,此外,在发酵的第7天和第14天发生明显的蛋白氧化现象,造成肌球蛋白重链的消失,而肌动蛋白在氧化的情况下条带强度变化程度较小。接菌组并没有在浓缩胶顶部出现明显的高分子蛋白聚集体即蛋白氧化现象,腐生葡萄球菌CGMCC 3475和植物乳杆菌CGMCC 18217在发酵的第4天蛋白降解显著,复配菌株则是在发酵的第2 天,220,95,45 kDa等主要条带蛋白降解程度明显强于其他处理组,发现复配菌株在香肠发酵结束后蛋白水解程度更为强烈。
2.5 发酵香肠风味物质分析
对发酵28 d后的香肠进行挥发性化合物的鉴定,见表4。
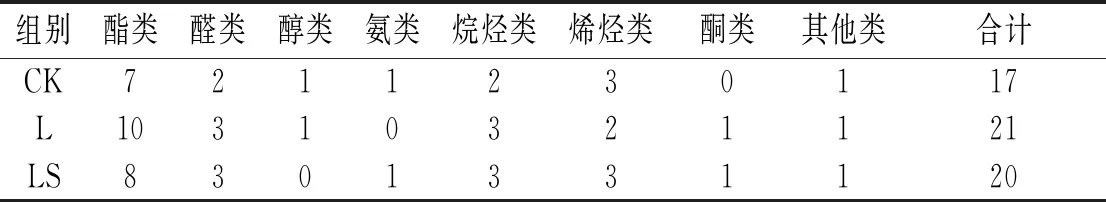
表4 发酵28 d时香肠中挥发性风味物质种类
由表4可知,对照组中CK检测到17 种化合物,接菌LS组检测到20 种化合物,说明接种腐生葡萄球菌CGMCC 3475及植物乳杆菌CGMCC 18217和腐生葡萄球菌CGMCC 3475的复配菌株影响了挥发性化合物的产生。
由图3和表5可知,3组之间检测到的风味物质种类差异显著,含量也有明显差异,在对照和接菌的香肠中共鉴定出28 种挥发性物质,包括酯类14种、醛类3种、氨类1种、醇类1种、烷烃类3种、烯烃类3种、酮类1种和其他化合物2种。这些挥发性化合物主要来源于脂质氧化、氨基酸分解代谢、碳水化合物发酵、微生物活动和香辛料。

图3 发酵香肠挥发性风味物质热图和风味物质的主成分分析

表5 发酵香肠挥发性物质含量
2.6 发酵香肠的感官评价
由表6可知,香肠形态方面,接菌组的差异不显著(P>0.05),接菌组L、LS的色泽要显著高于对照组CK(P<0.05),而接菌组与对照组的形态评分无显著性差异(P>0.05)。在香肠香味评分结果中,接菌组L、LS表现出良好的风味,显著高于对照组CK(P<0.05)。根据滋味评分可以得到,接菌组L、LS的滋味显著优于对照组CK(P<0.05)。对照组的感官评分低于接菌组,可能是接菌可以促进水解蛋白质和油脂,产生肽、游离氨基酸和游离脂肪酸,这些都是发酵风味和滋味所必需的。添加菌株发酵剂可显著提高香肠的感官品质,尤其是复配菌株LS不仅产生更高含量特征性风味,并且在色泽、香味和滋味的评价上优于其他处理组。
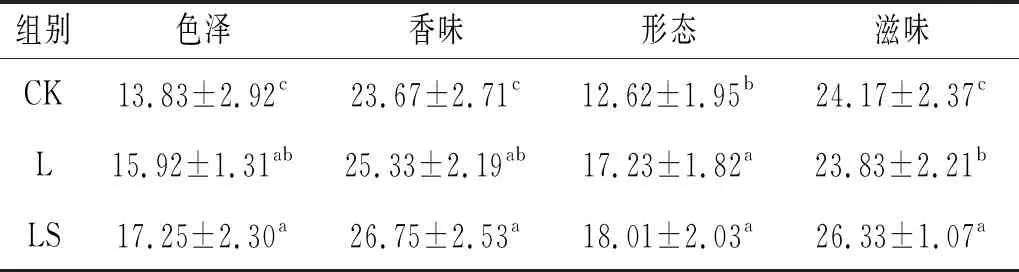
表6 发酵香肠的感官评价
3 结论
本文研究的目的是将腐生葡萄球菌CGMCC 3475单菌株以及腐生葡萄球菌CGMCC 3475和植物乳杆菌CGMCC 18217复配菌株运用于发酵香肠中,探究添加发酵剂对发酵香肠品质和风味的影响。研究发现,接菌组香肠的硬度、弹性、黏附性、L*值、a*值、乳酸菌和葡萄球菌菌落数、挥发性风味物质都有所增加,香肠的感官品质明显改善,pH值、Aw和b*值降低。复配菌株LS组在产生特征性风味物质酯类、醛类物质含量和感官评价中起到明显的促进作用。说明添加菌株及复配菌株对发酵香肠的风味、色泽、质地起到促进作用,可以改善香肠的品质及风味。

