阪崎肠杆菌在超高压条件下的转录组差异分析
廖巧明, 陶 晗
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
阪崎肠杆菌(Enterobactersakazakii)是一种常见的革兰氏阴性菌,可以寄生于人和动物肠道[1]。它与一系列传染病有关,例如新生儿革兰氏阴性脓毒症、脑膜炎和脑脓肿等[2]。阪崎肠杆菌近年来在奶粉中检出率逐年增加[3-4],2013—2017年,白银市婴幼儿食品中致病菌的检出率为17.42%,主要为蜡样芽胞杆菌和阪崎肠杆菌[5]。
奶粉常见的加工工艺在加工过程中一定程度上降低奶粉的口感,并对营养素造成一定的损失。因此,在保证奶粉质量的同时,检出食品中的阪崎肠杆菌及对其进行减控成为研究热点。目前,食品中的杀菌技术可以分为热杀菌和冷杀菌[6]。因为热杀菌会破坏一些热敏性食品的色、香、味及营养成分等,降低产品质量,所以冷杀菌技术的研究日益活跃,例如脉冲电场、臭氧、超声、辐照和超高压等杀菌技术[7-9]。其中,食品中超高压杀菌是将食品物料密封于食品级材料或置于无菌压力系统中(以水或其他流体作为传递压力的介质),在100~1 000 MPa压力下作用一段时间后使食品物料达到灭菌要求[10]。研究表明,超高压处理可以破坏食品贮藏期间细菌菌群结构[11],达到保证食品贮藏期的安全性和感官特性的目的[12]。
近年来,随着生物信息学的发展,在胁迫方面,利用高通量测序技术,通过转录组学研究细菌在不同因素胁迫后差异基因的分析成了手段之一[13-17]。通过DNA随机片段化处理、接头处理、克隆等手段,可以同时对数百万个DNA分子进行测序。该方法具有通量大、高灵敏度、高分辨率等优点[18-22];文献[23]使用RNA-Seq测序技术分析富硒条件下酿酒酵母内在分子机制;文献[24]探究原儿茶酚对阪崎肠杆菌毒力因子的抑制作用,质量浓度为2 g/L的原儿茶酚可以达到降低细菌黏附等能力,并导致9种与毒力相关基因的转录量下调;文献[25]通过测序技术分析副干酪乳杆菌SMN-LBK在乙醇胁迫下转录组学的变化,筛选出与细胞壁生物合成相关的6个差异基因,为乳酸杆菌的耐乙醇机制提供了理论依据。由于从RNA水平探究超高压对阪崎肠杆菌的杀菌机理研究目前尚少,基于此,本实验采用转录组测序技术对不同压强处理后的阪崎肠杆菌进行测序,基于转录组学采用生物信息学对阪崎肠杆菌基因的表达差异进行分析,对差异基因进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,为今后超高压在食品工业的应用提供一定的分子基础。
1 材料与方法
1.1 材料
实验菌株(阪崎肠杆菌 ATCC 29544)购自于北京北纳创联生物技术研究院,并保存在-20 ℃冰箱中。
1.2 菌株培养
取50 μL阪崎肠杆菌液(ATCC 29544)接种于5 mL的灭菌营养肉汁培养基(蛋白胨5.0 g,牛肉浸取物3.0 g,NaCl 5.0 g,蒸馏水1.0 L)中,并在37 ℃培养箱中孵育24 h。然后,从中取2%的接种量接种已活24 h的阪崎肠杆菌于10 mL已灭菌的营养肉汁培养基中,在37 ℃条件下在培养箱中培养4 h。
1.3 超高压处理
将5 mL的阪崎肠杆菌(约108CFU/mL)分装到10 mL聚乙烯塑料袋中,包装封口后进行不同压强的超高压处理(50、100、200、300、400 MPa),处理时间为10 min。
1.4 存活量测定
将超高压处理后的菌液在8 000 r/min条件下离心3 min,取其上清液与相同体积的0.85%生理盐水重悬,并吸取0.1 mL重悬液于无菌的0.85%生理盐水中梯度稀释,然后在营养肉汁固体培养基(蛋白胨5.0 g,牛肉浸取物3.0 g,NaCl 5.0 g,琼脂15.0 g,蒸馏水1.0 L)上涂布,在37 ℃培养箱中孵育过夜,并计算存活量,每组实验进行3次。
1.5 细菌总RNA提取
采用DEPC处理所有实验相关耗材,根据制造商的说明(TIANGEN),使用RNAprep Pure Cell/Bacteria Kit从阪崎肠杆菌细胞中提取总RNA,并使用DNase Ⅰ(TaKara)去除基因组 DNA。RNA样品提取后分别进行琼脂糖凝胶电泳、Nanodrop和Agilent 2100分析RNA降解程度以及是否有污染,检测RNA的纯度(OD260/OD280)和RNA的完整性。经过检测后才用高质量的RNA样品来构建测序文库,并上机测序。
1.6 文库制备和转录组测序
样品检测合格后,通过Ribo-zero试剂盒去除rRNA来富集mRNA。随后加入裂解液将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物(random hexamers)合成一链cDNA,然后加入缓冲液、dNTPs(dNTP中的dTTP用dUTP取代)、DNA polymerase Ⅰ和RNase H合成二链cDNA,用AMPure XP beads纯化双链cDNA,之后用USER酶降解含有U的cDNA第二链。纯化的双链cDNA先进行末端修复、加A尾并连接测序接头,再用AMPure XP beads进行片段大小选择。最后进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并用AMPure XP beads纯化PCR产物[26],得到最终文库。
文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库质量浓度至1 ng/μL,随后使用Agilent 2100对文库的插入片段长度(insert size)进行检测,insert size符合预期后,使用qPCR方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol/L),以保证文库质量。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling后进行HiSeq/MiSeq检测[27]。
1.7 数据分析
HTSeq v 0.6.1用于分析每个样品的基因表达水平,并根据基因长度计算每个基因的FPKM,然后将reads计数映射到该基因上。用DESeq进行差异表达分析,DESeq提供统计例程,基于负二项分布模型进行差异基因的表达分析,以P<0.05、|lb(差异倍数)|≥2为筛选条件,筛选获得实验组与空白组之间表达差异的基因。利用GOseq R对差异表达基因进行基因本体论GO富集分析,修正基因长度偏倚。P校正值小于0.05时,认为差异表达基因显著富集。使用KOBAS软件检测差异表达基因在KEGG通路中的富集情况。
2 结果与分析
2.1 不同压强对阪崎肠杆菌的影响
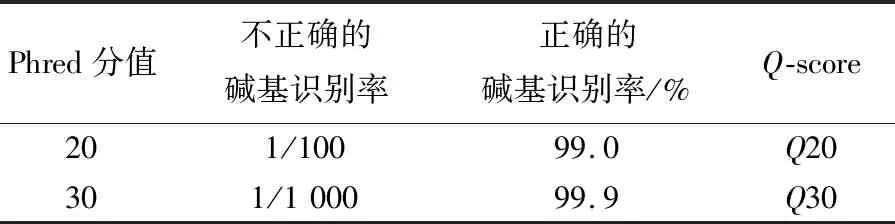
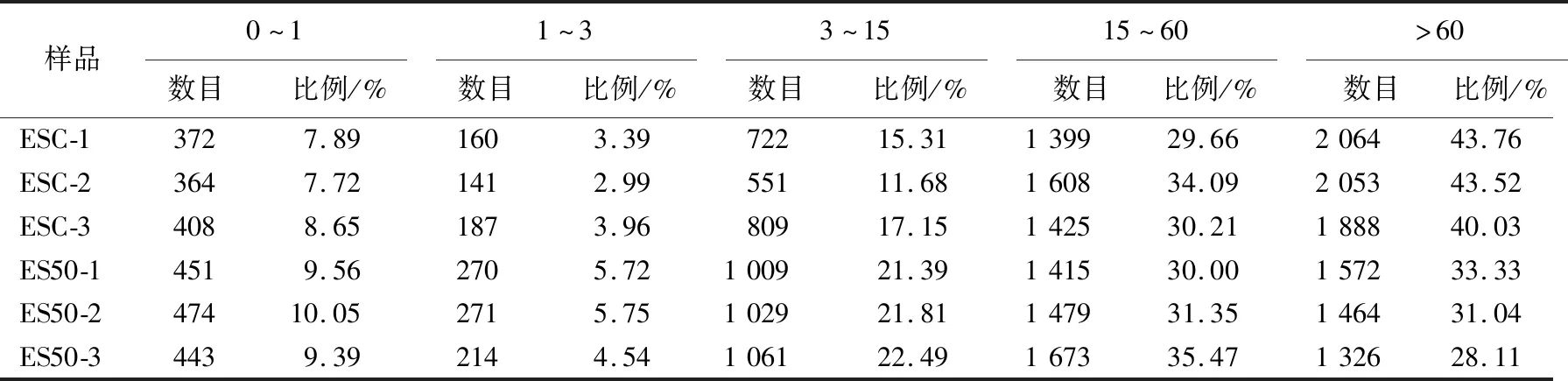
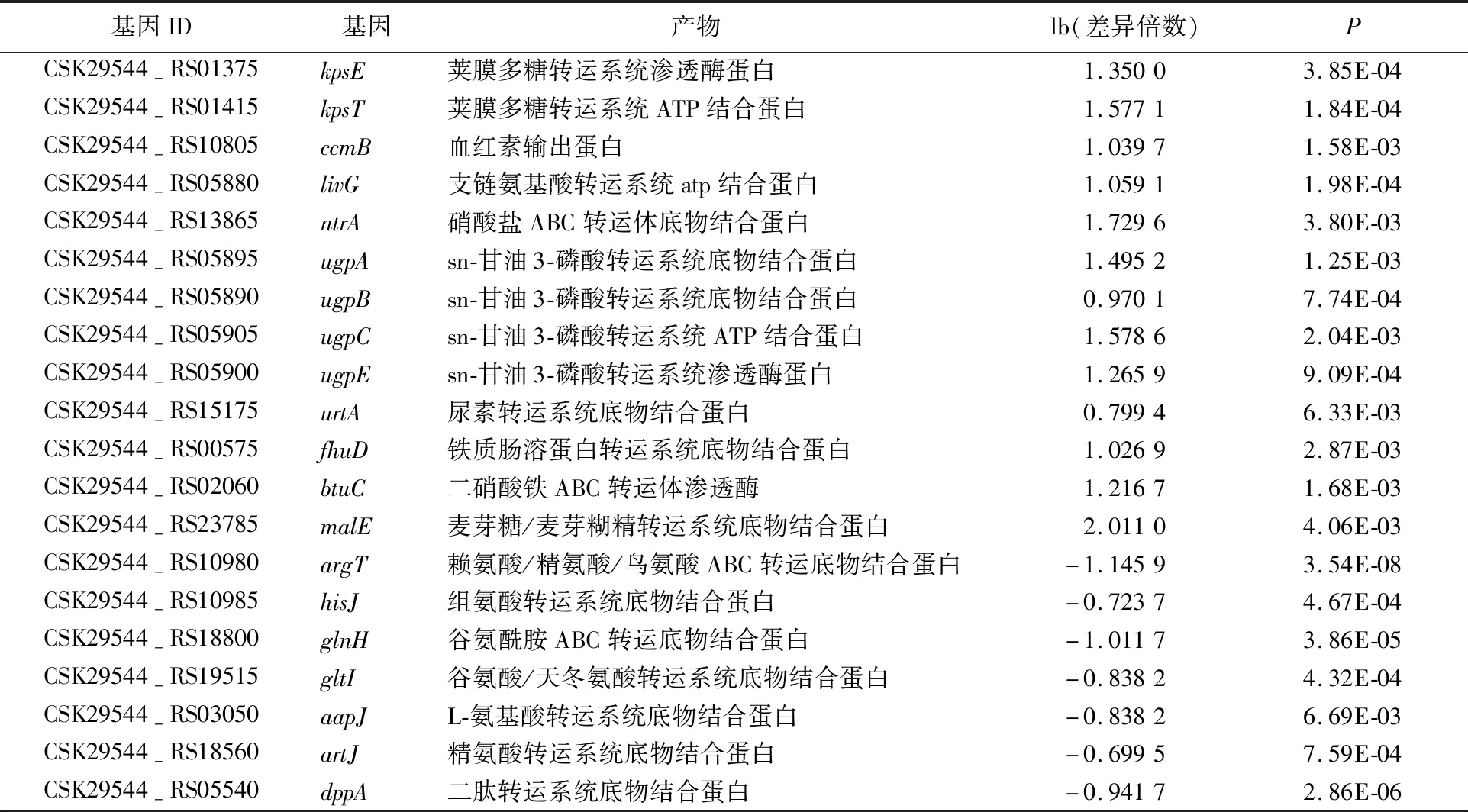
不同超高压压强对阪崎肠杆菌的影响如图1所示。图1中,*表示P<0.05;***表示P<0.001。由图1可知,以未进行超高压处理的阪崎肠杆菌作为对照组,以压强条件为50、100、200、300、400 MPa对阪崎肠杆菌进行超高压处理,未处理时,阪崎肠杆菌每毫升活菌数为109.39CFU;在50 MPa条件下,阪崎肠杆菌每毫升活菌数下降至109.25CFU,存活率为98.51%,随着处理压强的增加,阪崎肠杆菌的存活数减少;在400 MPa条件下,阪崎肠杆菌每毫升活菌数下降至106.27CFU,存活率为66.77%;50 MPa时,0.01 Phred指每个碱基测序错误率,其测序碱基质量值(Phred score,Qphred)通过公式转化得到;Phred分值、不正确的碱基识别率、正确的碱基识别率以及Q-score的对应关系见表1所列。 表1 碱基识别与Phred分值之间的简明对应关系 原始测序序列(sequenced reads,raw reads)中含有带接头的、低质量的读长(reads)以保证信息分析质量,必须对原始数据(raw reads)过滤,得到过滤数据(clean reads),后续分析都基于clean reads,测序数据统计结果见表2所列。 表2 测序数据统计结果 表2中,GC百分比表示碱基G和C的数量总和占总的碱基数量的百分比;Q20表示原始数据中Phred数值大于20的碱基数量占总碱基数量的百分比;Q30表示原始数据中Phred数值大于30的碱基数量占总碱基数量的百分比。 通过转录组测序,本文共获得108 643 634个原始数据,对原始片段进行过滤处理后得到106 852 708个过滤数据。由表1可知,对照组和50 MPa处理组的Q20值均大于97%,Q30值均大于91%,且GC百分比分别为55.84%、55.48%。表明转录组测序数据质量好、准确性高,可用于后续实验分析。 FPKM(expected number of Fragments Per Kilobase of transcript sequence per Millions basepairs sequenced)是最常用的基因表达水平估算方法[28],是指每百万片段中来自某一基因每千碱基长度的片段数目,被用来增加不同基因、不同实验估计基因的可比性。 FPKM结果见表3所列。 表3 不同表达水平区间的基因数量 由表3可知,处理组的基因PFKM在1~3区间最低,每个基因的表达水平在2.42%~5.75%范围内;基因平均表达量在FPKM>60区间最高,每个基因的表达水平在28.11%~54.00%范围内,说明多数基因均高水平表达,数据具有统计学意义[29]。 差异表达基因的火山图如图2所示。 由图2可知,与对照组相比,在50 MPa处理条件下,差异表达的基因总共635个,其中:上调基因481个;下调基因154个。 差异基因GO富集情况见表4所列。 50 MPa条件下差异基因GO富集分析如图3所示。 GO富集分析以阈值P<0.05为依据评价差异基因的主要生物学功能, GO富集分析分为分子功能(molecular function)、生物过程(biological process)和细胞组成(cellular component)3个部分。由图3和表3可知,50 MPa和未处理组相比,生物过程组细胞定植、定位确立以及转运为显著富集GO term,分别涉及159、156、155个基因;分子功能组中细胞膜部分为显著富集GO term,涉及相关基因180个,而细胞组成没有显著富集GO term。 表4 差异基因本体(GO)富集情况 差异基因的KEGG富集分析散点图如图4所示。差异基因的KEGG富集情况见表5所列。 表5 差异基因KEGG富集情况 在生物体内,不同基因相互协调行使其生物学功能,通过通路显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号传导途径[30]。KEGG是系统分析基因功能、基因组信息数据库。在KEGG富集散点图中,KEGG富集程度通过富集因子、q值和富集到此通路上的基因数来衡量。其中富集因子指该通路中富集到的差异基因数与注释基因数的比值。富集因子越大,表示富集的程度越大。 q值是做过多重假设检验校正后的值,其取值范围为[0,1],越接近于0,表明富集越显著。由表5可知,差异显著基因主要参与了腺苷三磷酸结合盒ABC转运蛋白(ATP-binding cassette transporter)、双组分调控系统(two-component system)、硫代谢(sulfur metabolism)、氮代谢(nitrogen metabolism)等。 腺苷三磷酸结合盒ABC转运蛋白差异显著基因见表6所列。 由图4和表6可知,富集到腺苷三磷酸结合盒ABC转运蛋白通路上的基因有50个,呈显著富集;富集到硫代谢通路上的基因有20个;富集到氮代谢、细胞趋化性通路上的基因有10个;富集到铁团非核糖体肽的生物合成通路上的基因有8个;富集到双组分调控系统、微生物在不同环境中的代谢,甘氨酸、丝氨酸和苏氨酸代谢通路的基因分别有30、30、5个。 ABC转运蛋白系统是一个与结构相关的吸收和外运系统的超家族,ABC转运蛋白核心是跨膜结构域和核酸结构域,它参与了大量物质的转运过程,因此对细菌的生命活动十分重要[31]。由表6可知,超高压的处理导致ES50组相对ESC组,ABC转运蛋白家族中kpsE/T、ugpA/B/C/E等基因显著上调表达,基因glnH/P、gltI/K/J等基因显著下调。差异表达的基因参与调控荚膜、磷壁酸、氨基酸等。 荚膜是细菌在生命活动中会在细胞的表面形成一层包裹菌体的黏液样物质。荚膜多糖在细菌生命活动中起重要作用,如维持细胞结构完整性、保护性免疫、细菌毒力等[32]。kpsE是荚膜多糖转运系统渗透酶蛋白,kpsT是荚膜多糖转运系统ATP结合蛋白,两者在50 MPa超高压处理后显著上调,在加速荚膜多糖形成的过程也产生了毒素,这是阪崎肠杆菌在逆环境中的一种自我保护方式。 文献[33]研究发现,致病性大肠杆菌△kpsED缺失株在鸡的体内定植能力下降并失去致病力,进一步证明了荚膜多糖与细菌致病性的关系。 表6 腺苷三磷酸结合盒ABC转运蛋白差异显著基因 磷壁酸根据醇组分不同可分为核糖醇壁酸(核糖醇-5-磷酸的聚合物)和甘油磷壁酸(sn-甘油-3-磷酸的聚合物)。磷壁酸参与到细胞多种生命活动中,例如细菌的黏附和定植、细胞自溶等。本研究发现ugpA/B/C/E基因显著上调,说明阪崎肠杆菌在超高压的胁迫下,ugpA/B/C/E基因被激活,加速sn-甘油-3-磷酸的形成。由表6可知,与无机盐转运与代谢相关的基因也发生了显著上调,如cysP/U/W、ntrA/B/C等,文献[34]研究表明,副溶血性弧菌在超高压的胁迫下,与无机盐离子转运与代谢、ABC型磷酸盐转运系统、生物过程调控相关的基因转录水平显著提高,并认为这些有助于菌株对超高压的耐受能力,与本研究的结果一致。 氨基酸在细菌的生长代谢活动中至关重要。由表6可知,与氨基酸相关的基因发生了显著下调,如与赖氨酸、精氨酸、鸟氨酸相关的argT,与组氨酸相关的hisJ,与谷氨酰胺相关的glnH/P,与谷氨酸、天冬氨酸相关的gltI/K/J等,这些基因的下调表明在超高压的胁迫下,阪崎肠杆菌对氨基酸的分解和利用能力降低。与肽相关的基因也发生了显著下调,表明在超高压胁迫下,阪崎肠杆菌对一些蛋白质的合成能力减弱,影响了自身的生长代谢。具体作用机制有待进一步研究。 本研究采用Illumina HiSeq 测序平台,对阪崎肠杆菌高压(50 MPa)条件下的转录组进行测序分析,并探讨超高压杀菌的分子机制,为后续进一步qPCR验证提供了方向。研究表明,超高压条件下,50 MPa与0 MPa相比,上调表达差异基因363个,下调表达差异基因395个。这些差异基因主要富集在ABC转运蛋白、氮代谢、细胞趋化性等方面。超高压通过对阪崎肠杆菌的ABC转运体造成损伤,影响了细胞的跨膜转运能力,破坏了细胞的正常新陈代谢能力,从而起到了杀菌的作用。2.2 测序数据质量分析

2.3 基因表达分析
2.4 差异基因表达分析
2.5 差异基因功能分析

2.6 差异基因的KEGG富集分析

3 结 论

