手术、化疗和放疗对胃癌患者营养状态的影响及与贫血发生、发展的关系研究
吴雨燕 程珍 潘湘涛
肿瘤相关性贫血是指患者在肿瘤发生、发展以及治疗过程中发生贫血情况[1],是肿瘤患者的常见并发症。有报道发现治疗前贫血>40%,而治疗后则高达70%~90%[2-4],引起肿瘤相关性贫血的机制复杂、原因众多,并且在同一种肿瘤的不同疾病过程中也有多种因素和机制[4-6]。贫血是独立于放化疗之外的影响肿瘤患者生存的危险因素[7],已逐步成为影响患者预后的重要临床问题,引起了广泛的临床关注。通常认为引起肿瘤相关性贫血的原因主要有3 个方面[8,9]:①肿瘤本身的因素,如造血原料的缺乏、营养不良、患者的年龄和性别、临床分期、有无消化道出血等;②治疗相关性,如手术、化疗和放疗等各种治疗手段;③炎症介导的铁代谢紊乱,是目前认为最重要的肿瘤相关性贫血的发生机制。如炎症状态下白细胞介素(IL)-6 高表达,引起铁调素(hepcidin)高表达,后者引起机体对铁的失利用,表现为血清铁蛋白(serum ferrintin,SF)升高和Hb 下降,甚或发生贫血。本文检测了胃癌患者手术、化疗和放疗前后的RBC、Hb、ALB 和前白蛋白水平,以探讨治疗方式与胃癌患者贫血发生、发展之间的关系。
1 资料与方法
1.1 一般资料 选择苏州大学附属太仓医院2011 年1 月~2020 年12 月期间住院手术治疗的胃癌患者448例(手术组),同期接受化疗的223例胃癌患者(化疗组),2016 年1 月~2020 年12 月接受放疗的50例胃癌患者(放疗组)作为研究对象。纳入标准:所有患者均为术后病理确诊,临床资料基本完整,并获得知情同意。排除标准:存在化疗禁忌证者;合并其他部位恶性肿瘤者;合并有肝脏、肾脏等慢性病等疾病。手术组患者中,男289例,女159例;年龄37~90 岁,平均年龄63.3 岁;≥60 岁240例,<60 岁208例。化疗组患者中,男160例,女63例;年龄23~87 岁,平均年龄63.5 岁;≥60 岁139例,<60 岁84例。放疗组患者中,男38例,女12例;年龄3~81 岁,平均年龄59.1 岁;≥60 岁29例,<60 岁21例。见表1。
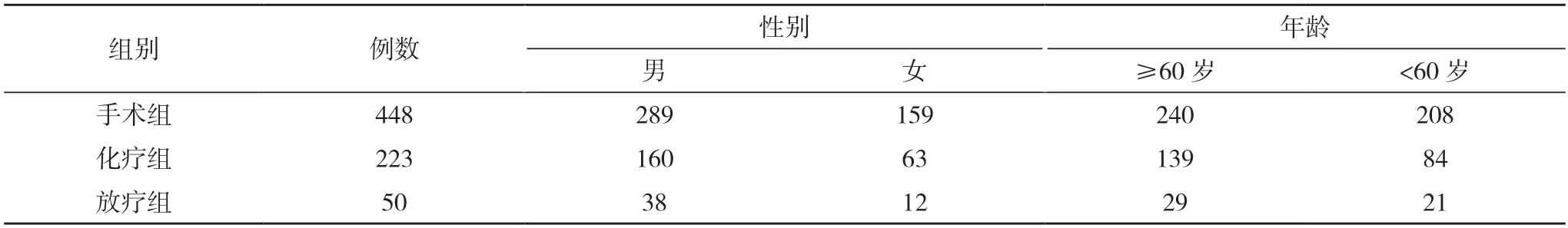
表1 三组患者一般资料(n)
1.2 方法 记录三组治疗前后的RBC、Hb、ALB、前白蛋白水平、贫血发生情况;比较三组患者治疗前后RBC、Hb、ALB 和前白蛋白水平以及贫血发生情况,并分析三组患者ALB、前白蛋白水平与RBC、Hb 水平的相关性。贫血判定标准:根据中华医学会血液学分会确定的贫血诊断标准,以男性Hb 水平<120.0 g/L、女性Hb 水平<110.0 g/L 为贫血。
1.3 统计学方法 采用SPSS23.0 统计学软件对数据进行处理。计量资料以均数±标准差(x-±s)表示,采用t 检验;计数资料以率(%)表示,采用χ2检验;相关性分析采用Pearson 分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 三组患者治疗前后RBC、Hb、ALB 和前白蛋白水平比较 三组治疗后的RBC、Hb、ALB 和前白蛋白水平均明显低于本组治疗前,差异均有统计学意义(P<0.05)。见表2。
表2 三组患者治疗前后RBC、Hb、ALB 和前白蛋白水平比较()
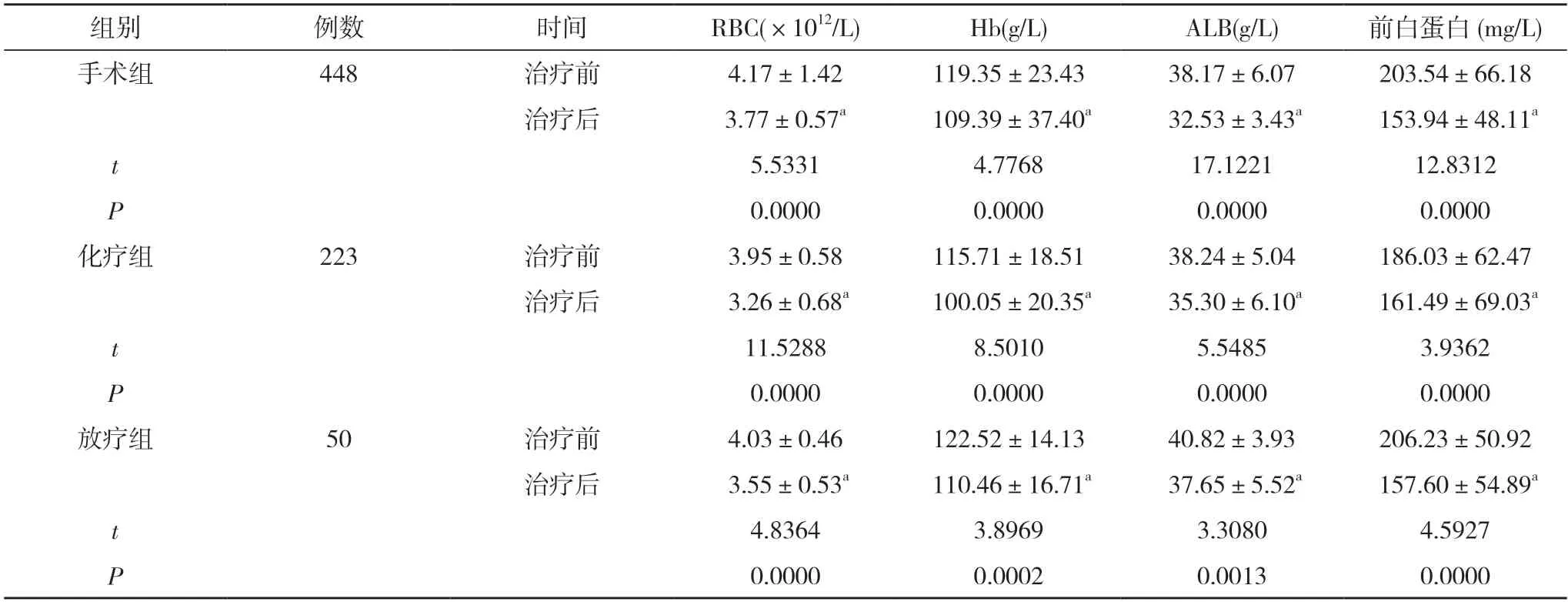
表2 三组患者治疗前后RBC、Hb、ALB 和前白蛋白水平比较()
注:与本组治疗前比较,aP<0.05
2.2 三组患者治疗前后贫血发生情况比较 三组治疗后的贫血发生率均明显高于本组治疗前,差异均有统计学意义(P<0.05)。见表3。
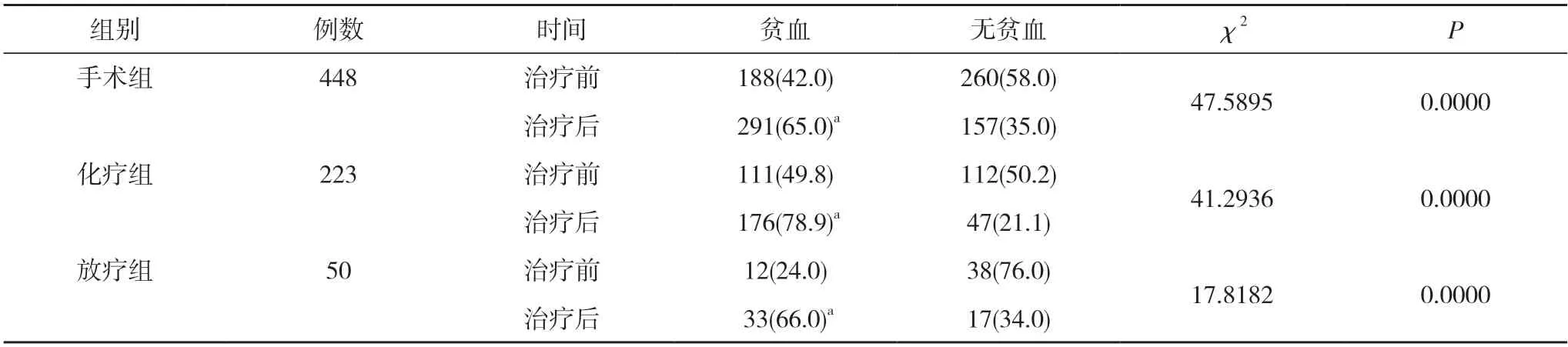
表3 三组患者治疗前后贫血发生情况比较[n(%)]
2.3 三组患者ALB、前白蛋白水平与RBC、Hb 水平的相关性分析 三组患者的ALB、前白蛋白水平均与RBC 和Hb 水平呈正相关(P<0.05)。见表4。
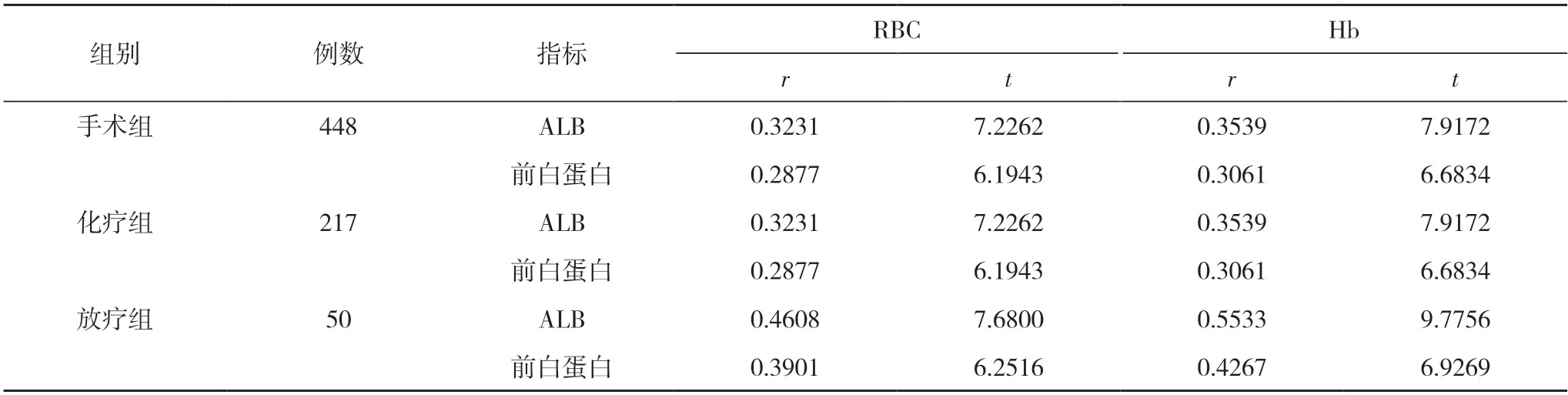
表4 三组患者ALB、前白蛋白水平与RBC、Hb 水平的相关性分析
3 讨论
目前的研究表明,贫血(特别是Hb<80.0 g/L)对肿瘤患者的生活质量和临床结局有显著影响[6],贫血是独立的不良预后因素,其初始程度可以作为预测复发或转移性胃癌患者预后的生物标志物[10],因此,早期关注并积极干预肿瘤相关性贫血不仅可以预防贫血的发生、发展,还可以指导临床用药、改善预后。
本研究发现,三组治疗后的RBC、Hb、ALB 和前白蛋白水平均明显低于本组治疗前,差异均有统计学意义(P<0.05);同时也发现,三组治疗后的贫血发生率均明显高于本组治疗前,差异均有统计学意义(P<0.05)。说明手术、化疗和放疗均可以引起胃癌患者发生或加重贫血,是胃癌相关性贫血的重要原因。该结果与国内外文献报道结果相一致[11-15]。如Jun等[12]报道胃癌长期存活者术后1 年累计贫血发生率为18.7%,术后5 年累计贫血发生率为39.5%。另一项研究报道术后3 个月贫血发生率为24.5%,术后4 年为37.1%。Kim 等[15]对Ⅰ期胃癌患者的研究结果显示,最终5 年累计贫血发生率为42.4%(其中566例患者术前无贫血)。放疗同样也可以引起贫血,如以色列的一项对202例接受放射治疗患者(包括乳腺癌、前列腺癌、结直肠癌、肺癌和支气管癌以及子宫癌患者)的研究中,57%的患者在治疗结束时最终出现贫血[16]。
胃切除术引起各种生理紊乱、对铁的摄入和吸收减少或壁细胞内源性因子分泌减少导致缺铁或巨细胞性贫血[11]。化疗对骨髓的抑制作用也可引起贫血。如多西紫杉醇可导致9%患者的贫血进展[13],Groopman等[14]报道以铂为基础的化疗方案由于骨髓和肾脏的联合毒性导致贫血或加重。由于造血细胞对放疗敏感,因而放疗常常会造成造血组织损伤从而引起贫血,尤其是照射范围广,照射造血骨组织多,照射剂量大的患者[17]。
本研究发现,三组治疗后的ALB 和前白蛋白水平均明显低于本组治疗前,差异均有统计学意义(P<0.05),与文献[1,2]结果一致,说明各种治疗均可以对患者的营养状况产生影响,这与多种因素有关。如治疗对机体创伤应激导致的炎症反应,对患者进食的影响,患者消耗增加等。有研究报道ALB 降低与各种癌症死亡率增高有关,ALB 或前白蛋白越低,胃癌的生存期越短[18]。作者进一步分析结果,表明三组患者的ALB、前白蛋白水平均与RBC 和Hb 水平呈正相关(P<0.05)。进一步说明了各种治疗确实通过多种途径引起胃癌患者贫血,并且营养状况的下降进一步引起贫血或加重贫血的程度。
综上所述,手术、化疗和放疗均会引起ALB 和前白蛋白水平降低,同时引起RBC 和Hb 水平降低、贫血发生率升高;RBC 和Hb 水平均与ALB 和前白蛋白水平呈负相关;手术、化疗和放疗均是引起胃癌患者贫血的重要原因。

