槐耳颗粒对逆转不完全热消融后肝癌细胞上皮间质转化(EMT)的作用及机制研究*
钟 海 孔凡创 周春晖 王晓光 刘晓琳
嘉兴市第二医院 浙江 嘉兴 314001
肝癌是世界范围内第五大恶性肿瘤[1]。近年来,热消融在肝癌治疗中发展迅速。本课题组研究显示[2],在直径小于3cm的小肝癌治疗中,完全消融疗效可与手术切除媲美。但部分肝癌很难达到理想的完全消融。
中药制剂槐耳颗粒作为肝癌根治性切除术后的辅助治疗,能显著延长无复发生存期,并有效减少肝外复发[3]。研究显示,槐耳能够有效逆转肿瘤细胞转移的初始阶段上皮间质转化(EMT)过程,从而抑制肿瘤的复发转移[4]。本研究通过建立亚致死肝癌细胞热损伤模型,探讨槐耳颗粒治疗不完全热消融后肝癌复发转移的机制。
1 材料与方法
1.1 材料:分述如下。
1.1.1 槐耳颗粒:国药准字:Z20000109,产品编号:B14006012409,购自启东盖天力药业有限公司。
1.1.2 细胞株:人肝癌(Huh7)细胞购自武汉普诺赛生命科技有限公司。购买的Huh7细胞被接种在由10%胎牛血清和DMEM培养基组成的生长培养基中。培养环境是37℃、含5%CO2的细胞培养箱。
1.1.3 实验试剂:DMEM细胞培养基(PM150210,Pro‐cell);胎 牛血清(164210,Procell);CCK-8溶液[40203ES60,翌圣生物科技(上海)股份有限公司];TRI reagent®(T9424,美国Sigma-Aldrich公司);Re‐vertAid™ First Strand cDNA Synthesis Kit(K1622,美国Thermo Scientific公司);RIPA裂解液(R0010,北京索莱宝科技有限公司)。
1.1.4 仪器:细胞培养箱;恒温水浴锅(上海比朗仪器制造有限公司);UV-1800紫外分光光度计(上海美析仪器有限公司);BX-51光学显微镜(日本OLYMPUS公司);Fast7500实时荧光定量PCR仪(美国ABI公司);BIORAD凝胶成像系统(Gel Doc™ XR+)
1.2 方法:分述如下。
1.2.1 构建亚致死肝癌细胞热损伤模型:收集对数生长期的Huh7细胞,在15mL聚丙烯管中(5×104个)密封(Parafilm封口膜)。根据分组,Huh7细胞被置于不同温度的恒温水浴锅中进行热应激处理。30min后,Huh7细胞被转移到37℃培养箱中恢复培养。
1.2.2 细胞分组:本研究包含以下细胞处理条件:①热损伤处理温度分别设定为41.5℃、42℃、42.5℃、43℃、43.5℃、44℃、47℃、50℃;②恢复培养的时间为1d、2d、3d、4d和5d;③槐耳干预浓度分为0、2、4、6、8g/L(溶剂为无血清DMEM培养基)。最终的热损伤和槐耳干预条件均通过CCK-8测定的细胞生存率确定。对照组细胞保持37℃培养。
1.2.3 CCK-8实验:收集的Huh7细胞处理为10000个/mL的细胞悬液。10μl CCK-8溶液加入100μl细胞悬液中。2h后用UV-1800紫外分光光度计测定450nm的吸光度,并计算Huh7细胞的生存率和抑制率[抑制率=(1-实验孔A450nm/对照组A450nm)×100%]。
1.2.4 Transwell实验:Huh7细胞被无血清培养基调整为1×105个/mL的细胞悬液。侵袭实验中,Corning Transwell小室上层铺有基质胶;迁移实验中不需要添加基质胶。小室上层添加100μl细胞悬液,下层添加600μl含血清培养基。72h后,小室下层的细胞被固定和染色。发生侵袭和迁移的Huh7细胞数量均在显微镜下观察和计数。
1.2.5 实时荧光定量(qRT-PCR):使用TRI reagent®分离细胞的总RNA。通过RevertAid™First Strand cDNA Synthesis Kit和PCR扩增仪的处理得到cDNA。cDNA、待测mRNA引物、SYBR Green染液与DEPC水混匀后被加入Fast7500实时荧光定量PCR仪中检测。mRNA水平统一按照2-ΔΔCT的形式。引物序列如下(5’-3’):N-Cadherin,(上游)AGGCTTCTGGTGAAATCGCA,(下游)GGAGGGAT‐GACCCAGTCTCT;vimentin,(上游)TCCGCACATTCGAGCAAA‐GA,(下 游)AAGCGCACCTTGTCGATGTA;snail,(上 游)CGAGTGGTTCTTCTGCGCTA,(下 游)GGGCTGCTGGAAGGTA‐AACT;E-Cadherin,(上游)CAGGCCTCCGTTTCTGGAAT,(下游)GGTGTATACAGCCTCCCACG;GAPDH,(上游)TGTGGGCAT‐CAATGGATTTGG,(下游)ACACCATGTATTCCGGGTCAAT。
1.2.6 Western blot检测:使用RIPA裂解液抽提Huh7细胞的总蛋白。测定蛋白浓度后,蛋白中加入上样缓冲液并高温变性。经过SDS-PAGE电泳和电转步骤,蛋白被转移到PVDF膜(1620177,美国Bio-Rad)上。PVDF膜在5%封闭液中孵育2h。再次清洗后,PVDF膜依次在稀释的一抗和二抗中孵育12h(4℃)和1h(室温)。1min后,通过凝胶成像系统检测蛋白表达。GAPDH在本实验中作为内参基因。
1.2.7 统计学方法:所有数据统计均通过Graphpad 8.0软件实现。计量资料统一按照±s的形式表示,两组差异比较采用独立样本t检验,三组及三组以上差异比较采用One-way ANOVA方差分析和Bofferroni事后检验法。统计学意义判定标准为P<0.05。
2 结果
2.1 热损伤对肝癌细胞活性的影响:随着热处理温度升高,Huh7细胞的存活率逐渐降低;从43.5℃处理开始,48h的细胞存活率显著低于同温度24h的细胞存活率(P<0.05),且44℃时细胞存活率降低约50%,见图1A。因此选择43.5℃作为后续处理温度。CCK-8实验显示,热处理早期,热处理组细胞活性低于对照组,见图1B和表1;从恢复培养3天开始,热处理组Huh7细胞的活性显著高于对照组(P<0.05),见图1B和表1。热处理条件最终设定为43.5℃恒温水浴处理30min,随后细胞送至37℃培养箱恢复72h。
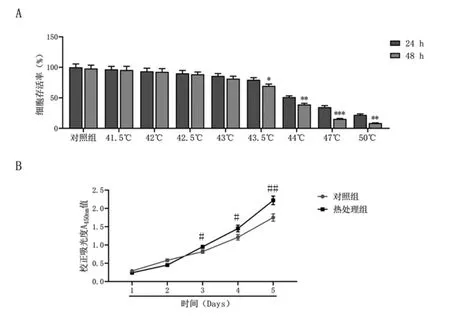
图1 热损伤对Huh7细胞活性的影响
表1 热损伤对Huh7细胞增殖力影响(±s)
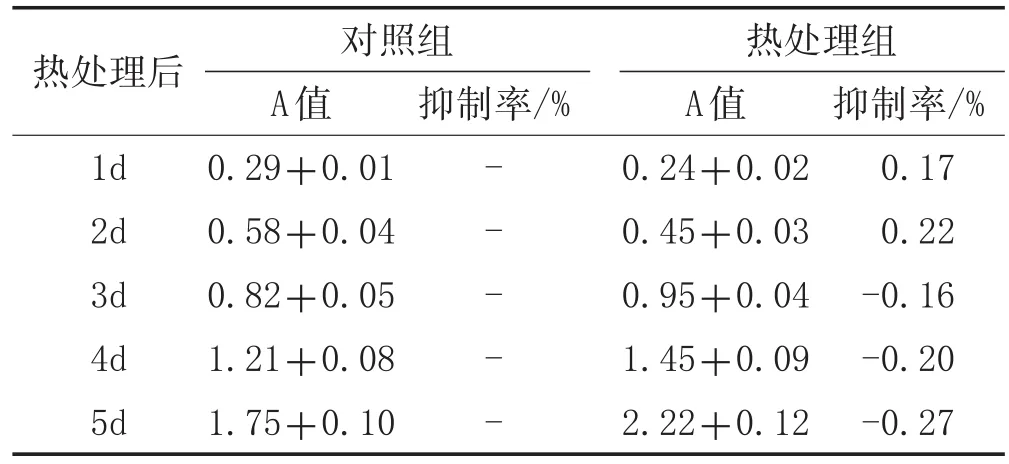
表1 热损伤对Huh7细胞增殖力影响(±s)
热处理后1d 2d 3d 4d 5d对照组A值0.29+0.01 0.58+0.04 0.82+0.05 1.21+0.08 1.75+0.10抑制率/%-----热处理组A值0.24+0.02 0.45+0.03 0.95+0.04 1.45+0.09 2.22+0.12抑制率/%0.17 0.22-0.16-0.20-0.27
Transwell实验结果显示,和对照组比较,热处理增加了侵袭和迁移的Huh7细胞数量(P<0.05),见图2A和2B。
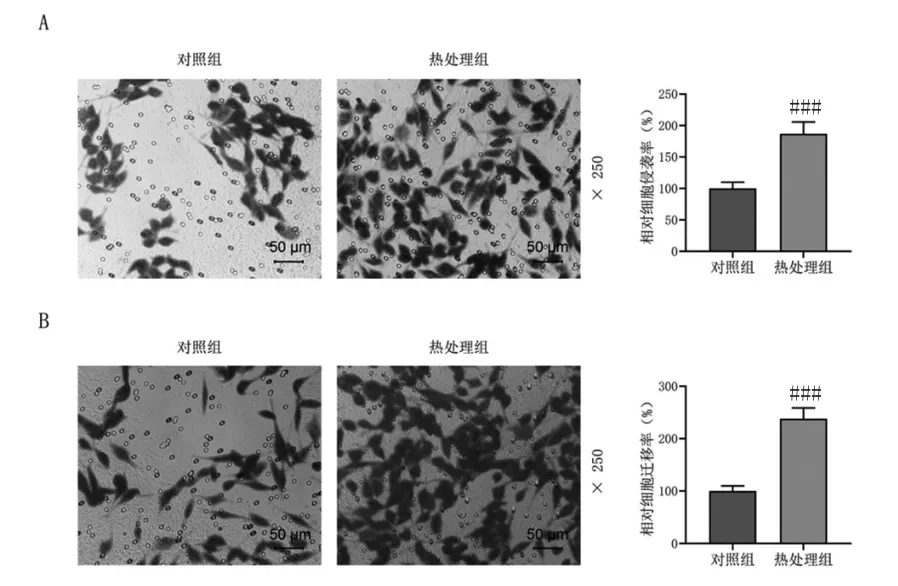
图2 热损伤对Huh7细胞侵袭和迁移的影响
2.2 热损伤对EMT相关基因的调控影响:qRT-PCR结果显示,和对照组比较,热处理组N-Cadherin、vimentin和snail的mRNA水平显著上调,E-Cadherin的水平显著下调(P<0.05),见图3A-D。Western blot检测结果显示,热处理上调N-Cadherin、vimentin和snail的蛋白,下调E-Cadherin蛋白,与对照组比较,差异具有统计学意义(P<0.05),见图3E-G。

图3 热损伤对Huh7细胞中EMT相关基因表达的影响
2.3 槐耳阻止热损伤诱导的Huh7细胞增殖、侵袭和迁移:与对照组比较,单纯热处理的Huh7细胞生存率高于对照组(P<0.05),见图4A。加入槐耳颗粒后,Huh7细胞的活性随着药物浓度的升高而降低;当槐耳浓度达到4g/L时,与0g/L组比较,差异具有统计学意义(P<0.05),见图4A。根据该结果,槐耳干预条件确定为6g/L、8g/L。
Transwell实验结果显示,与热处理组比较,槐耳减少了热处理诱导的Huh7细胞侵袭和迁移,有效地降低了Huh7细胞的侵袭率和迁移率(P<0.05),见图4B和4C。
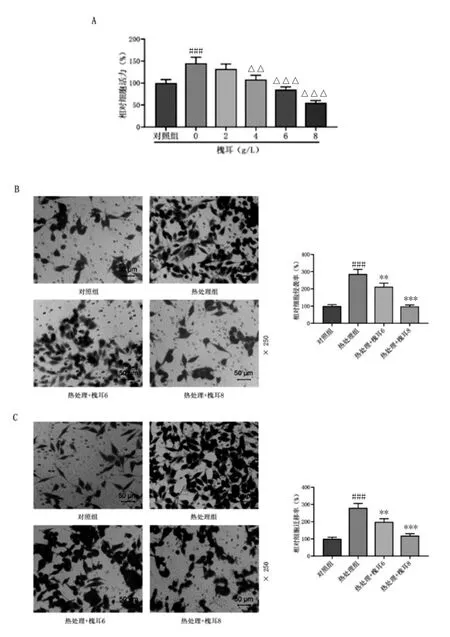
图4 槐耳阻止热损伤诱导的Huh7细胞增殖、侵袭和迁移
2.4 槐耳通过下调p-AKT蛋白,阻止热损伤诱导的EMT相关基因变化:Western blot检测结果显示,增加槐耳干预后,Huh7细胞中N-Cadherin、vimentin和snail蛋白表达下调,E-Cadherin水平上调,与热处理组比较,差异具有统计学意义(P<0.05),见图5A-E。另外,热处理组Huh7细胞中p-AKT的水平明显高于对照组(P<0.05),但是AKT表达没有变化;当细胞恢复培养时增加槐耳处理后,p-AKT水平降低(P<0.05),见图5F-G。
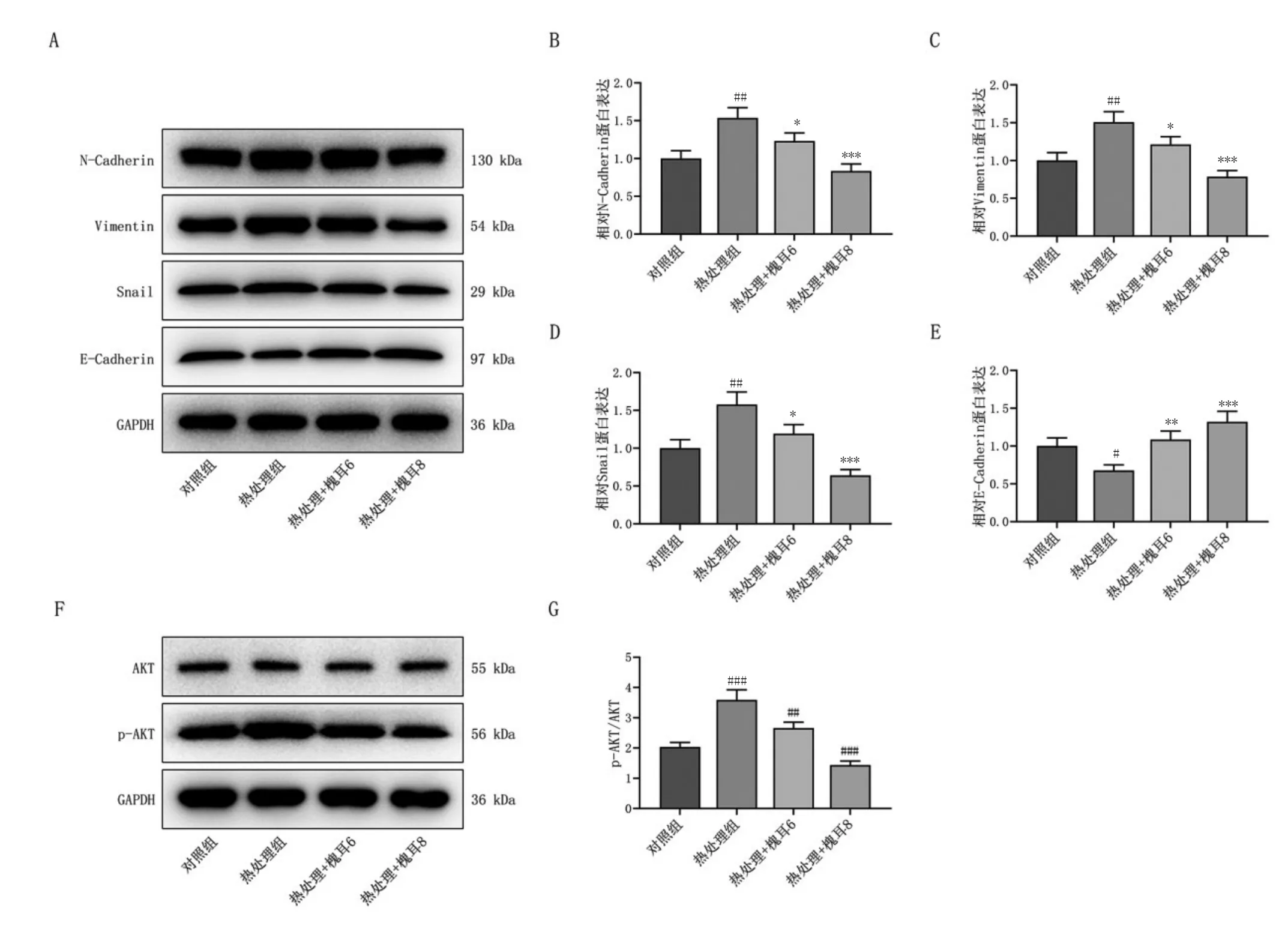
图5 槐耳下调p-AKT阻止热损伤诱导的EMT相关基因变化
3 讨论
近年来随着微创领域技术不断地革新,热消融技术已经被纳入肝癌根治性方案中。但这种治疗的缺陷是热能经过辐射后杀伤能力降低,导致了肿瘤残存和高转移复发的临床现象[5]。
EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。因此,检测标志性基因是监测EMT进程的关键。E-cadherin具有维持细胞间稳定性、连接性和细胞极性的能力,能够抑制肿瘤细胞的转移[6]。N-cadherin、Vimentin和Snail的上调则促进了EMT的发生。本文在亚致死肝癌细胞热损伤模型的基础上,通过检测上述基因,证明热损伤能够促进EMT进程。
槐耳及其提取物在诱导癌细胞凋亡、抑制癌细胞的转移等多种抗癌途径中的机制被挖掘,被广泛应用于癌症辅助治疗。本研究发现,槐耳减少了热处理后Huh7细胞的转移,机制可能与抑制p-AKT有关。众所周知,PI3K-AKT通路参与了包括肝癌在内的多种肿瘤的发生发展。例如Jondal等[7]证实使用AKT通路抑制剂能够降低热消融术后肝癌细胞的生长。这些结论较大程度上增加了本研究的可靠性。
综上,槐耳抑制不完全热消融诱导的EMT进程,减少肝癌细胞的转移,机制与抑制AKT磷酸化有关。

