芍药ACS基因的克隆及其蛋白质原核表达
肖士奎,李 芳,张文婷,吕淑芳,史国安,吴 疆,范丙友
(1.河南科技大学 农学院,河南 洛阳 471023;2.中机十院国际工程有限公司,河南 洛阳 471003;3.榆林学院 信息工程学院,陕西 榆林 719000)
芍药(PaeonialactifloraPall.)为芍药科芍药属多年生草本植物,兼具观赏和药用价值[1]。“维士与女,伊其将谑,赠之以芍药”出自《诗经·国风·郑风·溱洧》,这表明芍药作为中国的“爱情花”,至少已有超过3 000 a的栽培历史[2]。芍药花色丰富,花型娇美,花梗长而挺直,因而非常适宜作切花应用[1]。芍药切花主要应用于婚礼和宴会等场合,目前全球已有50多个国家在开展芍药切花生产。
桃花飞雪是我国传统的芍药品种,花型皇冠型,中花品种,花初开桃红色、盛开后变粉,花量大、花期长、形态娇美,是优良的切花品种[3]。因瓶插期相对较短,影响了其商业开发价值。花瓣是该品种切花内源乙烯释放的主要器官,花瓣的乙烯释放速率具有明显的跃变峰,暗示乙烯在切花衰老进程中发挥重要作用;花瓣乙烯释放的快速增加诱发了呼吸跃变的发生,进而启动整个开花和衰老进程[4]。芍药切花品种班可海尔和杨妃出浴也对乙烯敏感,外源乙烯处理后乙烯生物合成及信号转导途径中有多个基因上调[5]。
作为植物体内唯一的气体植物激素,乙烯参与种子萌发、幼苗生长、果实成熟、叶片和花瓣衰老及脱落等生长发育进程[6]。通过一系列精巧的试验,乙烯的生物合成途径已被详尽地阐明[7]。在乙烯生物合成途径中,1-氨基环丙烷-1-羧酸合酶(1-aminocyclopropane-1-carboxylic acid(ACC)synthase,ACS),以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)为底物催化生成了乙烯生物合成的直接前体ACC[8]。目前,已从拟南芥(Arabidopsisthaliana)[9]、月季(Rosahybrida)[10]、牡丹(Paeoniasuffruticosa)[11-12]、文心兰(OncidiumGower ramsey)[13]和无花果(FicuscaricaLinn.)[14]等高等植物中分离出编码乙烯生物合成关键酶ACS的基因序列,但芍药ACS基因尚未见报道。因而,基于cDNA末端快速扩增(Rapid amplification of cDNA ends,RACE)技术克隆了芍药PlACS基因cDNA序列,对其进行了生物信息学分析,构建了PlACS基因的原核表达载体并建立了PlACS重组蛋白的高效原核表达体系,以期为后续该基因的生物学功能和分子机制研究奠定基础。
1 材料和方法
1.1 试验材料
芍药桃花飞雪花瓣采自河南科技大学芍药园,液氮速冻后带回实验室保存于-80 ℃冰箱备用。原核表达载体pET-32a及宿主菌大肠杆菌BL21(DE3)保存于牡丹种质创新与精深加工河南省工程实验室。大肠杆菌DH5α感受态细胞、DNA 连接试剂盒、DNA凝胶回收试剂盒、克隆载体 pMD18-T、TaqDNA 聚合酶、限制性核酸内切酶BamH Ⅰ和Hind Ⅱ、蛋白质分子质量标准(低)均购自大连宝生物公司;高保真KOD-Plus DNA聚合酶为日本TOYOBO公司产品;其余试剂均为进口或国产分析纯。
1.2 PlACS基因全长cDNA的克隆
根据芍药近缘物种ACS蛋白的保守区设计简并引物PlACS-F和PlACS-R(表1),用于扩增芍药ACScDNA保守区。基于ACS基因保守区测序结果,设计5′-RACE和3′-RACE引物PlACS-5′-1st和PlACS-3′(表1),分别与SMARTTMRACE cDNA Amplification Kit(TaKaRa,大连)自带引物UPM配对使用。以CTAB-LiCl法[15]提取桃花飞雪盛花期花瓣总RNA,按照RACE试剂盒说明书进行第1链cDNA合成及5′-RACE和3′-RACE扩增。由于5′-RACE第1轮扩增条带模糊,因而设计了5′-RACE第2轮扩增引物PlACS-5′-2nd,与试剂盒自带引物NUP配对使用,以5′-RACE第1轮扩增产物为模板进行第2轮5′-RACE扩增。将克隆测序的PlACS保守序列、3′-RACE扩增产物和5′-RACE第2轮扩增产物拼接后,得到芍药PlACS基因全长的cDNA序列,并对拼接序列进行ORF预测(https://www.ncbi.nlm.nih.gov/orffinder/)。

表1 引物序列Tab.1 Primer sequences
1.3PlACS基因编码蛋白质的生物信息学分析
应用Protparam软件(https://web.expasy.org/protparam/)进行蛋白质物理化学特性分析;应用ProtScale软件(https://web.expasy.org/protscale/)进行疏水性分析;应用PSORT(https://www.genscript.com/psort.html)进行亚细胞定位预测;应用TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)分析跨膜结构区域;应用SignalP(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)进行信号肽分析;应用NetPhos(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)预测磷酸化位点。
应用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构;应用SWISS-MODEL(http://swissmodel.expasy.org/)同源建模方法进行3D结构预测。
应用DNAMAN 7.0软件进行氨基酸序列比对分析;利用MEGA 5.0软件的Neighbor-Joining进行ACS的分子系统进化树构建,并用Bootstrap法(重复1 000次)对构建的进化树进行评估。
1.4 PlACS基因CDS的亚克隆
基于PlACS的CDS序列和原核表达载体pET-32a的MCS位点序列,设计含酶切位点BamH Ⅰ和Hind Ⅲ的PCR引物(表1),扩增得到PlACS的CDS。回收纯化目的基因片段,连接至克隆载体pMD18-T,转化大肠杆菌DH5α感受态细胞。将质粒PCR及BamH Ⅰ/Hind Ⅲ双酶切鉴定的阳性克隆送至华大基因公司进行测序。
1.5 PlACS基因原核表达载体的构建
用BamH Ⅰ/Hind Ⅲ对重组质粒pMD18-T-PlACS和原核表达载体pET-32a进行双酶切,酶切产物经1.0%琼脂糖凝胶电泳检测,回收并纯化目的基因片段和pET-32a载体,用DNA 连接试剂盒连接并转化大肠杆菌DH5α感受态细胞。将经质粒PCR及BamH Ⅰ/Hind Ⅲ双酶切鉴定后的阳性重组子转化大肠杆菌BL21(DE)获得基因工程菌。
1.6 IPTG诱导PlACS重组蛋白的表达
挑取1个PlACS基因表达工程菌的单菌落,接种在含Amp的LB液体培养基中,37 ℃培养至A600达0.6,加入IPTG使其终浓度为0.6 mmol/L,诱导继续培养4 h,收获菌体用于SDS-PAGE电泳检测。
1.7 PlACS重组蛋白高效表达体系的建立
为了建立芍药PlACS重组蛋白原核高效表达体系,分别对基因工程菌菌体密度A600、IPTG浓度及表达时间等影响重组蛋白表达量的因素进行了单因素的优化。
当基因工程菌菌体密度A600达0.1~1.1时,添加IPTG至终浓度为0.4 mmol/L,37 ℃诱导表达4 h后进行SDS-PAGE电泳检测。
当基因工程菌菌体密度A600达0.6时,添加IPTG至终浓度分别达0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 mmol/L。37 ℃诱导表达4 h后进行SDS-PAGE电泳检测。
当基因工程菌菌体密度A600达0.6时,加入IPTG至终浓度为0.4 mmol/L诱导,分别在2,5,10,20,40 min及1,2,4 h各取出1.5 mL菌液用于SDS-PAGE电泳检测。
1.8 PlACS重组蛋白表达形式分析
采用超声波充分裂解37 ℃ IPTG诱导表达的基因工程菌,12 000 r/min离心20 min,分别收集细菌裂解上清液和沉淀用于SDS-PAGE电泳检测。
2 结果与分析
2.1 PlACS基因的克隆
应用高保真KOD-Plus DNA聚合酶扩增,成功获得了PlACS基因保守区、3′-RACE和5′-RACE第1轮及第2轮PCR产物(图1)。PCR产物经加A后与T载体连接,将连接产物转化大肠杆菌感受态细胞,获得了阳性克隆。测序结果表明,PlACS保守区长576 bp,3′-RACE扩增产物长1 165 bp,5′-RACE扩增产物长895 bp;三者拼接后得到的PlACS基因全长cDNA为1 752 bp(GenBank登录号为JX512359),其5′-UTR长134 bp,3′-UTR长139 bp,CDS长1 479 bp,编码492个氨基酸,其中含有51个带负电荷的氨基酸残基(D和E)和51个带正电荷的氨基酸残基(R和K)。

A.保守序列;B.3′-RACE;C.5′-RACE第1轮;D.5′-RACE第2轮。A.Conservative sequence;B.3′-RACE;C.5′-RACE round 1;D.5′-RACE round 2.
2.2 PlACS编码蛋白质的理化特性分析
蛋白质理化性质预测分析结果显示,PlACS蛋白分子式C2465H3835N673O717S26,分子质量55.20 ku,理论等电点7.13,定位于细胞质内,不具有信号肽或跨膜结构,不稳定系数为43.78,总平均疏水性为-0.194,推测PlACS为亲水性不稳定蛋白质。经NetPhos软件分析,发现PlACS蛋白存在44个可能的磷酸化位点,其中26个位于丝氨酸(S)上,13个位于苏氨酸(T)上,5个位于酪氨酸(Y)上(图2)。

ATG.起始密码子;TAA.终止密码子;小写字母.5′-UTR和3′-UTR;下划线.可能的磷酸化位点。ATG.The start codon;TAA.The stop codon;The lowercase letters.5′-UTR and 3′-UTR;The underline.Possible phosphorylation sites.
2.3 ACS蛋白多序列比对
将PlACS(AFT92042)与牡丹ACS(PsACS,ABC69166)、苹果(Malusdomestica)ACS(MdACS,AAB67989)、拟南芥ACS7(AtACS,NP_194350)和番茄(Solanumlycopersicum)ACS(SlACS,XP_010313742)进行蛋白质多序列比对分析(图3),发现PlACS与牡丹ACS蛋白相似性最高达95.33%,暗示ACS蛋白在芍药属中可能较为保守。
PlACS蛋白序列中含有7个保守结构域和保守活性位点K278,其中BOX5中含有保守的12肽基序SLSKDMGFPGFR,该基序为ACS结合底物SAM的位点,5′-磷酸吡哆醛结合位点氨基酸残基为G128A129T130Y154N211Y242S275S277K278R286,形成同源二聚体界面的氨基酸残基为G131T165H235G284F285R286T314L317(图3)。
2.4 ACS蛋白分子系统进化分析
分子进化树分析结果表明,PlACS和牡丹ACS的亲缘关系最近,与葡萄(Vitisvinifera)和河岸葡萄(Vitisriparia)ACS亲缘关系次之,而与苹果、枇杷(Rhaphiolepisbibas)、欧洲甜樱桃(Prunusavium)、李(Prunussalicina)、扁桃(Prunusdulcis)等蔷薇科植物的ACS亲缘关系相对较远(图4)。
2.5 PlACS蛋白二级和三级结构分析
运用SOPMA软件对PlACS蛋白二级结构进行分析,发现该蛋白质存在α-螺旋(40.04%)、β-折叠(16.26%)、β-转角(6.91%)和无规则卷曲(36.79%)4种二级结构(图5)。
以拟南芥ACS7蛋白结合5′-磷酸-l-氨基乙氧基乙烯基甘氨酸吡哆醛(Pyridoxal 5′-phosphate-l-aminoethoxyvinylglycine,PPG)的晶体结构(7DLW)[16]为模型预测PlACS蛋白三维结构,二者蛋白质序列相似性为55.63%,预测PlACS寡聚体状态为同源二聚体(图6)。

红色框.ACS蛋白的保守结构域;红色箭头.活性位点K278。Red box.Conservative domains of ACS proteins;Red arrow.Active site K278.
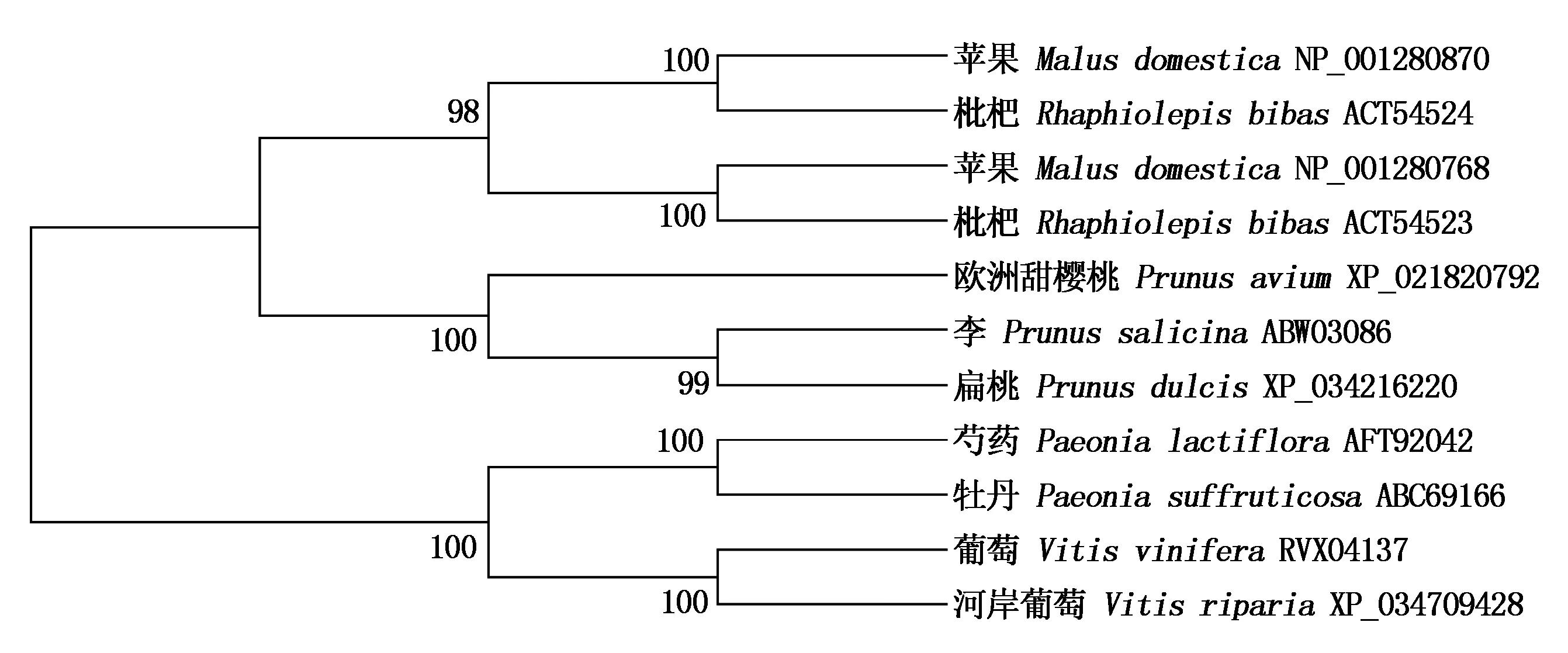
图4 PlACS蛋白与其他物种ACS蛋白的系统进化树Fig.4 Phylogenetic tree of PlACS and previously reported ACS proteins

A.α-螺旋;B.β-折叠;C.β-转角;D.无规则卷曲。A.α-helix;B.Extended strand;C.β-turn;D.Random coil.
2.6PlACS基因CDS的亚克隆
根据PlACS的CDS序列,设计含有BamH Ⅰ和Hind Ⅲ酶切位点的PCR引物,扩增获得带有酶切位点BamH Ⅰ和Hind Ⅲ的CDS片段(图7-A),纯化回收后与T载体连接并转化大肠杆菌,质粒PCR(图7-B)和BamH Ⅰ/Hind Ⅲ双酶切(图7-C)鉴定获得阳性重组子,测序结果表明,含有插入的BamH Ⅰ和Hind Ⅲ酶切位点,且编码区与PlACS拼接序列CDS完全一致。
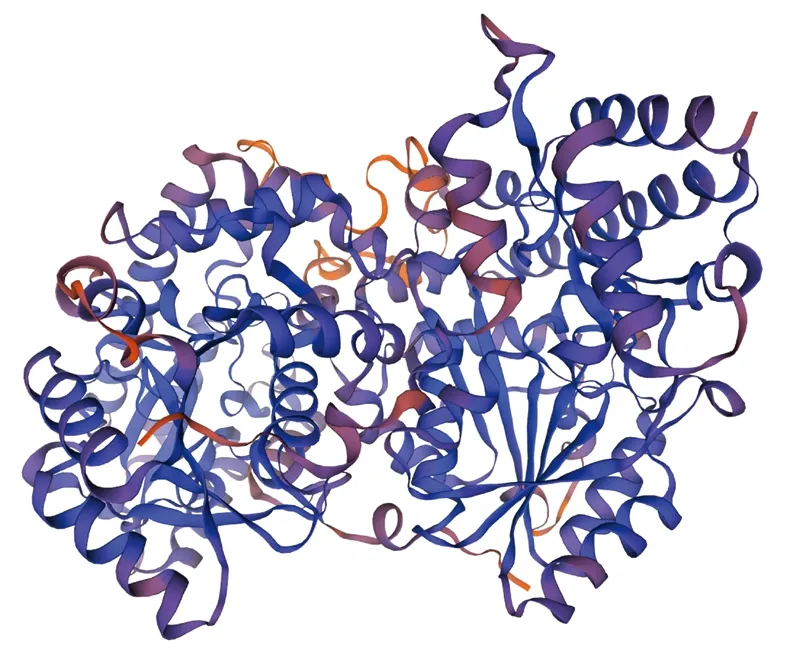
图6 PlACS蛋白三级结构预测Fig.6 The tertiary structure prediction of PlACS protein

A.PlACS基因CDS扩增;B.pMD18-T-PlACS重组质粒PCR;C.pMD18-T-PlACS重组质粒的BamH Ⅰ和Hind Ⅲ双酶切。A.Amplification of PlACS gene CDS;B.PCR identification of pMD18-T-PlACS;C.Double enzyme digestion of pMD18-T-PlACS by BamH Ⅰ/Hind Ⅲ.
2.7 pET32a-PlACS原核表达载体的构建
用BamH Ⅰ/Hind Ⅲ酶切重组质粒pMD18-T-PlACS和原核表达载体pET-32a,将目的基因片段与pET-32a空载体连接。经转化后,用含有BamH Ⅰ和Hind Ⅲ酶切位点的引物进行质粒PCR检测,得到与PlACS的CDS大小一致的条带(图8-A);进一步用BamH Ⅰ/Hind Ⅲ对重组质粒进行双酶切,获得2个条带,其中大片段条带为质粒pET-32a载体骨架,小片段条带为PlACS基因(图8-B)。表明PlACS基因已成功插入到原核表达载体pET-32a中,将构建好的PlACS基因原核表达载体转化BL21(DE3)获得基因工程菌。
2.8 PlACS重组蛋白的表达
与未诱导的阴性对照相比,基因工程菌经IPTG诱导后表达出分子质量约为60 ku的蛋白质(图9),其分子质量与理论计算值一致,表明PlACS重组蛋白表达成功。

A.PCR;B.BamH Ⅰ和Hind Ⅲ双酶切。A.PCR;B.Double enzyme digestion by BamH Ⅰ/Hind Ⅲ.
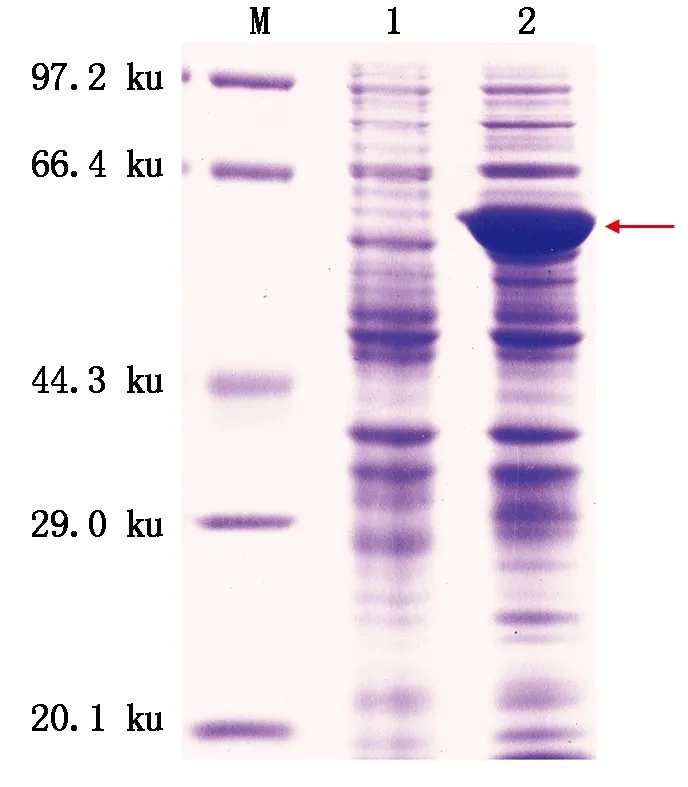
M.Protein Marker;1.IPTG未诱导;2.IPTG诱导。M.Protein Marker;1.Without induced by IPTG;2.Induced by IPTG.
2.9 PlACS重组蛋白高效表达体系的建立
当宿主菌A600为0.1~1.1时,添加终浓度为0.4 mmol/L的IPTG均能诱导出PlACS重组蛋白(图10),其中当A600介于0.2~1.1时,PlACS重组蛋白表达量较高。
当基因工程菌菌体密度A600达0.6时,添加终浓度为0.1~0.9 mmol/L的IPTG均能成功诱导PlACS
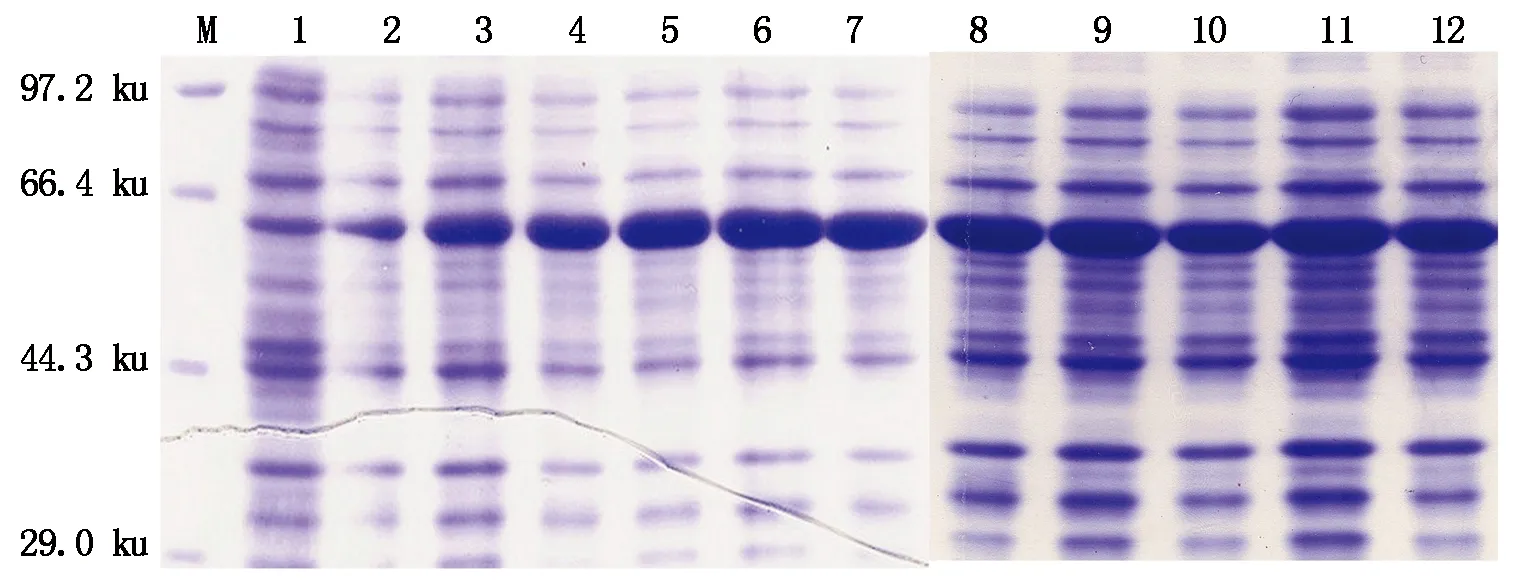
M.Protein Marker;1.未诱导;2—12.A600为0.1~1.1时诱导表达。M.Protein Marker;1.Without induced;2—12.Induced when A600 was 0.1—1.1.
重组蛋白的表达(图11)。基于节约成本考虑,确定诱导剂IPTG浓度为0.1 mmol/L。

M.Protein Marker;1.未诱导;2~10.IPTG终浓度为0.1~0.9 mmol/L。M.Protein Marker;1.Without induced;2—10.The final concentration of IPTG was 0.1-0.9 mmol/L.
诱导时间与异源蛋白在大肠杆菌中的表达量关系密切。在加入诱导剂IPTG仅 2 min后,基因工程菌中即可检测出PlACS重组蛋白,表明pET-32a载体上的T7启动子对诱导剂IPTG非常敏感,反应迅速。当IPTG诱导2 h后其表达量趋于稳定(图12),因此,诱导2 h左右即可收获菌体。

M.Protein Marker;1.未诱导;2.2 min;3.5 min;4.10 min;5.20 min;6.40 min;7.1 h;8.2 h;9.4 h。M.Protein Marker;1.Without induced;2.2 min;3.5 min;4.10 min;5.20 min;6.40 min;7.1 h;8.2 h;9.4 h.
综上所述,PlACS蛋白最佳诱导表达条件为:当基因工程菌菌体密度A600达0.2时,在菌液中加入终浓度为0.1 mmol/L的IPTG,在37 ℃诱导2 h。
2.10 PlACS重组蛋白的表达形式分析
在37 ℃条件下,表达的PlACS以包涵体的形式存在,上清液中几乎未见表达的PlACS蛋白(图13),其原因可能是由于外源基因表达速度过快,导致表达的蛋白质来不及正确折叠。
3 结论与讨论
本研究应用RACE技术从芍药切花品种桃花飞雪中克隆了PlACS基因cDNA序列,应用生物信息
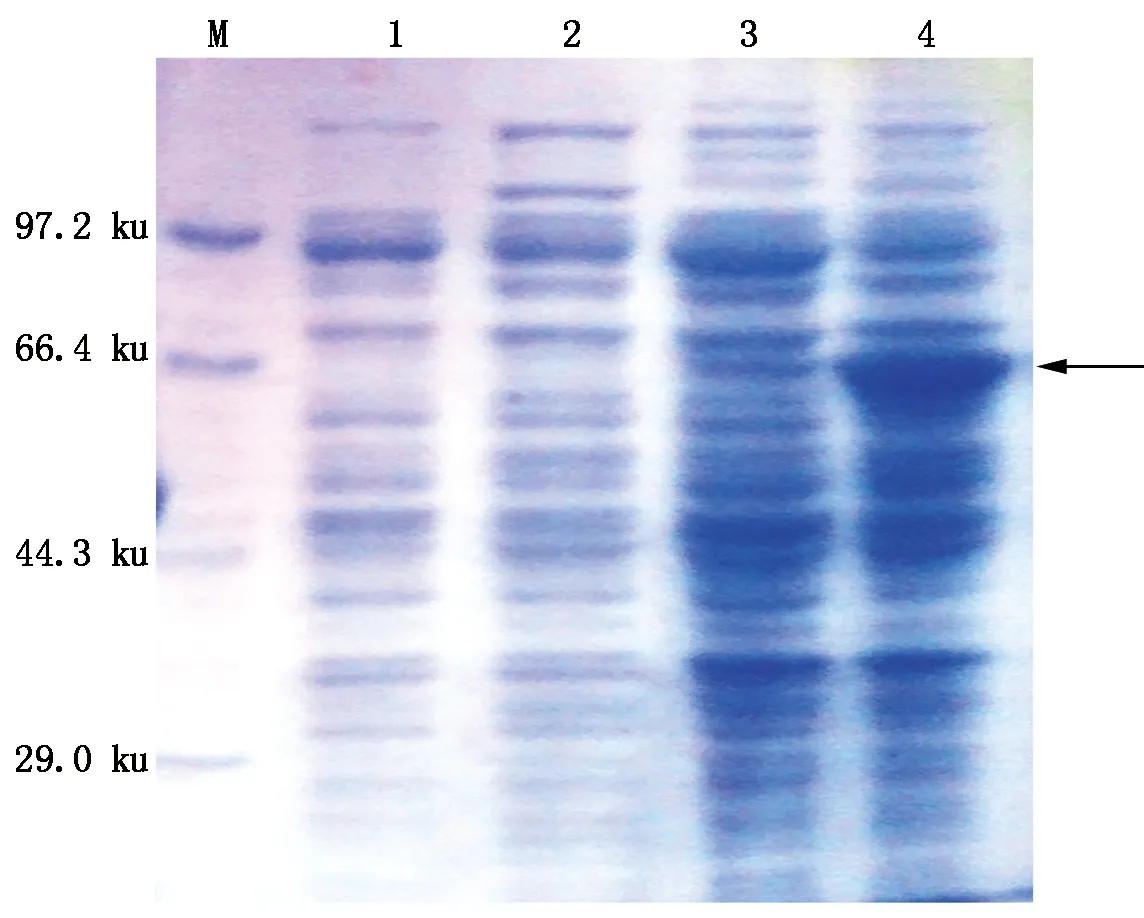
M.Protein Marker;1.未诱导上清液;2.诱导上清液;3.未诱导沉淀;4.诱导沉淀。M.Protein Marker;1.Supernatant without induced;2.Supernatant induced;3.Precipitate without induced;4.Precipitate induced.
学方法对其编码的蛋白质进行了综合分析,构建了PlACS基因的原核表达载体,建立了PlACS蛋白高效的原核表达体系。研究结果为后续通过变复性获得有生物学活性的PlACS重组蛋白及其酶学功能鉴定奠定了基础。
拟南芥[8]、番茄[17]和苹果[18]等物种的ACS基因已被克隆和鉴定,但受限于基因组和转录组等信息的缺乏,芍药ACS基因迟迟未被研究。在没有基因组或转录组测序数据的情况下,RACE技术是获得芍药ACS基因cDNA全长序列的有效方法。通过2轮RACE-PCR,获得了芍药ACS基因全长cDNA序列,共1 752 bp。cDNA完整序列的获得对后续该基因功能的鉴定及蛋白质原核表达等研究至关重要。
与拟南芥ACS一样,PlACS蛋白序列中存在多个保守区及保守的活性位点K,且包含了底物SAM特异性结合位点和磷酸吡哆醛结合位点,这些保守结构在拟南芥中已经被证明为ACS酶活性所必需的位点[9];PlACS蛋白中的活性位点12肽基序SLSKDMGFPGFR与苹果和番茄ACS活性位点12肽基序高度相似,而后者的12肽基序已被3H和14C同位素标记试验证实为与底物SAM结合的蛋白质序列[18-19]。系统发育分析揭示,PlACS和牡丹ACS亲缘关系最近,与葡萄属植物ACS亲缘关系较近,而与蔷薇科植物相对较远。该结果与基于基因组序列推断的虎耳草目(Saxifragales)植物与葡萄目(Vitales)植物亲缘关系较近,而与蔷薇类(Rosids)植物亲缘关系相对较远的结果一致[20]。
目前,已经建立了多个物种的ACS重组蛋白原核高效表达体系,如月季[21]、牡丹[22]和丝瓜[23]的大肠杆菌原核表达体系,但是尚无芍药ACS重组蛋白的原核表达体系。因此,本研究构建芍药PlACS基因原核表达载体并探索PlACS原核高效表达所需的条件。在大肠杆菌中表达的重组蛋白往往不能自发折叠卷曲,以一种不溶性的沉淀即包涵体的形式存在,这是原核表达系统高效表达时的普遍现象[24]。为了使重组蛋白具有生物活性,必须将包涵体变性后复性[25]。但包涵体的变复性一直困扰着许多科学工作者,降低诱导温度有益于某些蛋白质的可溶性表达[26]。在本试验条件下,PlACS重组蛋白表达形式为包涵体。后续将采取降低表达温度及变复性2种方式,尝试获得有生物学活性的PlACS重组蛋白,从而对PlACS重组蛋白的酶学特性及功能进行深入研究。

