CT图像数字化自动测量腹壁皮下动脉穿支皮瓣在乳腺再造术术前评估的应用
谭 勇,吴 丹,刘代洪,张 菁,杨 露,林 檬,张久权
(重庆大学附属肿瘤医院影像科 400030)
腹壁皮下动脉穿支皮瓣(deep inferior epigastric flap,DIEP)游离自体皮瓣重建技术是乳腺癌患者术后乳房重塑最主要的技术手段,术后患者有较高的接受度和满意度[1-2]。皮瓣穿支血管的选择将直接影响皮瓣的血供,是保证DIEP手术成功率的一个关键点[3]。计算机断层血管造影术(computed tomographic angiography,CTA)被认为是DIEP自体乳房再造术穿支血管成像及术前计划设计的首选技术及金标准[4-5]。CTA能够对一系列手术步骤进行详细规划,从而缩短手术时间并改善手术结果[6]。有研究表明,DIEP术前使用CTA选择皮瓣最佳穿支时,最重要的信息依次为穿支静脉直径、穿支点在皮瓣内的位置和穿支动脉直径,脐下的穿支常常作为优先选择[7]。
目前,对于CTA穿支血管的显示及生成适合临床使用的3D重组图像,主要依赖后处理软件生成“穿支血管分布图”,以协助临床医生对合适的穿支、供体部位和皮瓣做出选择[8-10]。这些后处理软件包括Syngo InSpace 4D(德国Siemens公司)、VoNaviX(德国IVS Technology公司)及Osirix(瑞士Pixmeo公司)等[9]。然而,临床选择皮瓣最为关切的血管直径、穿支点在皮瓣内的位置及与体表标记点肚脐的位置关系,仍然依靠影像科医生的手动测量,主观性较强且工作效率很低。而DIEP数字化后处理软件syngo via Frontier-Deep flap plan (德国Siemens公司)可实现对穿支血管位置的自动化测量,将标记出的所有穿支点全景式展示在3D视图模型中。本研究拟将其与人工手动测量进行对比,分析二者测量的准确性、所耗时长及临床对两种测量模式所提供信息的满意度评价,现报道如下。
1 资料与方法
1.1 一般资料
(1)体模测量:使用人体模型BOU/CPR100(上海博友科教仪器设备有限公司),以直径约2 mm的维生素AD软胶囊于左右腹壁各随机设置5个标记点(共10个标记点),标记点设置范围参考既往研究发现的腹壁下穿支动脉的穿出点位置[11-12]。在模型上以肚脐为体表参考点,使用实物标尺测量并记录各标记点对应参考点的位置信息(与肚脐的垂直上下径及左右径)共计20个测量值,作为各标记点位置信息的实际值(标准测值),见图1。(2)人体测量:选取本院2015年11月11日至2021年3月19日拟行DIEP自体乳房再造术的乳腺癌患者33例,年龄33~62岁,平均(42±6)岁,采用DIEP标准化扫描协议[9]完成扫描及数据采集。本研究经本院伦理委员会审核通过(伦理编号:CZLS2021175-A)。

图1 模型设置的标记点及实际值测量
1.2 方法
1.2.1CTA扫描
使用西门子Somatom Drive(德国Siemens公司)双源CT进行扫描,采用DIEP标准化扫描协议(模型仅扫描协议中平扫部分)。患者仰卧位足先进,手臂上举至头顶。扫描范围由耻骨联合至剑突,覆盖完整腹部。采用双源螺旋CT血管扫描模式;探测器使用64排探测器×0.6 mm准直器宽度;螺距0.9;球管旋转速度0.37 s;管电压120 kV;管电流180 mA;使用标准血管算法重建,卷积核I30f;对比剂使用碘普罗胺注射液370(碘浓度370 mg/mL),以4.0 mL/s的速率推注约90 mL,于对比剂注射完后以相同速率推注生理盐水30 mL;动脉期采用股动脉监测触发,触发阈值为100 HU。
1.2.2图像后处理及测量
将扫描所得1 mm层厚无间距横轴位原始图像数据传输至工作站。(1)人体模型的测量:自动测量使用数字化后处理软件(syngo via Frontier-Deep flap plan)标识出人体模型的参考点及设置的标记点。由软件自动得出各标记点相对于参考点的位置信息(垂直上下径及左右径)并以3D容积再现模型展示,见图2;手动测量则由一位主管技师用工作站中标尺线对所有位置信息作手动画线测值并记录。(2)患者数据的测量:由具有血管诊断经验的1名主治医师和1名副主任医师独自观察,并对每例患者选出两支最大腹壁动脉穿支(共计66个穿支点)。当两位医师意见不一致时,由两位医师协商并达成一致结果。然后,测量选出最大穿支动脉的穿支点位置信息(与肚脐的垂直左右径、上下径、深度)。上述数据测量均由熟练掌握后处理及测量软件的同一主管技师完成,分别记录软件自动测值及人工手动画线测值两者耗时,见图3。
此外,由两位具有DIEP自体乳房再造术资质的临床医师分别对数字化自动测量、手动测量所得图像、测值等信息及临床价值进行整体评价,包括实用性、直观性、全景视图、3D视图4个参数。并分别以-:不能满足;+:部分满足;++:基本满足;+++:完全满足,进行评分。
1.3 统计学处理
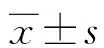

A:模型断层图像标记点1的识别;B:模型3D重建成像显示标记点1的自动测值(黑色箭头:参考点肚脐;蓝色箭头:标记点1);C:模型3D显示所有标记点。

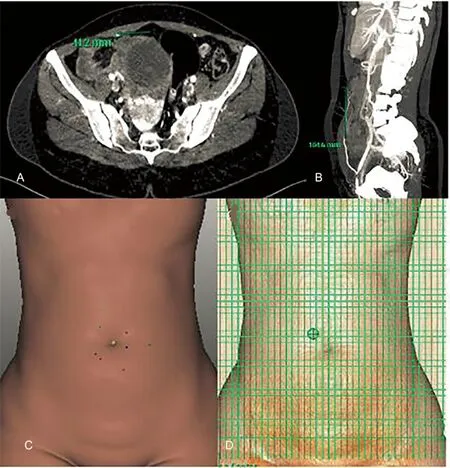
A、B:患者断层图像穿支点左右径及上下径的手动测量;C:患者断层图像穿支点标识;D:该标记点数字化后处理自动测量值的3D显示;E:患者多个主要穿支点分布情况的3D显示。
2 结 果
2.1 测量准确性
模型设置的10个标记点共计20个位置信息(与肚脐的垂直左右径、上下径)测量值(实际值)、数字化后处理软件(syngo via Frontier-Deep flap plan)自动测值和操作者手动测值分别为(3.51±1.85)、(3.68±1.84)、(3.65±1.84)cm,差异无统计学意义(F=0.954,P>0.05)。
2.2 测量效率对比
所有33例患者选取的66个穿支点均能清晰显示、识别及测量。数字化后处理软件自动测量单支血管耗时为(67.89±9.86)s(自动测量耗时包含软件打开时间),较手动测量耗时[(106.00±10.13)s]缩短,差异有统计学意义(P<0.001),且每单支腹壁穿支动脉自动测量平均耗时与手动测量平均耗时之差为[Δt=(42.5±9.4)s];数字化后处理软件自动测量与操作者手动测量的左右径测值、上下径测值及深度测值均无明显差异(P>0.05),见表1。典型病例:患者女,年龄35岁,对8支主要穿支点分别采用自动和手动两种方式测量并计时,自动测量耗时248 s,手动测量耗时904 s,该患者自动测量节约耗时约11 min,见图4。
2.3 临床医师满意度评价
经临床医师对两种测量方法所提供测值、图像及其他附加信息量进行评价,数字化自动测量各项参数均优于手动测量,见表2。

表1 患者最大穿支点位置信息
A、B:手动测量;C、D:自动测量。

表2 两种测量方法临床满意度评价
3 讨 论
在普通外科的许多领域,准确了解和理解患者的解剖结构和所有细节(如脉管系统)是外科决策的关键。每侧腹壁一般发出5~7个较大穿支动脉,DIEP在切除过程中一般保留 1~3个主要的皮肤血管穿支[13],对复杂解剖结构常规横断面成像的解释需要较强的空间推理能力,临床上较为困难且容易出错[14]。DIEP穿支血管变异较大,手术难点在于如何准确、快速、安全地解剖出最适合乳房再造的穿支血管。传统方式下医师通过术中解剖探查各穿支情况,综合评估后选择保留最佳穿支,其耗时较长,对医师的技术与经验要求很高[15]。因此,需要对每例患者行术前检查,了解其血管在周围组织和皮瓣中的走行和分布,从而遴选出最佳穿支,并制订适宜的手术方案,最大限度地规避因个体差异和解剖变异带来的手术不确定性和手术失败风险,缩短手术时间,同时提高皮瓣的存活率[16]。
本研究所采用的数字化自动测量软件可构建3D立体穿支模型,直观地为临床决策提供丰富的附加信息,并可有效避免术中设计皮瓣的不稳定性,从而降低手术风险和缩短手术时长。对于皮瓣穿支点位置信息的量化测量,该方法具有可靠性高、对操作者水平依赖性低、更加客观等优点,且测量效率也得到非常大的提高。
本研究对比分析表明,数字化后处理软件自动测量值与人工手动测量值无明显差异,且与实际值高度一致。使用人体模型设置标记点验证的方法与术中测量相比具有相似的可靠性和准确度,而且可操作性更强,对患者更加友善。此外,相较于手动测量,数字化后处理软件自动测量耗时明显缩短,单个患者可节约测量时间10 min以上。DIEP数字化后处理可在保证测量精度的同时,大幅度提高工作效率,对减少医疗人员人力消耗有重要意义。
综上所述,本研究中数字化后处理软件自动测量在提高影像科工作效率的同时,可以更加满足临床术前对于腹壁穿支动脉空间解剖结构、位置等信息的需求,临床满意度更高;此外,对今后体内其余部位深部细小血管或组织结构位置信息的方便、快捷测量及3D立体呈现均具有一定参考意义。但本研究为回顾性研究,且样本量较小,需要在今后的研究中扩大样本量进一步探讨。

