基于网络药理学和实验探讨丹玄口康治疗口腔黏膜下纤维化作用机制
朱可可,周 蓉,王志豪,谭 劲*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.长沙市妇幼保健院,湖南 长沙 410008)
口腔黏膜下纤维化(oral submucosal fibrosis, OSF)是一种常见的慢性口腔黏膜病,好发于中国湖南、台湾,在印度、巴基斯坦、泰国、马来西亚等国家也有报道[1-2],其主要表现为口腔黏膜下固有层的胶原纤维异常沉积和上皮萎缩,从而引起黏膜硬化,形成条索,临床上主要表现为进行性张口受限、长期口腔灼疼和口腔溃疡等[3]。目前,OSF 的发病机制尚不明确,主要与长期咀嚼槟榔、免疫功能失调等有关[4]。 OSF的治疗主要采用激素类药物,降低局部组织的免疫炎性反应,但长期服用该类药物,会出现一系列不良反应,如库欣综合征、高脂血症、高血压、高血糖、动脉粥样硬化等[5-7]。 近年来,本课题组在桃红四物汤基础上创制丹玄口康,并观察其治疗OSF 的临床疗效与实验机制[8-10]。 丹玄口康由丹参、玄参、当归、红花、生地黄、白花蛇舌草、黄芪、薄荷配伍而成,能够理气活血、化瘀软坚,缓解患者张口受限和口腔黏膜疼痛的症状,同时较少出现药物的不良反应。 但其在分子水平上的作用机制,还需进一步探索。 因此,本文在分子层面,通过网络药理学方法探讨丹玄口康治疗OSF 的作用机制,以期对未来进一步的药理研究提供依据和参考。
1 方法
1.1 丹玄口康的活性成分筛选
运用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP, http://tcmspw.com/tcmsp.php),分别检索丹玄口康中的丹参、当归、红花、生地黄、白花蛇舌草、玄参、黄芪和薄荷,收集其化学成分信息,以口服生物利用度(oral bioavailability, OB)≥30%和类药性(drug-likeness, DL)≥0.18 作为药物活性成分的筛选标准。 得到结果为丹玄口康的活性成分。
1.2 丹玄口康作用靶点的预测
运用TCMSP 数据库和UniProt 数据库(https://www.uniprot.org/),对丹玄口康活性成分进行靶基因的预测,预测条件限定为靶点人源性,将所有预测的靶基因进行转换,得到基因标准化名字。得到结果为丹玄口康作用靶基因的标准化名字。
1.3 OSF 的治疗靶点预测
运用GeneCards 数据库(https://www.genecards.org/)和OMIM 数据库(https://omim.org/),以关键词“oral submucosal fibrosis”对疾病相关靶点分别进行检索,检索结果汇总后去除重复基因。 得到结果为OSF 的潜在治疗靶点。
1.4 构建“丹玄口康的活性成分-OSF 的作用靶点”网络
将上述结果导入R 语言(V 3.7.0)中,绘制药物和疾病的韦恩图,并得到药物调控疾病靶基因的网络节点。 将上述结果导入Cytoscape 软件(V 3.8.0)中,进行网络拓扑结构分析,绘制“丹玄口康的活性成分-OSF 的作用靶点”网络图。其中,外围椭圆形代表丹玄口康的有效活性成分,中间的三角形代表OSF 的关键靶基因,网络中有联系的节点通过连线链接。
1.5 作用靶点的功能和通路的生物信息学分析
将“1.4”项中获得的靶基因数据导入David 数据库(DAVID,https://david.ncifcrf.gov),物种限定“Homo sapiens”,对靶基因进行GO 生物过程和KEGG 通路生物信息学分析,筛选P<0.05 结果并保存。 列出排名前60 的GO 富集结果,圆圈大小代表基因数目,参与该生物学进程靶基因的数目越多,圆圈直径越大;圆圈的颜色从蓝色到红色代表P 值逐渐变小,P 值越小, 说明参与该生物学进程的靶基因富集程度越高。 列出排名前20 的KEGG 信号通路,圆圈大小代表基因数目,参与该信号通路靶基因的数目越多,圆圈直径越大;圆圈的颜色从蓝色到红色代表P 值逐渐变小,P 值越小,说明参与该信号通路的靶基因富集程度越高。
1.6 动物实验验证
1.6.1 实验动物及药物 选取8 周龄雄性SD 大鼠50 只,体质量(235±15) g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK(湘)2019-0004。 于湖南中医药大学SPF 级动物房饲养,温度(24±2) ℃,相对湿度为50%~60%,清洁饮水,自由摄食,24 h 光暗循环条件下饲养。 严格遵循实验动物福利伦理原则,并经本单位实验动物伦理委员会审查,伦理审批编号为LLBH-202103100002。
丹玄口康所用药物为颗粒剂,经广东三九制药有限公司生产,由湖南中医药大学第一附属医院药剂科提供。 具体组方如下:丹参10 g,玄参10 g,当归10 g,红花5 g,生地黄10 g,白花蛇舌草10 g,黄芪10 g,薄荷10 g。
1.6.2 主要试剂及仪器 氢溴酸槟榔碱(德斯特生物公司,批号:300-08-03),HE 染色套装(武汉赛维尔生物科技有限公司,批号:G1003),中性树胶(国药集团化学试剂有限公司,批号:10004160),病理切片机(德国莱卡,型号:RM2016),正置显微镜(日本尼康,型号:Nikon Eclipse E100),荧光定量PCR 仪(赛默飞世尔科技有限公司,型号:QuantStudio 7 Flex)。
1.6.3 实验分组、 模型制备和给药 将造模大鼠分别放入麻醉造模装置中,待大鼠吸入异氟烷麻醉后,用止血钳和镊子张开大鼠口腔,充分暴露颊黏膜,注意从口角伸入皮肤褶襞与颊黏膜相接处进针入黏膜下,朝内推进0.5 cm 后,注入10 mg/mL 槟榔碱0.2 mL(2 d/次);注射后再用自制刷蘸槟榔碱在颊黏膜处刷20 次(1 d/次,上下左右各20 次),之后禁食、禁水2 h[11]。 连续8 周后,检查大鼠口腔情况:张口明显受限,颊黏膜苍白,扪之发硬,黏膜下有条索物形成,符合OSF 临床表现。造模期间无大鼠死亡。随机将造模成功大鼠分为正常对照组、模型组、丹玄口康低剂量组、丹玄口康中剂量组、丹玄口康高剂量组,每组10 只。 正常对照组10 只大鼠不予处理,正常饲养。 模型组大鼠在正常饲养基础上,予以等量生理盐水灌胃;丹玄口康低、中、高剂量组大鼠,在正常饲养基础上予以低、中、高浓度丹玄口康灌胃。
丹玄口康低、中、高剂量组以组方4、8、12 mL/kg(按照体表面积药物剂量换算公式计算, 分别相当于70 kg 成人剂量的1、2、3 倍)[11]灌胃8 周,模型组以等量生理盐水灌胃,1 次/d。 末次给药后,使用过量水合氯醛将大鼠处死,取大鼠口腔颊黏膜组织,部分固定于10%甲醛中,部分冻存于-80 ℃冰箱。
1.6.4 口腔黏膜组织病理切片 将标本石蜡包埋后切片,依次将切片放入二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、75%乙醇5 min,自来水洗;切片入苏木素染液染3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;伊红染色:切片依次入85%、95%乙醇脱水各5 min,入伊红染液中染色5 min;脱水封片:切片依次放入无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、无水乙醇Ⅲ5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min透明,中性树胶封片;显微镜镜检,图像采集分析。
1.6.5 q-PCR 检测口腔黏膜组织中HIF-1α 以Trizol 提取细胞总RNA,取保存在Trizol 中的组织约0.02 g,加入1 mL Trizol 于匀浆器中充分研磨匀浆,混匀后室裂解5 min;加入200 μL 三氯甲烷,混匀15 s,室温静置3 min;以离心半径8 cm、12 000 r/min、4 ℃下离心15 min;取上层液相,转移至新的RNase-Free 离心管中;加入等体积的异丙醇,混匀,室温静置10 min;以离心半径8 cm、12 000 r/min、4 ℃下离心10 min,去上清,加入1 mL 75%乙醇(无菌DEPC处理水配制)洗涤沉淀;以12 000 r/min、4 ℃下离心3 min,去上清;空气干燥5~10 min;加入20~30 μL无菌无酶水溶解沉淀;紫外分光光度计测定浓度,在260 nm 与280 nm 处测其吸光度值,并计算其浓度、纯度;以组织总mRNA 为模板,逆转录cDNA,反应体系涡旋振荡混匀,短暂离心,使管壁上的溶液收集到管底,50 ℃孵育50 min,85 ℃孵育5 min;反应结束后,短暂离心,置于冰上冷却;以β-actin 作为内参基因计算丹玄口康治疗OSF 的关键靶基因HIF-1α 相对表达量,运用primer5 软件设计引物,由北京擎科合成引物;根据引物的设计要求,PCR 扩增条件:95 ℃、10 min 预变性;95 ℃下15 s,60 ℃下20 s,持续40 个循环。 HIF-1α mRNA 以β-actin为内参基因,采用2-ΔΔCt算法计算HIF-1α mRNA相对表达水平。 q-PCR 引物序列见表1。
1.7 数据分析

表1 q-PCR 引物序列
2 结果
2.1 丹玄口康的活性成分
通过TCMSP 数据库共收集丹玄口康中化学成分2456 个,依据OB≥30%和DL≥0.18 的筛选标准,去除重复的有效成分后,结果为93 个,OB 值排名前10 的活性成分见表2。

表2 丹玄口康OB 前10 位活性成分的基本信息
2.2 共同作用靶点的预测
运用TCMSP 数据库,对丹玄口康所包含的8 味中药依次进行筛选,得到结果为潜在的治疗靶基因,去除重复靶基因,最后得到的靶基因数目为260 个。通过检索GeneCards 和OMIM 数据库,两个数据库相结合后去除重复项,得到459 个OSF 的潜在治疗靶基因。 将丹玄口康有效成分的靶点与OSF 的靶点相匹配,得到丹玄口康治疗OSF 的关键靶基因48 个,根据结果绘制韦恩图。 详见图1。
2.3 丹玄口康活性成分-OSF 关键靶基因的网络构建和分析
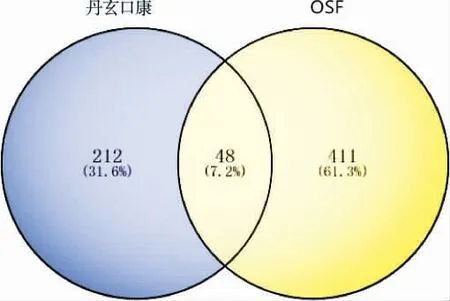
图1 丹玄口康和OSF 共同作用靶点的韦恩图
将丹玄口康有效活性成分和OSF 关键靶基因导入Cytoscape 软件进行网络构建,得到“有效活性成分-关键靶基因”网络。 结果表明,槲皮素、丹参酮ⅡA、阿魏酸、芍药苷、木犀草素、黄芩素能与5 个以上的靶点相连接,推测这6 个成分是丹玄口康中对OSF 起治疗作用的主要活性成分;丹玄口康活性成分和OSF 靶基因连线排在前10 位的分别是:EGFR、JUN、HIF-1α、PGR、MMP9、MAPK1、PTGS2、MYC、VEGFA、CASP8。表明这些靶点在OSF 的治疗中可能发挥重要的作用。 详见图2。
2.4 GO 生物学过程的生物信息学分析
GO 富集分析显示,丹玄口康治疗OSF 的靶基因涉及氧活性反应(response to reactive oxygen species)、金属内肽酶活性(metalloendopeptidase activity)、丝氨酸内肽酶活性(serine-type endopeptidase activity)、血红素结合(heme binding)等多个生物进程,表明丹玄口康通过多生物学进程发挥治疗OSF 的作用。详见图3-5。
2.5 KEGG 信号通路的生物信息学分析
KEGG 信号通路富集结果显示,丹玄口康治疗OSF 主要涉及的通路如下:肿瘤坏死因子信号通路、IL-17 信号通路、HIF-1 信号通路等多个通路。 表明丹玄口康活性成分作用的靶基因,分布于不同的信号通路,通过多通路共同作用来发挥治疗OSF 的作用。 详见图6。
2.6 丹玄口康对OSF 大鼠口腔黏膜的影响
2.6.1 丹玄口康对OSF 大鼠口腔黏膜的病理改变
通过HE 染色发现,正常对照组黏膜上皮基本正常,钉突未出现变平或消失;与正常对照组相比,模型组黏膜上皮萎缩、变薄,部分钉突变短甚至消失,黏膜固有层出现大量粉红色丝状、网状胶原纤维沉积,固有层下肌纤维萎缩;丹玄口康低、中、高剂量组HE 染色结果较为相似,黏膜上皮基本正常,黏膜固有层见少量丝状胶原纤维沉积,固有层肌纤维基本正常。 详见图7。
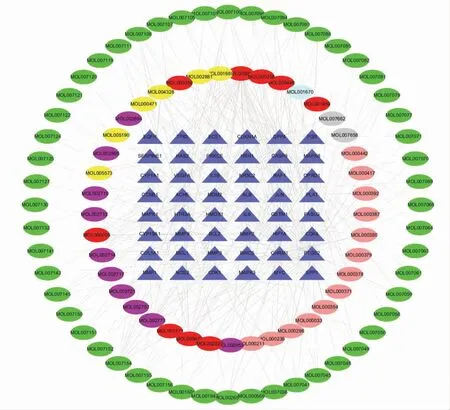
图2 丹玄口康的活性成分作用于OSF 关键靶基因的网络图
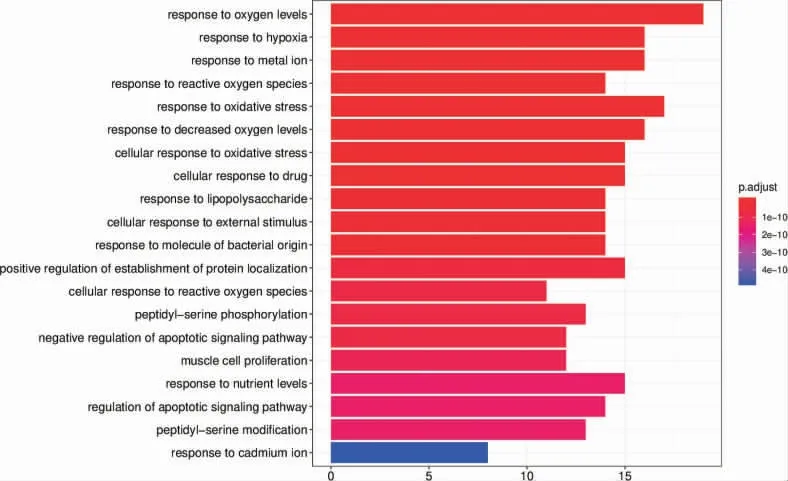
图3 GO 的BP 柱状图
2.6.2 丹玄口康对OSF 大鼠HIF-1α 转录的影响 与正常对照组比较,模型组大鼠口腔黏膜HIF-1α mRNA 表达水平明显上升(P<0.01)。与模型组比较,丹玄口康各剂量组大鼠HIF-1α mRNA 表达水平明显下降(P<0.01),丹玄口康低剂量组和中剂量组相比,HIF-1α mRNA 的表达,差异无统计学意义,丹玄口康高剂量组较丹玄口康低、中剂量组HIF-1α mRNA 表达水平下降(P>0.05)。 详见图8。

