CXCL2-CXCR2 轴在血管内皮细胞趋化循环纤维细胞过程中的作用研究
庞 楠, 王 艳, 李学拥
(1. 延安大学咸阳医院口腔科,陕西 咸阳 712000;2. 空军军医大学第三附属医院口腔颌面肿瘤科,陕西 西安 710032;3. 空军军医大学第二附属医院烧伤整形科,陕西 西安 710038)
创伤的愈合过程是一个复杂的生理过程,阐明创伤愈合的机制、促进创伤愈合是当前亟待解决的问题和外科医生追求的目标。
血管新生是创伤愈合的基础,因而研究血管新生的机制对于外科学具有重要意义。 在血管新生的过程中,周细胞发挥着重要的作用。 研究表明,循环纤维细胞(CFs)可以分化为周细胞[1]。 但 CFs 向新生血管的血管内皮细胞(VECs)趋化的机制尚不清楚。因此,阐明CFs 向VECs 趋化的机制,有助于揭示血管新生的机制和创伤愈合的机制。
尽管在许多研究中已探讨了CFs 迁移的基本机制[2-4],但在伤口愈合这一特定的病理生理过程中,CFs 迁移的机制缺乏充分的研究。 体内细胞的迁移与趋化因子及趋化因子受体相关[5-6]。 有研究表明,CC趋化因子配体2 [chemokine (C-C motif) ligand 2,CCL2]、CXC 趋化因子配体 8[chemokine(C-X-C motif)ligand 8,CXCL8]参与了 VECs 趋化 CFs 的过程[1,7]。此外, 我们前期报道了CCL15-CCR1 轴在介导CFs向VECs 迁移的过程中起重要作用[8]。 然而,在培养的VECs 上清液中能够检测到多种趋化因子, 因而我们可能忽视了一些其他趋化因子的作用。 本研究旨在探讨由人脐静脉内皮细胞(HUVECs)分泌的趋化因子在介导CFs 迁移中的作用。
1 材料和方法
1.1 实验材料和设备
人外周血抗凝浓缩白细胞(空军军医大学第一附属医院血液中心提供); 淋巴细胞分离液Histopque-1077(Sigma 公司,美国);含 4.0 mmol/L谷氨酰胺、4 500 mg/L 葡萄糖、100 U/mL 青霉素 G和 100 U/mL 链霉素的 DMEM 培养液 (HyClone 公司,美国);HUVECs(ScienCell 公司,美国);含 5%胎牛血清 (fetal bovine serum, FBS)、4 mmol/L 左旋谷氨酰胺、100 U/mL 青霉素 G、100 U/mL 链霉素、1%内皮细胞生长添加剂的内皮细胞培养液(endothelial cell medium, ECM)(ScienCell 公司, 美国); 重组Anti-CD45 抗体(Abcam 公司,英国);Anti-CollagenⅠ抗体(Abcam 公司,英国);Alexa Fluor 594 标记的山羊抗兔IgG、Alexa Fluor 488 标记的山羊抗鼠IgG(Abcam 公司,英国);牛血清白蛋白(bovine serum albumin,BSA;Thermo Fisher Scientific 公司, 美国);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(碧云天生物技术有限公司, 中国);Transwell 小室 (Thermo Fisher Scientific 公司,美国);TRIzol 试剂 (Thermo Fisher Scientific 公司,美国);人全基因组表达谱基因芯片(Illumina 公司,美国);QIAGEN RNeasy mini 试剂盒 (Qiagen 公司,德国);Ambion Message Amp 试剂盒 (Thermo Fisher Scientific 公司, 美国);MiniBEST 通用 RNA 提取试剂盒(TaKaRa 公司,日本);PrimeScriptTMRT Master Mix 试剂盒(TaKaRa 公司,日本);TB GreenTMPreMix Ex TaqⅡ(TaKaRa 公司,日本);人 CXCL16 Quantikine ELISA 试剂盒(R & D System 公司,美国);人MIP2/CXCL2 ELISA 试剂盒 (Abcam 公司, 英国);MIP3/CCL23 ELISA 试剂盒(Abcam 公司,英国);TPerTM组织蛋白提取试剂 (Thermo Fisher Scientific公司,美国);抗 CCR1 小鼠单克隆抗体(Abcam 公司,英国)、抗肌动蛋白小鼠单克隆抗体(Abcam 公司,英国);辣根过氧化物酶-兔抗小鼠 IgG(H&L)二抗(Abcam 公司,英国);抗趋化因子 CXCL2 多克隆抗体、抗 CXCR2 多克隆抗体(Santa Cruz 公司,美国);4%多聚甲醛(北京雷根生物技术有限公司,中国);0.1%结晶紫(碧云天生物技术有限公司,中国)。
安捷伦生物分析仪(Agilent 公司,美国);SureS-can 微阵列扫描仪 (Agilent 公司, 美国);CFX Connect 实时系统(Bio-Rad 公司,美国);TECAN SUNRISETM多功能酶标仪(Tecan 公司,瑞士);ChemiDoc XRS+凝胶成像系统(Bio-Rad 公司,美国);倒置显微镜及成像系统(Olympus 公司,日本);激光扫描共聚焦显微镜(Thermo Fisher Scientific 公司,美国)。
1.2 细胞的分离和培养
人CFs 的分离纯化方法参考前期研究[8]。 现将步骤简述如下: 采用Histopque-1077 密度梯度离心法从人外周血抗凝浓缩白细胞中分离出CFs; 用磷酸盐缓冲液(phosphate buffered saline,PBS)等体积稀释外周血抗凝浓缩白细胞样品,再用等体积的淋巴细胞分离液Histopque-1077 分离,室温下以800×g离心20 min;小心吸取外周血单核细胞层;用PBS洗涤所获得的外周血单核细胞, 室温下以1 200×g离心5 min,重复3 次;DMEM 培养液重悬外周血单核细胞;然后将外周血单核细胞以1×107/mL 的密度接种于 6 孔板, 以5×105/mL 的密度接种于24 孔板,在 37 ℃、5%CO2孵箱中培养;7 d 后弃去未贴壁细胞,更换新的DMEM 培养液;根据此前的研究结果[8],培养 14 d 后,CFs 的纯度>95%。
人CFs 的鉴定:将培养2 周的CFs 进行免疫荧光染色,PBS 清洗1 次,用4%多聚甲醛固定20 min,PBS 洗 3 次, 用 100 μL 胎牛血清封闭 30 min,加入兔抗人重组Anti-CD45 抗体(1∶100)及小鼠抗人Anti-Collagen Ⅰ抗体(1∶500),于 4 ℃下过夜孵育,PBS 洗3 次;分别将Alexa Fluor 594 标记的山羊抗兔IgG 和Alexa Fluor 488 标记的山羊抗鼠IgG 溶于1%牛血清白蛋白(bovine serum albumin, BSA)中,与上述一抗室温下避光孵育1 h,使用PBS 洗3 次;用 DAPI 染色 5 min,PBS 洗 3 次, 于共聚焦显微镜下观察。
将 HUVECs 接种于 ECM 培养液, 在 37 ℃、5%CO2孵箱中培养。 本研究中使用的HUVECs 取自第3~4 代细胞。
1.3 建立细胞共培养体系
将 1×105纯化的 CFs 接种于 6 孔板 Transwell小室,将 1×105的 HUVECs 接种于 6 孔板,分别单独培养48 h 后, 把接种有CFs 的Transwell 小室置于HUVECs 的上方进行共培养。 共培养24 h 的实验组用于进行基因芯片分析或Transwell 迁移实验;共培养48 h 的实验组用于进行实时定量聚合酶链反应(RT-qPCR)、Western blotting 及 ELISA 检测。分别设置相同数量、单独培养的HUVECs 及CFs 作为阴性对照。
1.4 基因芯片分析
使用人全基因组表达谱基因芯片进行基因芯片微阵列分析。 共培养 24 h 后, 用 TRIzol 裂解HUVECs,并用TRIzol 试剂提取总RNA,经QIAGEN RNeasy mini 试剂盒进行纯化和脱氧核糖核酸酶Ⅰ(DeoxyribonueleaseⅠ, DNaseⅠ)处理后,用安捷伦生物分析仪进行质量控制。以Ambion Message Amp试剂盒制备用于Illumina 阵列的生物素化环状RNA(cRNA)。将标记的cRNA 与芯片上的探针杂交并洗涤,然后用SureScan 微阵列扫描仪进行信号扫描。用 GenomeStudio v2.0 数据分析软件(Illumina 公司,美国)分析扫描数据。 以上所有实验数据均已存入基因表达综合数据库,登录号为GSE108626。
1.5 RT-qPCR 检测
用MiniBEST 通用RNA 提取试剂盒分别提取CFs 和 HUVECs 的 总 RNA。 用 PrimeScriptTMRT Master Mix 试剂盒进行逆转录。 随后用TB GreenTMPreMix Ex TaqⅡ执行定量PCR。引物序列见表1。表内引物均由生工生物工程股份有限公司合成。 标准循环条件下,在CFX Connect 实时系统中进行PCR扩增。 定量 PCR 的热循环条件:95 ℃初始变性10 min;95 ℃变性 15 s,40 个循环;60 ℃退火、延伸1 min;68 ℃下进行 3 min 的最终扩展。 用 2-ΔΔCq法[9]量化表达水平, 并标准化为GAPDH。 使用CFX Manager 软件分析数据。

表1 RT-qPCR 引物序列信息Table 1 Coding sequence of primers involved in RT-qPCR
1.6 ELISA 检测
用ELISA 检测单独培养和共培养的HUVECs上清液中相应趋化因子的浓度。 CFs 与HUVECs 按上述方法共培养。 6 孔板的各接种孔及每个6 孔板Transwell 小室的培养液体积均为2 mL, 实验过程中不更换培养液。 培养48 h 后,收集HUVECs 上清液。 上清液样品于室温下以600×g 离心10 min 后于-80 ℃保存,用于进行后续实验。上清液样品与无血清ECM 以1∶2 的比例稀释, 分别用 CXCL16 ELISA 试 剂 盒 、CXCL2 ELISA 试 剂 盒 及 CCL23 ELISA 试剂盒进行 ELISA 检测。 SUNRISETM多功能酶标仪检测吸光度, 所得数据基于细胞数给予标准化。
1.7 Western blotting 分析
Western blotting 分析按照标准程序进行。 用TPerTM组织蛋白提取试剂提取细胞总蛋白,Bradford比色法测定蛋白量。 蛋白样品(30~40 μg/泳道)以8%十二烷基硫酸钠聚丙酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDSPAGE)分离并转移到聚偏二氟乙烯(polyvinylidene fluoride membrane, PVDF)膜上,将转移的膜在室温下用5%脱脂牛奶封闭 1 h。 将 PVDF 膜与抗CCR1 小鼠单克隆抗体和抗肌动蛋白小鼠单克隆抗体于37°C 下孵育3 h,然后将其与二抗(1∶2 000)室温下孵育 1 h, 用 ECL 溶液和ChemiDoc XRS+系统显影蛋白条带,最后使用ImageJ 软件分析条带密度。
1.8 CXCL2、CXCR2 阻 断 实 验 和 Transwell 迁 移实验
为了明确 CXCL2-CXCR2 轴是否在 HUVECs趋化CFs 的过程中起一定作用,我们进行了趋化因子CXCL2 及其相应受体的阻断实验。 我们将CFs与HUVECs 在Transwell 中共培养, 分别在共培养体系的上层添加了CXCR2 的多克隆抗体, 在共培养体系的下层添加CXCL2 的多克隆抗体, 并分别与不添加抗体的共培养体系比较发生迁移的CFs的数目,来检测CXCL2 及其受体CXCR2 对CFs 的趋化性影响。
在共培养体系的上层小室培养液中加入抗CXCR2 多克隆抗体, 在下层小室培养液中加入抗CXCL2 多克隆抗体,并在 37 ℃、5%CO2孵箱中共孵育24 h,然后再进行细胞迁移实验。 对照组中加入等量的TE 缓冲液(pH 值为9.0,为以上多克隆抗体的溶剂)。
HUVECs 以 1×105/mL 的密度(培养液为 ECM)接种于Transwell 共培养体系的下层小室。 CFs 以1×105/mL 的密度(培养液为DMEM)接种于共培养体系的上层小室。于37 ℃下共培养24 h 后,将上层小室取出并用4%多聚甲醛室温下固定30 min,0.1%结晶紫室温下染色5 min, 光镜下观察并计数CFs 趋化并附着于上层小室下表面 (朝向HUVECs)的数量。 每个小室取3 个视野,计平均数。
1.9 统计学分析
所有实验数据均来源于3 次独立、 重复的实验,数据用平均数±标准差()表示。2 组数据比较应用Student's t 检验。单因素方差分析用于比较2 组以上数据之间的差异。 Dunnett's t 检验用于进行2 个实验组与对照组之间的多重比较。图基(Tukey)事后检验法用于进行2 个以上的实验组与对照组之间的多重比较。 用SPSS 19.0 软件进行统计学分析,GraphPad Prism 8.0 软件绘制图形。以P<0.05 为差异具有统计学意义。
2 结果
2.1 HUVECs 与CFs 体外培养的形态学观察
体外培养CFs,1 周时在镜下观察可见多个散在细胞呈贴壁生长,2 周时可见贴壁细胞形成多个集落,贴壁的细胞呈多种形态,较典型的呈纺锤形,双侧可见细长的突起, 其他的形态包括多角形、卵圆形等(图1)。 细胞核为 1~3 个,细胞质向外延伸,形成突起,2 周后,细胞数目逐渐增多,并且细胞不再呈集落样分布,而表现为广泛分布在培养皿的表面。 随培养时间的延长,细胞形态变为均一的纺锤形外观。 在培养的第14~21 天,细胞呈指数增长,体积增大,胞质丰富。 培养时间超过1 个月,细胞则逐渐裂解死亡。
图1 CFs 体外培养2 周时的形态(×200)Figure 1 Morphology of CFs cultured for 2 weeks in vitro(×200)
体外培养的HUVECs 在倒置相差显微镜下观察呈单层贴壁生长, 短梭状或铺路石样排列于培养皿底面(图 2),胞体较 CFs 大,胞质丰富。 大多数细胞呈典型的扁平多边形,边界清楚。 细胞核清晰可见。

图2 HUVECs 体外培养 3 d 时的形态(×200)Figure 2 Morphology of HUVECs cultured for 3 days in vitro(×200)
2.2 CFs 的鉴定
连续培养 14 d 后,CD45(绿色荧光)和 CollagenⅠ(红色荧光)表达明显(图3)。
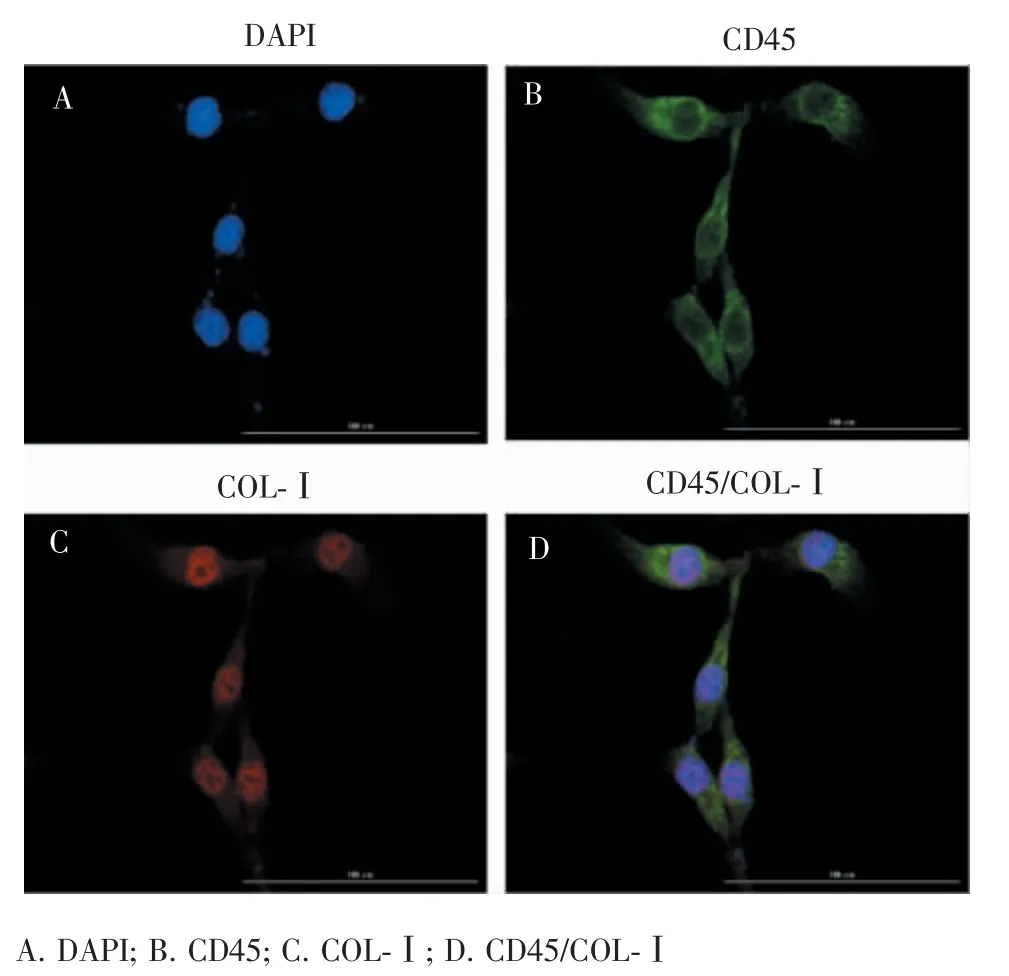
图3 CFs 体外培养14 d 后行的免疫荧光染色(×200)Figure 3 Immunofluorescent staining of CFs cultured for 14 days in vitro (×200)
2.3 HUVECs 与CFs 共培养时上调的趋化因子检测结果
本实验采用基因芯片技术, 对共培养后的HUVECs 和CFs 分别进行了检测, 发现在HUVECs内可以检测到23 种趋化因子,它们是CCL2、CCL3、CCL5、CCL7、CCL8、CCL15、CCL19、CCL20、CCL21、CCL23、CCL28、CXCL1、CXCL2、CXCL5、CXCL6、CXCL8、CXCL10、CXCL11、CXCL12、CXCL14、CXCL16、CXCL17和CX3CL1。其中6 种趋化因子的mRNA 水平(相对荧光信号) 在与CFs 共培养后明显上调, 分别为CCL2、CCL15、CCL23、CXCL2、CXCL8 及 CXCL16(图 4)。如前所述,CCL2、CXCL8 及 CCL15 在 HUVECs 趋化CFs 的过程中的作用均已被研究, 故本文不再对它们进行进一步探讨, 而是重点探索CCL23、CXCL2和CXCL16 这3 种趋化因子在介导CFs 迁移中的作用。
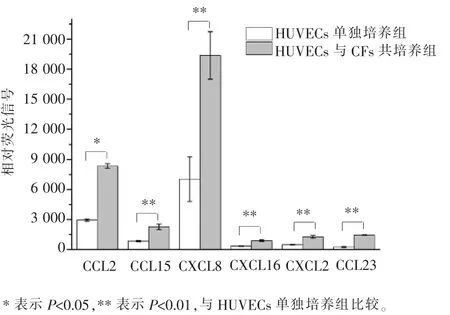
图4 基因芯片检测CFs 与HUVECs 共培养前后6 种趋化因子的表达水平Figure 4 Expression levels of the six chemokines in HUVECs before and after co-culture with CFs by gene microarray
2.4 RT-qPCR 检测共培养前后3 种趋化因子的mRNA 表达
CFs 与 HUVECs 共培养 48 h 后,RT-qPCR 检测3 种趋化因子mRNA 的表达变化(与HUVECs 单独培养比较),检测结果显示,除CXCL16 外,其余2 种趋化因子的mRNA 表达水平在共培养后明显上调(均 P<0.05,图 5)。

图5 RT-qPCR 检测CFs 与HUVECs 共培养前后3 种趋化因子mRNA 的表达水平Figure 5 Relative mRNA expression levels of three chemokines in HUVECs before and after co-culture with CFs by RT-qPCR
2.5 ELISA 检测共培养前后培养液中3 种趋化因子的表达
CFs 与 HUVECs 共培养 48 h 后,ELISA 检测培养上清液中3 种趋化因子的蛋白表达变化(与HU-VECs 单独培养比较), 检测结果显示,HUVECs 单独培养时,培养上清液中3 种趋化因子的蛋白浓度分别为(22.6±0.4) pg/mL(CCL23)、(11.4±0.9) pg/mL(CXCL2)及(112.1±1.9) pg/mL (CXCL16);与 CFs 共培养48 h 后, 培养上清液中3 种趋化因子的蛋白浓度分别为(2.6±1.1) pg/mL(CCL23)、(202.8±0.9) pg/mL(CXCL2)及(158.1±14.0) pg/mL (CXCL16)。根据以上数据可知,CCL23 在共培养后,其蛋白表达水平反而降低,CXCL16 在共培养前后表达的差异没有统计学意义, 而CXCL2 的表达在共培养后发生了显著上调(P<0.01,图 6)。

图6 HUVECs 与CFs 共培养前后培养液中3 种趋化因子的ELISA 检测Figure 6 Concentrations of the three chemokines in the medium of HUVECs before and after co-culture with CFs measured by ELISA
2.6 RT-qPCR 和Western blotting 检测共培养前后CXCR2 的表达水平
据报道,CXCL2-CXCR2 轴可调节多种细胞的迁移和聚集[10-12]。而且,根据以上实验结果,2 种细胞共培养后,CXCL2 的表达在基因水平和蛋白水平均发生显著上调。 因此,为了研究CFs 是否能够通过CXCL2-CXCR2 轴被 HUVECs 招募, 我们检测了CFs 中 CXCL2 的受体 CXCR2 的表达。 RT-qPCR 和Western blotting 分别在基因水平和蛋白水平检测CXCR2 的表达。结果表明,与CFs 单独培养相比,共培养条件下,CXCR2 的表达增加(图 7、8)。

图7 RT-qPCR 检测 HUVECs 与CFs 共培养前后 CFs 中CXCR2的 mRNA 表达Figure 7 Expression of CXCR2 mRNA in CFs before and after co-culture with HUVECs measured by RT-qPCR
2.7 CFs 趋化性检测
CXCL2 被其多克隆抗体阻断后,平均每200 倍的视野下发生趋化的CFs 的细胞数为11.7,而对照组(不添加多克隆抗体的共培养组)为19.0(图9)。当CXCR2 被其多克隆抗体阻断后,平均每200 倍的视野下发生趋化的CFs 的细胞数为22.3,而对照组(不添加多克隆抗体的共培养组)为34.3(图10)。以上结果表明, 当CXCL2 或CXCR2 被阻断后,发生趋化的CFs 的数量减少, 表示CXCL2-CXCR2 轴在HUVECs 趋化CFs 的过程中起一定作用。
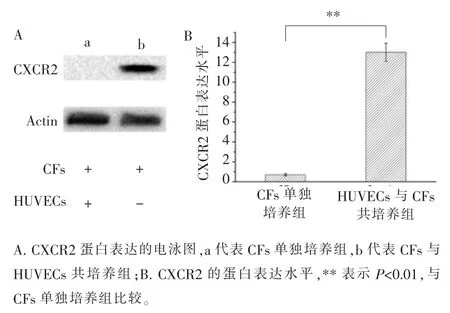
图8 Western blotting 检测 HUVECs 与 CFs 共培养前后 CFs 中CXCR2 的表达Figure 8 Expression of CXCR2 in CFs before and after co-culture with HUVECs measured by Western blotting
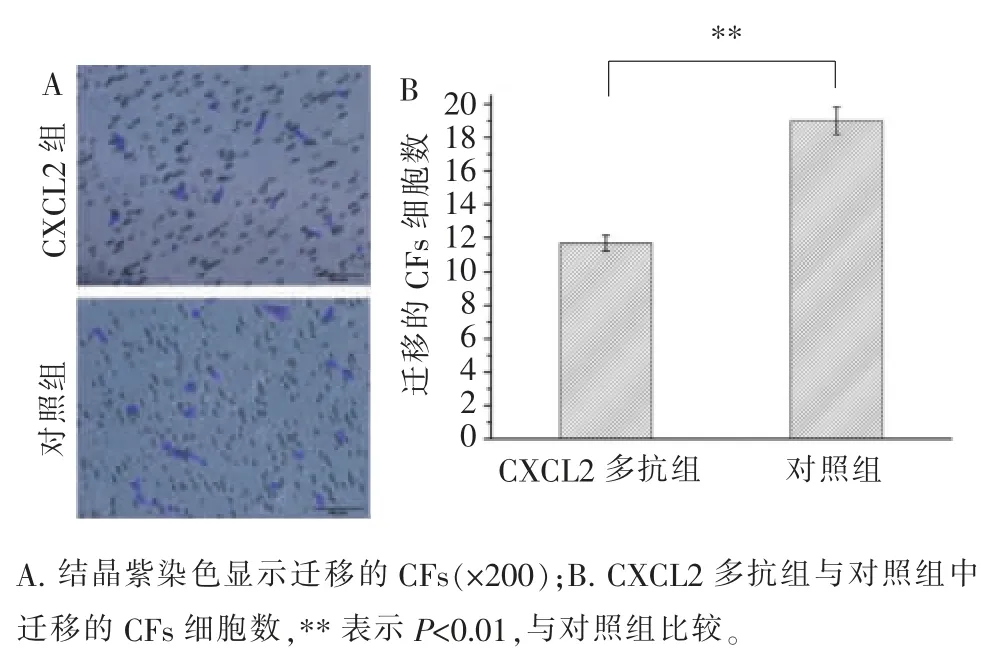
图9 CXCL2 阻断实验Figure 9 CXCL2 blocking experiment
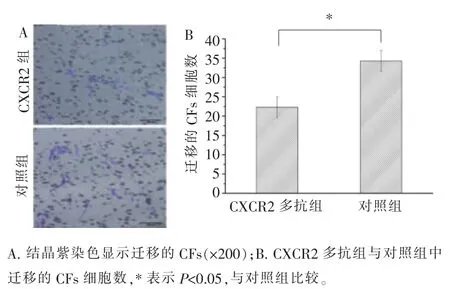
图10 CXCR2 阻断实验Figure 10 CXCR2 blocking experiment
3 讨论
在纤维化疾病中,参与CFs 迁移的趋化因子已被广泛研究[13-15]。 然而,在伤口愈合过程中,我们对趋化因子对CFs 的调节作用仍然知之甚少。 本研究利用基因芯片筛选HUVECs 分泌的趋化因子,并比较这些趋化因子在HUVECs 与CFs 共培养前后表达的变化。研究结果表明,在共培养条件下,CXCL2/CXCR2 的表达均显著提高。 此外, 在阻断CXCL2/CXCR2 后,CFs 向 HUCECs 迁移的细胞数明显变少。 这些结果提示, 在体外培养条件下,CXCL2-CXCR2 轴在介导CFs 向HUVECs 迁移的过程中起一定作用。 本研究首次报道了内皮细胞来源的CXCL2 对CFs 向HUVECs 迁移的调节作用。
使用可渗透的Transwell 共培养系统探索2 种细胞相互影响的方法被广泛使用[16-17]。 在本研究中,我们通过将CFs 和HUVECs 在Transwell 中共培养来模拟创伤愈合时血管的生成过程, 并检测共培养前后趋化因子的表达水平。基因芯片分析表明,有6 种趋化因子的mRNA 水平在与CFs 共培养后明显上调, 分别为 CCL2、CCL15、CCL23、CXCL2、CXCL8 及 CXCL16。 这些结果提示,HUVECs 趋化CFs 可能与多种趋化因子相关,其中CCL2、CCL15、CCL23、CXCL2、CXCL8 和 CXCL16 这 6 种趋化因子在HUVECs 趋化CFs 的过程中可能具有更高的相关性。 由于 CCL2、CXCL8 及 CCL15 在 HUVECs趋化CFs 的过程中的作用均已被研究,故本文不再对它们进行进一步的探讨, 而是重点探索CCL23、CXCL2 和 CXCL16 这 3 种趋化因子在介导 CFs 迁移中的作用。 我们比较了3 种趋化因子在2 种细胞共培养后的表达变化,进而利用细胞迁移实验确认了 CXCL2 对 CFs 迁移的影响。 结果显示,CXCL2 在调节CFs 的迁移方面具有一定的作用。 此外,本研究还证实了CXCR2 在CFs 中的表达。 内皮细胞和纤维细胞之间的CXCL2-CXCR2 轴具有许多重要的功能。 例如, 先前的一项研究报道显示,CXCL2-CXCR2 轴通过 Gαi-2 和 Gαq/11 介导, 引起特定类型的基质细胞发生趋化并控制血管生成, 从而促进肿瘤发生[11]。 但是,我们的研究没有进一步探讨CXCL2-CXCR2 轴的下游机制, 因此可能忽视了该轴的其他功能。 此外,本研究仅进行了细胞学研究,未在体内实验层面进行进一步的探讨。 因此,未来的研究应聚焦于CXCL2-CXCR2 轴在介导纤维细胞的分化及与纤维细胞其他功能相关的下游信号通路的激活方面, 以及在动物实验中进一步确认CXCL2-CXCR2 轴的功能。
已有研究人员对趋化因子在调控CFs 的迁移方面进行报道。例如,已发现CCL2 在哮喘时可以介导纤维细胞向肺迁移; 另外,CX3CL1 也可以调节CFs 的迁移[15,18]。 在本研究中,虽然通过基因芯片初步筛选出了几种趋化因子,但本研究仅根据其表达的倍数变化来进一步选择了3 种趋化因子。 因此,基因芯片分析检测到的其他趋化因子在血管生成过程中介导纤维细胞迁移的作用可能被忽视了。 除了迁移外, 纤维细胞向周细胞的分化在血管生成过程中也同样重要[18]。 然而,本研究并未检测与HUVECs共培养后CFs 的分化率。 CXCL2-CXCR2 轴是否参与CFs 分化尚需进一步研究。
综上所述, 本研究首次确定了CXCL2 在介导内皮细胞募集纤维细胞中的作用,还证实了CXCR2在纤维细胞中的表达, 并确定了CXCL2-CXCR2 轴在CFs 募集过程中的调节作用。

