circKEAP1通过影响miR-661/LIF轴促进骨肉瘤细胞增殖和迁移*
黄晓文, 张能华△, 陈兴英, 袁 梅, 费春霞, 徐屹宁
(1浙江中医药大学附属嘉兴中医院检验科,浙江 嘉兴 314001;2浙江大学医学院附属邵逸夫医院骨科,浙江 杭州 310020)
骨肉瘤是来源于间叶组织最常见的原发性恶性骨肿瘤,好发于青少年及儿童,主要表现为骨骼或关节处的肿胀感与疼痛,活动后加剧,部分可触及肿块[1]。骨肉瘤的发病率约为3/100 万,占全世界相关年龄段肿瘤的2.4%[2]。过去几十年来,随着新辅助放化疗结合手术的应用,骨肉瘤的治疗方式有了显著的进步。尽管如此,骨肉瘤的患者预后仅有微小的提升。而伴有化疗耐药与肿瘤组织转移的骨肉瘤患者,其五年生存率仅为15%~30%[3]。骨肉瘤治疗目前尚无特异性的有效靶点。在体外水平寻找抑制骨肉瘤细胞增殖与迁移的靶点,是后续开发新型有效的临床治疗药物首要与关键步骤。
与传统的线性RNA 不同,环状RNA(circular RNA,circRNA)是一种呈现环状闭合结构的非编码RNA,不具备5'末端帽子和3'末端多聚腺苷酸尾巴,且有更高的稳定性,表现为对RNA 酶更高的耐受[4]。circRNA 广泛存在于机体各个组织器官中,在特定条件下具有一定的功能,与其他RNA 或蛋白共同维持生物体内微环境的稳态。circRNA 可与特定的蛋白相互作用,从而影响靶蛋白功能[5]。少部分circRNA被证明具有翻译功能,能够翻译蛋白或肽段行使其生物学功能[6-7]。此外,circRNA 存在广泛的微小RNA(microRNA,miRNA,miR)的结合位点,能够海绵吸附 miRNA 并调节其下游靶基因[8]。miRNA 是一类不具备编码功能的短核苷酸单链RNA 分子,参与转录后基因表达调控,在肿瘤发生和心血管疾病等生物学过程中发挥着重要作用[9]。其中,miR-661 被证明可通过调节细胞色素C 增强星形孢菌素或肿瘤坏死因子α介导的骨肉瘤细胞凋亡[10]。
此前有研究报道,circRNA circKEAP1 在系统性红斑狼疮患者外周血单核细胞中的表达量显著下调[11]。此外,还有学者报道 circKEAP1 对预测肺腺癌患者的生存率具有重要意义[12]。基因表达集合数据库(GSE140256)分析结果显示,circKEAP1 有较高的丰度,且在多个骨肉瘤细胞系中显著高表达。由此推断,我们探讨了circKEAP1 通过海绵吸附miR-661,进而调控其靶基因白血病抑制因子(leukemia inhibitory factor,LIF)影响骨肉瘤增殖与迁移的分子机制,并为探索基于circKEAP1-miR-661-LIF 轴的骨肉瘤新型治疗靶点提供依据。
材料和方法
1 材料
凋亡检测试剂盒购自BD;24孔Transwell板及小室购自Corning;CCK-8 和双萤光素酶报告基因检测试剂盒购自碧云天生物技术有限公司;小干扰RNA、miR-661 模拟物与miR-661 抑制剂购自上海吉玛制药技术有限公司;LIF过表达质粒购自汉恒生物科技(上海)有限公司;Lipofectamine 3000、胎牛血清、DMEM 高糖培养液、Opti-MEM 培养液、胰蛋白酶溶液和 PBS 购自 Thermo Fisher Scientific;总 RNA 提取试剂盒购自康为世纪生物科技股份有限公司;逆转录试剂购自艾科瑞生物;荧光定量PCR SYBR Green荧光染料购自翌圣生物科技(上海)股份有限公司;热稳定性的DNA 聚合酶(Taq 酶)购自南京诺唯赞生物科技股份有限公司;放线菌素D 购自Selleck;引物购自北京擎科生物科技有限公司;
2 细胞
293T、143B、HOS、U2OS、SJSA-1、MG63 和hFOB1.19 细胞系均购自美国模式培养物集存库(American Type Culture Collection,ATCC),培养条件均为含10%胎牛血清的DMEM 高糖培养液,培养环境为5%CO2、37 ℃恒温恒湿细胞培养箱。
3 主要方法
3.1 PCR 与RT-qPCR 根据总RNA 提取试剂盒说明书提取处理后的U2OS、HOS、MG63、143B、SJSA-1与hFOB1.19 细胞的总RNA。随后使用艾科瑞生物的逆转录试剂将总RNA 逆转录为互补DNA。PCR为 10 μL 体系,其中 2× Taq 酶取 5 μL,互补 DNA 取0.5 μL,正、反向引物各取 0.25 μL,去离子水取 4 μL。反应条件:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,共35个循环。将上述PCR 产物加入1%琼脂糖胶,120 V 恒压电泳30 min后显影。对于RT-qPCR,将β-actin 作为内参照。反应体系为 10 μL,其中 2× SYBR Green 预混液取 5 μL,正、反向引物各取0.25 μL,互补DNA 按照1∶10用去离子水稀释后取4.5 μL。反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火/延伸30 s,共40个循环。采用 2-ΔΔCt方法计算 circKEAP1 及 KEAP1 的相对表达量。circKEAP1 的正向引物序列为5'-CGAGAAGTGTGTCCTCCACG-3',反向引物序列为5'-CACTCAGGGACCTCCCCAAAAT-3';KEAP1 的 正向引物序列为5'-CTGGAGGATCATACCAAGCAGG-3',反向引物序列为5'-GGATACCCTCAATGGACACCAC-3';β-actin 的正向引物序列为 5'-AGAGCTACGAGCTGCCTGAC-3',反向引物序列为5'-AGCACTGTGTTGGCGTACAG-3'。
3.2 质粒构建 选择上海汉恒生物科技有限公司的 pHBLV-CMV-MCS-3FLAG-EF1-ZsGreen-T2A-PURO 载体,依次加入载体DNA(1 g/L)、10×Buffer、超纯水、限制性核酸内切酶(EcoR I和BamH I)试剂,轻轻吸打混匀,置于37 ℃水浴锅中反应2 h;酶切结束之后进行琼脂糖凝胶电泳,回收目的片段。设计的引物进行目的片段PCR 扩增后,琼脂糖凝胶回收得到正确大小的目的片段。将目的基因片段(大于100 ng)、线性化载体、无缝克隆试剂预混液与超纯水配置克隆连接体系,于在50 ℃反应30 min后,置于冰上5 min。随后将DH5α 感受态细胞从-80 ℃冰箱拿出来之后立刻放到冰上融化,加入1 μL目的质粒,冰上放置30 min,42 ℃热激90 s,立刻插入冰上冰育2 min,随后加入 500 μL 不含抗生素的 Luria-Bertani(LB)肉汤培养液,在37 ℃恒温摇床上震荡培养60 min。将菌液涂到相应抗性的固体平板上,涂布均匀,然后将板倒放37 ℃恒温箱培养16 h。次日,挑阳性单克隆,进行测序,确认序列无误后,使用质粒抽提试剂盒对质粒进行扩增抽提。
3.3 细胞转染 将细胞接种于6 孔板中,待其生长到50%~60%密度备用转染。准备两个微型离心管,分别加入100 μL 的Opti-MEM 培养液。对于小干扰RNA 的转染,在第 1 个微型离心管中加入 5 μL 的 Lipofectamine 3000,另一个微型离心管中加入10 μL 20 μmol/L 浓度的小干扰RNA,将两个微型离心管共孵育15 min 后,将上述样品滴入细胞培养液中。对于质粒的转染,在第1 个微型离心管中加入5 μL 的Lipofectamine 3000,另1个微型离心管中加入1 μg浓度的质粒,并加入2 μL P3000。将两个微型离心管中的溶液共孵育15 min 后,再将上述样品滴入细胞培养液中。24 h后,换用新鲜的培养液继续培养。
3.4 CCK-8 法检测细胞活力 将细胞接种于96 孔板,转染si-circKEAP1 或miR-661 抑制剂或过表达LIF 后,将处于对数生长期的143B 细胞取出,弃去培养液,用PBS 溶液洗涤一遍后加入含有10% CCK-8溶液的培养液,进一步培养2 h。随后将96孔板置于酶标仪检测450 nm 的吸光度(A)值,并计算细胞活力。
3.5 流式细胞术检测细胞凋亡 将细胞接种于6孔板,转染si-circKEAP1或miR-661 抑制剂或过表达LIF 后,将处于对数生长期的143B 细胞取出。使用PBS 溶液洗涤细胞,随后使用无EDTA 的胰蛋白酶溶液将细胞消化下来,再次用PBS 溶液洗涤后,使用400 μL Binding Buffer重悬细胞。向上述样品中加入5 μL Annexin V-FITC 和5 μL 碘化丙啶(propidium iodide,PI)并在避光条件下孵育15 min。最后将样品置于流式细胞仪中上机,并分析细胞凋亡比例。
3.6 细胞迁移实验 将细胞接种于6 孔板,转染sicircKEAP1 或 miR-661 抑制剂或过表达 LIF 后,将细胞消化并离心重悬计数,均匀的铺在24 孔Transwell板上层小室。上层小室中加入无血清培养液,下层加入含有10%胎牛血清的培养液。24 h 后使用4%多聚甲醛固定,在孔板中加入结晶紫染液染色1 h,随后使用清水洗净。取出Transwell 上层小室,擦去上层多余的细胞,置于显微镜下观察,并记录典型视野。
3.7 萤光素酶报告基因实验 将293T 细胞接种于24 孔板中,每组设置3 个复孔,待其贴壁并生长达到密度50%~60%。将1.5 μL Lipofectamine 3000试剂、1 μL P3000试剂、500 ng对应萤光素酶报告基因质粒(野生型或突变型)及3 μL 标准浓度的miR-661 模拟物(或miR 阴性对照)于无血清Opti-MEM 培养液中共孵育15 min,并转染入293T 细胞中。36 h 后参照双萤光素酶报告基因检测试剂盒说明书,使用裂解液裂解细胞并加入萤火虫萤光素酶底物,通过化学发光仪检测萤火虫荧光素酶活性,随后检测海肾萤光素酶活性,计算萤火虫萤光素酶与海肾萤光素酶活性的比值。
3.8 Western blot 实验 将三羟甲基氨基甲烷3.02 g、甘氨酸18.8 g 和十二烷基硫酸钠1 g 加水溶解,定容至1 L,制成电泳液。将三羟甲基氨基甲烷5.8 g、甘氨酸2.9 g 和十二烷基硫酸钠0.376 g 加水溶解,定容至800 mL,并加入200 mL 甲醇,制成转膜液。组装电泳槽,倒入电泳液,在配好的SDS-PAGE 胶中每孔加入15 μg 蛋白样品与适量蛋白标准品。接通电泳仪电源后,首先以恒压80 V 进行电泳,随后以120 V 恒压电泳直至样品移动至分离胶末端。将PVDF 膜置于甲醇中激活,随后将海绵、双层滤纸、凝胶、PVDF 膜、双层滤纸,海绵从下到上依次安装并夹紧。根据目标蛋白的分子量大小,在冰浴中按280 mA 恒流的条件转膜90 min。使用TBST 溶液配制5%的牛血清白蛋白溶液,将PDVF 膜置于配置好的牛血清白蛋白溶液中室温封闭1 h。TBST漂洗后,将对应PVDF 膜裁剪后置于对应配置好的Ⅰ抗中,4 ℃摇床孵育过夜或室温下孵育1 h。取出PVDF 膜,使用TBST 溶液洗涤3 次,每次10 min。将与Ⅰ抗对应种属的Ⅱ抗按1∶10 000 的比例配制于5%牛血清白蛋白溶液中,将PVDF 膜置于含有Ⅱ抗的溶液中,于室温在摇床上缓慢孵育1.5 h。取出PVDF 膜,使用TBST 溶液洗涤3 次,每次10 min。使用电化学超敏发光液进行曝光显影。使用ImageJ 软件对目标条带进行灰度定量分析。
从“伙伴”到“对手”:《美国国家安全战略报告》的话语空间分析 ……………………… 刘文宇 徐博书(6.8)
4 统计学处理
用GraphPad Prism 8.0 软件进行统计学分析,KS检验数据符合正态分布,方差分析数据符合方差齐性。数据以均数±标准差(mean±SD)表示,两两比较比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 circKEAP1 在骨肉瘤细胞系中表达上调,且具有更高的稳定性
通过对基因表达集合数据库(GSE140256)的数据进行分析,我们筛选到在骨肉瘤组织中表达显著上调的circRNA circKEAP1,又名has_circ_0049271(图1A)。RT-qPCR 结果显示,相比于对照成骨细胞hFOB1.19,骨肉瘤细胞系 U2OS、HOS、MG63、143B和SJSA-1 中circKEAP1 具有较高的丰度,差异有统计学意义(P<0.01),见图1B。circKEAP1 是由其母基因KEAP1的2 号外显子自身成环形成,一代测序确认其circRNA 结构,且成环剪切位点为“TGGA”(图 1C)。PCR 结果显示,circKEAP1 仅存在于互补DNA 中,且不存在于基因组DNA 中。相比之下,其母基因KEAP1则同时存在于互补DNA 和基因组DNA 中(图1D)。此外,我们使用放线菌素D 抑制RNA 合成。RT-qPCR 结果显示,相比于 KEAP1 线性RNA,circKEAP1 具有更高的稳定性,12 和 24 h 降解速率有显著差异(P<0.05或P<0.01),见图1E。
2 circKEAP1 促进骨肉瘤细胞活力与迁移,抑制其凋亡
构建针对circKEAP1 环状剪切位点的小干扰RNA,使用 Lipofectamin 3000 将 si-circKEAP1 转染入143B 细 胞 。 RT-qPCR 结 果 显 示 ,143B 细 胞 中 的circKEAP1 表达显著下降(P<0.01),见图2A。CCK-8 实验结果显示,敲减circKEAP1后,143B 细胞的活力显著降低,48 和72 h 相比差异有显著统计学意义(P<0.01),见图2B。细胞迁移实验结果显示,敲减circKEAP1后,143B 细胞的迁移能力显著下降(P<0.01),见图2C。此外,流式细胞凋术结果显示,敲减circKEAP1后,143B 细胞的凋亡比例显著上升(P<0.01),见图2D。
3 circKEAP1 结合 miR-661 影响 143B 骨肉瘤细胞的活力和迁移
通过检索CircBank 数据库与CircInteractome 数据库,预测能与circKEAP1 结合的miRNA 并取二者交集。进一步通过生物信息学分析与文献检索,得到在骨肉瘤细胞中具有抑癌作用的miR-661(图3A)[10,13]。circKEAP1 与 miR-661 存在较高评分的结合位点(图3B)。构建miR-661 模拟物、野生型及突变型双萤光素酶报告质粒。双萤光素报告基因实验显示,miR-661 能与circKEAP1 结合,而不能与位点突变的 circKEAP1 结合(P<0.01),见图 3C。构建miR-661 的抑制剂,将 si-circKEAP1 与 miR-661 抑制剂(或miRNA 抑制剂对照)共转染入143B 细胞。CCK-8 实验结果显示,miR-661 抑制剂能部分逆转敲减circKEAP1介导的细胞活力降低,在48 和72 h 有显著差异(P<0.05 或P<0.01),见图3D。细胞迁移实验结果显示,miR-661 抑制剂能部分逆转敲减circKEAP1引起的细胞迁移减少(P<0.01),见图3E。此外,流式细胞细胞术结果显示,抑制miR-661 能部分逆转si-circKEAP1 介导的凋亡增加(P<0.01),见图3F。
4 miR-661能与LIF相互作用
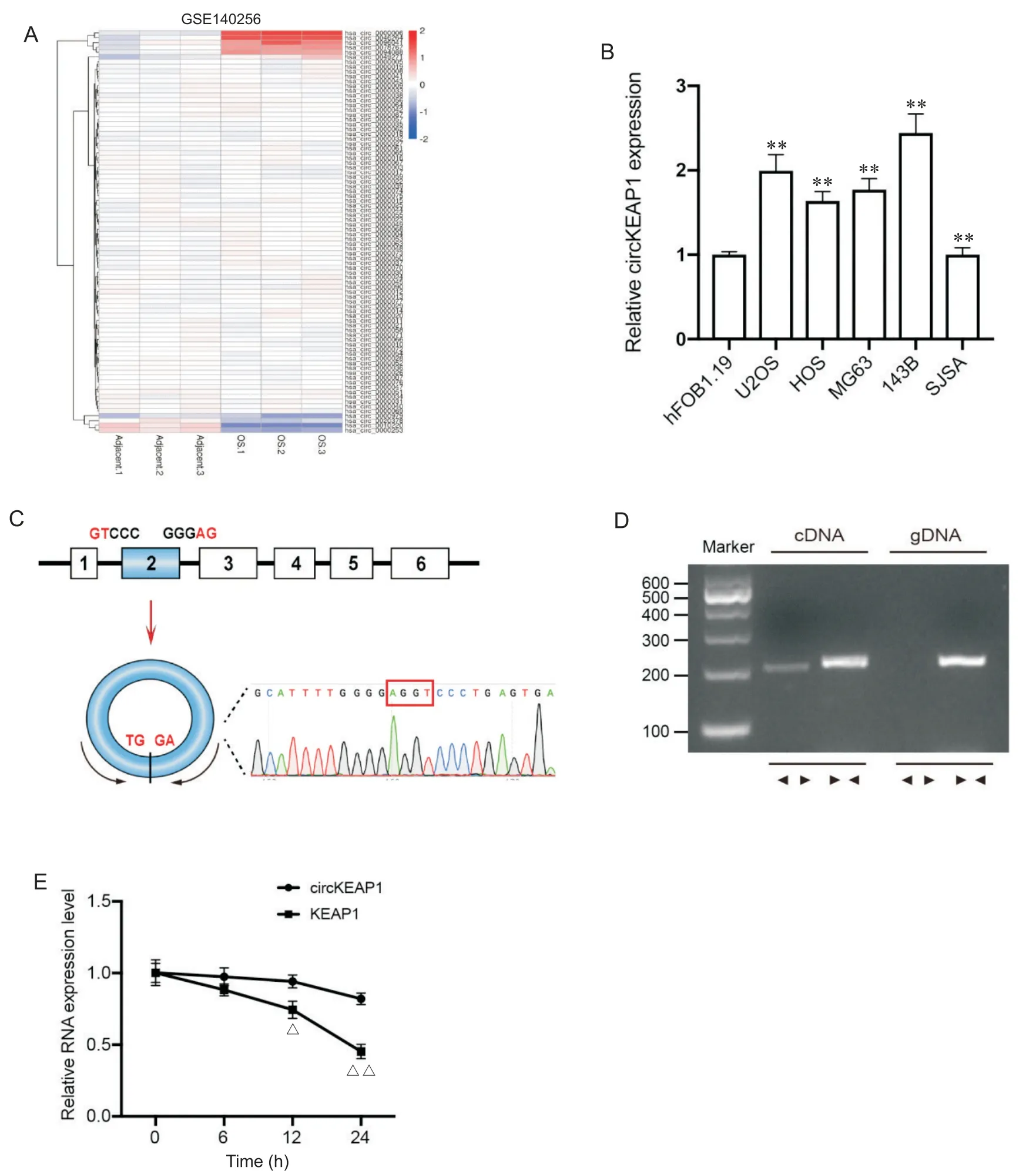
Figure 1. The characteristics of circKEAP1 and its expression alteration in osteosarcoma cells. A:the differential expression of circRNAs in osteosarcoma and its adjacent tissue in GSE140256;B:the expression level of circKEAP1 in osteoblast hFOB1.19 and different osteosarcoma cell lines including U2OS,HOS,MG63,143B and SJSA-1;C:schematic illustration demonstrated the formation of circKEAP1 via exon 2 of KEAP1,and the formation of circKEAP1 was validated using PCR followed by Sanger sequencing;D:PCR confirming the existence of circKEAP1 in 143B cells(circKEAP1 was amplified by divergent primers in cDNA but not gDNA,while KEAP1 was amplified by convergent primers in both cDNA and gDNA);E:the expression levels of circKEAP1 and KEAP1 mRNA in 143B cells treated with actinomycin D at the indicated time points were detected by RT-qPCR. Mean±SD. n=3.**P<0.01 vs hFOB1.19 group;△P<0.05,△△P<0.01 vs circKEAP1 group.图1 circKEAP1的特性及其在骨肉瘤细胞中表达的改变
为进一步探究circKEAP1 发挥作用的下游靶基因,我们将转染si-circKEAP1 后的143B 骨肉瘤细胞进行转录组测序。热图显示敲减circKEAP1的143B细胞与对照差异RNA 表达情况(图4A)。TargetScan数据库预测miR-661下游有1 293个靶基因。将预测数据与转录组中下调的RNA 取交集,进一步生物信息学分析结合文献检索,可得高评分靶基因LIF(图4B)。在 143B 细胞中,使用 si-circKEAP1 敲减circKEAP1,进一步 RT-qPCR 分析显示 LIF 的 mRNA 水平显著下调(P<0.01),见图4C。生物信息学分析结果显示LIF基因上有3 个miR-661 的结合位点,分别位于3'非翻译区135~157、983~1005 和1978~2001。分别构建针对3个位点的Luc-LIF突变型双萤光素酶报告质粒(以及Luc-LIF 野生型对照质粒),miR-661 模拟物(与miRNA 对照)在293T 中共转染。萤光素酶报告基因实验结果显示,miR-661 能与LIF 结合,且3个位点均有较强的结合能力(P<0.01),见图4D。
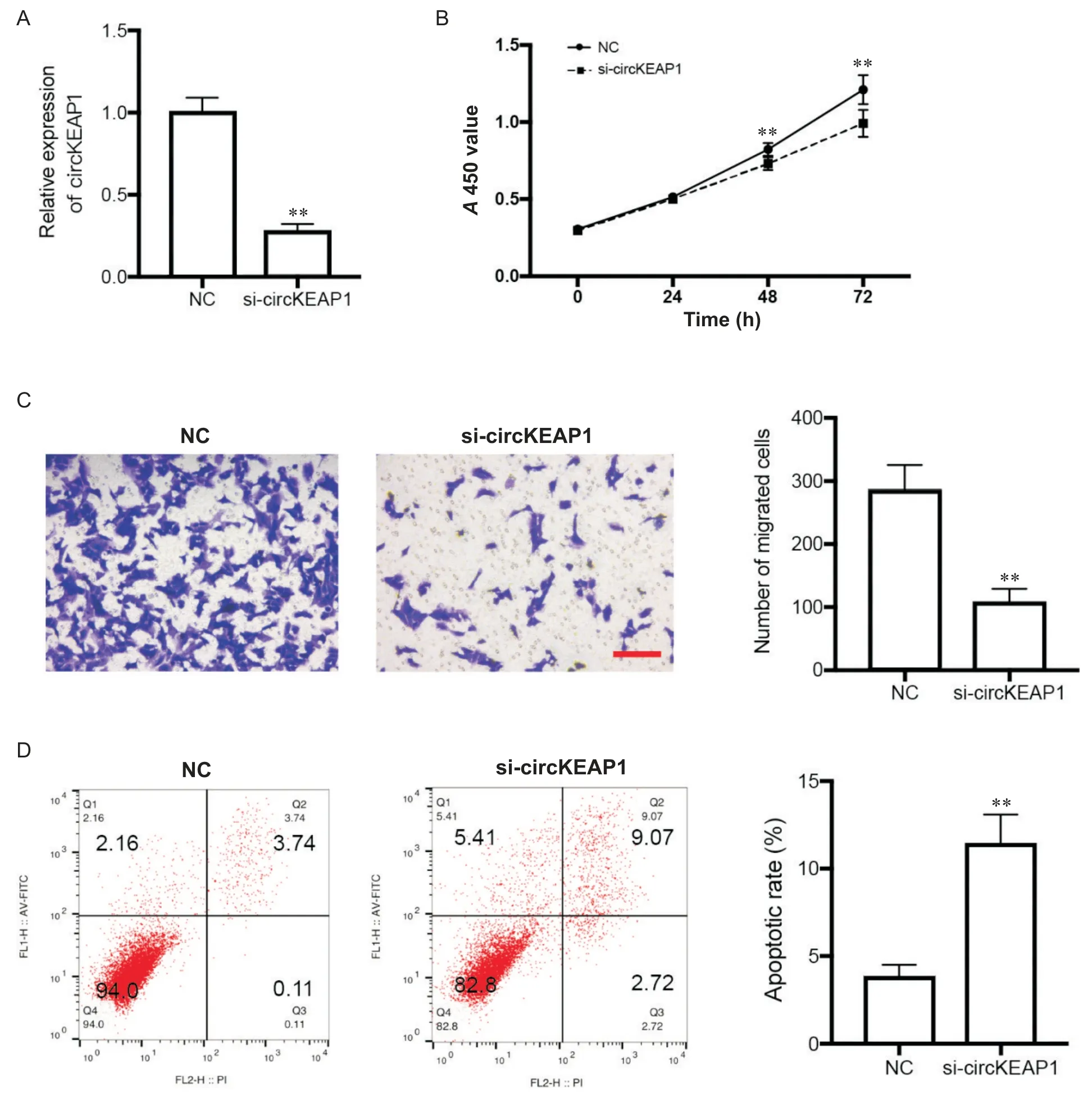
Figure 2. circKEAP1 knockdown inhibited the viability and migration of 143B cells. A:the expression level of circKEAP1 evaluated by RT-qPCR;B:CCK-8 assay showing the viability of 143B cells transfected with si-circKEAP1 at 24,48 and 72 h;C:Transwell assay demonstrating the migration ability of 143B cells after circKEAP1 knockdown(scale bar=100 μm);D:flow cytometry detecting the apoptosis rate change after 143B cells transfected with si-circKEAP1. Mean±SD. n=3.**P<0.01 vs NC group.图2 敲减circKRAP1抑制骨肉瘤细胞143B的活力和迁移
5 circKEAP1通过LIF提高骨肉瘤细胞活力并促进其迁移
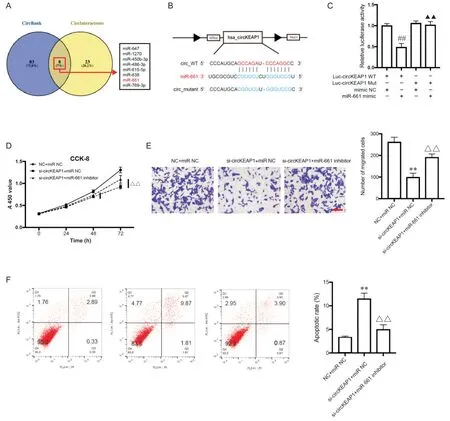
Figure 3. circKEAP1 enhanced the viability and migration of 143B cells through miR-661. A:Venn diagram demonstrating the targeted miRNAs of circKEAP1 predicted by CircBank and CircInteractome database;B:the interaction regions and the sequence of circKEAP1,miR-661 and mutant circKEAP1;C:luciferase reporter assay showing the interaction between circKEAP1 and miR-661;D:CCK-8 assay revealing the viability changes of 143B cells transfected with si-circKEAP1 and miR-661 inhibitor;E:Transwell assay showing the migration ability of 143B cells transfected with si-circKEAP1 and miR-661 inhibitor(scale bar=100 μm);F:flow cytometry detecting the apoptosis rate change of 143B cells transfected with sicircKEAP1 and miR-661 inhibitor. Mean±SD. n=3.**P<0.01 vs NC+miR-NC group;△△P<0.01 vs si-circKEAP1+miRNC group;##P<0.01 vs Luc-circKEAP1 WT+mimic NC group;▲▲P<0.01 vs Luc-circKEAP1 WT+miR-661 mimic group.图3 circKEAP1通过吸附miR-661促进骨肉瘤细胞活力与迁移
讨 论

Figure 4. miR-661 could interact with LIF. A:heatmap of RNA sequencing demonstrating the differential expression genes between 143B cells treated with si-circKEAP1 and controls;B:Venn diagram showing the overlap between target genes of miR-661 predicted by TargetScan database and down-regulated genes in RNA sequencing data;C:RT-qPCR revealing the LIF mRNA expression after circKEAP1 knockdown;D:luciferase reporter assay exhibiting the interaction between LIF and miR-661 in the 3 predicted binding sites(diagram illustrates the sequences of the 3 binding sites). Mean±SD. n=3.**P<0.01 vs Luc-LIF WT+mimic NC group;△△P<0.01 vs Luc-LIF WT+miR-661 mimic group;##P<0.01 vs NC group.图4 miR-661能与LIF基因相互作用
circRNA 是一种共价闭环的非编码RNA,不具备5'末端帽子和3'末端多聚腺苷酸尾巴。40 多年前,circRNA 首次被发现。随后很长一段时间,这种RNA 被认为是一种无意义的剪切产物[14]。然而,近些年随着高通量测序及针对circRNA 生物信息算法的发展,越来越多的circRNA 在真核细胞中被发现并鉴定,且呈现出一定的组织特异性分布[15]。大部分circRNA 定位于细胞质,经可变剪切从编码蛋白的基因中产生。通常circRNA 由一个或多个外显子构成,也有少量由内含子或内含子联合外显子构成[16]。尽管circRNA 相对于线性基因表达丰度稍低,但其高度的稳定性使得circRNA 在许多病理生理过程中发挥着重要的作用。小鼠circRNA-42398通过调控TGF-β1/Smads 信号通路抑制肝星状细胞活化[17]。在结肠癌中高表达的circPTK2 可以与波形蛋白(vimentin)的Ser38、Ser55 和Ser82 位点相结合,促进结肠癌的进展。这也使得circPTK2 有望成为治疗结肠癌的潜在靶点[18]。在骨肉瘤中此前有研究报道,circECE1 通过竞争结合c-Myc 蛋白泛素化位点,减弱c-Myc蛋白泛素化降解,促进TXNIP转录进而促进骨肉瘤的瓦博格效应[19]。鉴于circRNA 重要的生物学功能与作用,寻找在特定疾病中具有较高丰度与稳定性的一类circRNA,可能是干预并治疗特病疾病,尤其是肿瘤的重要靶点。

Figure 5. LIF overexpression reversed circKEAP1 knockdown-induced inhibition of viability and migration of 143B cells. A:RT-qPCR revealing the mRNA expression of LIF in 143B cells transfected with si-circKEAP1 and LIF;B:Western blot revealing the protein expression of LIF in 143B cells transfected with si-circKEAP1 and LIF;C:CCK-8 assay demonstrating the viability of 143B cells transfected with si-circKEAP1 and LIF;D:Transwell assay showing the migration rate change of 143B cells transfected with si-circKEAP1 and LIF(scale bar=100 μm);E:flow cytometry detecting the apoptosis rate change of 143B cells transfected with si-circKEAP1 and LIF. Mean±SD. n=3.*P<0.05,**P<0.01 vs NC+Vec group;△△P<0.01 vs si-circKEAP1+Vec group.图5 过表达LIF能逆转敲减circKEAP1介导的细胞活力和迁移抑制
本项研究中,我们通过分析基因表达集合数据库GSE140256,首次检测并筛选出在骨肉瘤组织中显著表达上调的circRNA circKEAP1。经RT-qPCR确认,相对于成骨细胞hFOB1.19,该circRNA在各骨肉瘤细胞系中高表达,同时使用放线菌素D 验证了其具有较高的稳定性。这表明circKEAP1 在骨肉瘤细胞中可能具有潜在的重要功能。circKEAP1 是由其线性转录本第2 号外显子成环而来,针对其剪切位点我们设计了小干扰RNA,通过敲减circKEAP1的方法,验证了其具有促进骨肉瘤细胞143B 增殖与迁移,同时抑制凋亡的功能。circRNA 具有较多微小RNA 结合位点,可通过海绵样吸附微小RNAs 发挥作用[4]。这也是circRNA 被报道最多的作用机制之一。因此通过分析数据库CircBank 与CircInteractome,结合文献报道miR-661可通过增强骨肉瘤凋亡抑制骨肉瘤进展,我们锁定了miR-661 可能是潜在的circKRAP1 下游之一。circKEAP1 表面具有miR-661的反应元件,我们通过萤光素酶报告基因实验验证了二者的结合。此外,抑制miR-661 可以部分逆转敲减circKEAP1对骨肉瘤细胞的抑制作用,这进一步验证了miR-661是circKEAP1的下游信号分子。
为进一步探究下游的效应基因,我们通过转录组测序分析筛选受circKEAP1 调控的基因,同时通过TargetScan 数据库生物信息学分析miR-661 下游靶基因,取二者交集,经过筛选得到LIF基因。LIF基因是白细胞介素6 细胞因子家族中最具多效性的成员之一,可激活多种信号通路,例如JAK/STAT 通路、MAPK 通路和PI3K 通路等。尽管如此,其在不同类型细胞中可能具有矛盾的相反作用,包括刺激或抑制细胞增殖、分化和存活等[20]。有学者报道,LIF可通过激活STAT3 通路促进骨肉瘤生长[21]。本研究中,我们验证了LIF可与miR-661相互作用,且3个结合位点均有较高的结合力。过表达LIF基因可部分逆转敲减circKEAP1介导的肿瘤增殖抑制、凋亡增加与迁移减弱。这表明,circKEAP1 可通过对miR-661的海绵吸附作用,进一步调控LIF,发挥其对骨肉瘤细胞的促肿瘤作用。当然,我们并不排除circKEAP1能够靶向其他微小RNA,或者通过结合其他RNA 结合蛋白,甚至发挥翻译作用引起骨肉瘤的生物学改变。该部分研究将在后续进一步展开。
综上所述,circKEAP1 能够通过吸附miR-661,进而调控其靶基因LIF,促进骨肉瘤细胞的增殖与迁移。在体外水平,circKEAP1-miR-661-LIF 轴是干预骨肉瘤细胞生物学行为的重要信号靶点,为骨肉瘤治疗提供了参考资料。

