葛根素通过调节PINK1-parkin信号通路介导的线粒体自噬抑制慢性阻塞性肺疾病大鼠肺泡上皮细胞凋亡*
潘晓杰, 范嘉铨, 夏光琴△
(1贵州医科大学附属金阳医院呼吸与危重症医学科,贵州 贵阳 550023;2广州医科大学附属第二医院呼吸与危重症医学科,广东 广州 510260)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种临床常见的慢性炎性呼吸系统疾病,主要表现为胸闷、气短、咳嗽等症状[1-2]。近年来全球范围内COPD 的发病率与死亡率均呈上升趋势[3],严重影响患者健康,增加家庭与社会负担。目前临床上用于治疗COPD 的药物效果不佳,易产生不良反应,因此探索新的药物是COPD 治疗与预后的关键。
葛根素是中草药葛根的主要生物活性成分,是一类异黄酮类化合物,具有退热、镇痛、消炎及抗肿瘤的作用,已被证实在肺癌等癌症中能有效发挥抗肿瘤特性[4-5]。近年来研究发现,葛根素对于脂多糖(lipopolysaccharide,LPS)引起的肺组织炎症损伤具有显著的抑制作用[6]。葛根素能够通过抑制含FUN14 结构域蛋白 1(FUN14 domain containing 1,FUNDC1)介导的线粒体自噬,参与COPD 进展,减少肺泡上皮细胞凋亡,减轻COPD[7];也能够通过介导PTEN 诱导假定激酶 1(PTEN-induced putative kinase 1,PINK1)-parkin 诱导的线粒体自噬,改善大脑皮层神经元免受镉诱导的神经毒性[8];但其是否能通过PINK1-parkin 信号通路介导的线粒体自噬抑制COPD 肺泡上皮细胞凋亡尚不清楚。PINK1-parkin信号通路介导的线粒体自噬是特异性清除受损线粒体的经典信号通路[9]。本研究通过建立大鼠COPD模型,探讨葛根素是否能够通过调控PINK1-parkin信号通路介导的线粒体自噬,发挥肺保护作用,为临床治疗COPD提供新的用药参考。
材料和方法
1 实验动物
SPF 级雄性 SD 大鼠,6~8 周龄,体质量 200~220 g,购自河北医科大学生物医学工程中心,动物生产许可证号为SCXK(冀)2019-001。实验前适应性饲养于湿度40%~55%,温度20~25℃,光照循环12 h/12 h的动物房中,期间自由饮水采食。实验遵守动物伦理委员会标准,符合“3R”原则。
2 主要试剂与仪器
LPS(A2313)购自北京康瑞纳生物科技有限公司;葛根素(YG10447)购自上海韵泰信息科技有限公司;自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA;T1879)购自TargetMol;TNF-α 检测试剂盒(EKR38696)、IL-1β 检测试剂盒(EK-R36877)和 IL-6 检测试剂盒(EK-R36902)购自北京博沃尔斯生物科技有限公司;HE染色试剂盒(YT8681)购自北京伊塔生物科技有限公司;TUNEL染色试剂盒(A112-01)购自南京诺唯赞生物科技股份有限公司;DAB 染色试剂盒(SW1020)和ECL 显色液(PE0010)购自北京索莱宝科技有限公司;BECN1 抗体(ab210498)、LC3B 抗体(ab48394)、Bcl-2 抗 体(ab196495)、Bax 抗 体(ab216985)、PINK1 抗体(ab186303)、parkin 抗体(ab15494)及辣根过氧化物酶(horseradish peroxidase,HRP)标 记 的 羊 抗 兔/鼠 Ⅱ 抗(ab6721 和ab6789)购自Abcam。
小动物肺功能分析仪购自EMMS;E100 光学显微镜购自Nikon;Revolve 荧光显微镜购自Echo Laboratories;Azure 200 凝胶成像系统购自普迈精医科技(北京)有限公司。
3 分组、模型制备及给药
参照文献[10],采用气管滴注LPS+烟熏法建立COPD 大鼠模型:于实验第1 天向SD 大鼠气管内滴注1 mg/kg 的LPS,之后将大鼠置于规格为60 cm×40 cm×40 cm 的自制玻璃烟薰箱,点燃香烟持续熏30 min,2周后即第14天时再进行一次LPS滴注,之后再次进行烟熏,2 周后进行肺功能检测,以肺功能下降提示大鼠造模成功。将造模成功后的大鼠按照随机数字表法分为模型组、低剂量葛根素组、中剂量葛根素组、高剂量葛根素组和3-MA 组,每组15 只。另取15 只大鼠不做处理作为对照组。参照文献[11],按照成人与大鼠体表面积比,低、中、高剂量葛根素组大鼠分别灌胃 50、100 和 200 mg/kg 葛根素,3-MA 组大鼠腹腔注射10 mg/kg 3-MA[12]。模型组与对照组均灌胃并腹腔注射等体积生理盐水。各组大鼠每日给药1次,连续给药8周。
4 指标检测
4.1 大鼠肺功能检测 末次给药结束后24 h,麻醉大鼠,采用小动物肺功能分析仪检测大鼠用力肺活量(forced vital capacity,FVC)、0.1 s 用力呼气容积(forced expiratory volume in 0.1 s,FEV0.1)和呼气流量峰值(peak expiratory flow,PEF)。
4.2 大鼠肺泡灌洗液中 TNF-α、IL-1β 和 IL-6 水平的检测 肺功能测定结束后,各组随机取5 只大鼠,处死后开胸,分离气管和肺,结扎右肺门,用注射器吸取3 mL 生理盐水注入左肺,反复灌洗3次,收集肺泡灌洗液,1500 r/min 离心15 min,取上清液,采用ELISA 法,按照试剂盒检测说明书进行操作,检测肺泡灌洗液中TNF-α、IL-1β和IL-6水平。
4.3 HE染色观察大鼠肺组织病理学变化 取血后,选取剩余的10只大鼠,处死后迅速取出肺组织,分为两部分,一部分制备10%的组织匀浆,另一部分心肌组织用4%多聚甲醛固定,石蜡包埋、切片。切片用二甲苯和乙醇浓度梯度脱蜡、水化后,浸入苏木精3~4 min,并用伊红染色1~2 min。之后,切片分别在80%、90%和100%乙醇中脱水3~5 min,然后用中性树胶密封。参照文献[13]中肺组织病理损伤评分标准,对肺泡腔充血、炎症细胞浸润、肺泡间隔增宽等损伤程度进行评估,按照无损伤(0分)、轻度损伤(1分)、中度损伤(2 分)和重度损伤(3 分)进行评分。每组选取5 张不同视野照片进行评分,取平均值作为最终评分。
4.4 TUNEL 染色检测肺泡上皮细胞凋亡 取石蜡包埋的肺组织,切成5 μm 厚的切片,随后,进行脱蜡和水化,封闭液室温封闭1 h,加入3% H2O2消化后,进行TUNEL 染色和苏木素染色,置于显微镜下观察染色结果并拍照,记录肺泡上皮细胞凋亡情况。出现棕色颗粒的细胞为凋亡细胞,所有细胞的细胞核呈蓝色。每组随机选取5 张不同视野对细胞进行计数,计算细胞凋亡率。凋亡率(%)=凋亡细胞数/总细胞数×100%。
4.5 免疫组化法检测肺组织中自噬相关蛋白的表达 收集各组大鼠肺组织切片,胰蛋白酶修复抗原,加入 3% H2O2室温孵育 30 min 后,再加入 5% BSA 室温封闭1 h,加入Ⅰ抗(BECN1 和LC3B 抗体,稀释倍数1∶1 000),4 ℃孵育过夜,再加入HRP 标记的Ⅱ抗(稀释倍数1∶2 000),采用DAB 显色,苏木素复染,ImageJ 7.0软件分析积分吸光度,计算目的蛋白的相对表达量。
4.6 Western blot 检测肺组织中PINK1-parkin 通路及凋亡相关蛋白的表达 取-80 ℃冰箱中保存的适量肺组织,提取总蛋白,在含有蛋白酶抑制剂(PMSF)的RIPA 裂解液中匀浆,12 000×g离心10 min取上清液,使用CelLytic™NuCLEAR™提取试剂盒提取总蛋白。使用BCA 法测定蛋白质浓度后,将等量的蛋白质样品加到8%~12%SDS-PAGE凝胶上,并在冰上电泳90 min。然后将分离的蛋白质转移到PVDF 膜上,用5%脱脂牛奶封闭,然后将膜与Ⅰ抗(PINK1、parkin、Bcl-2 和 Bax 抗体,稀释倍数 1∶500)在4 ℃下孵育过夜。然后用HRP 标记的山羊抗兔Ⅱ抗(1∶2 000)在室温下孵育1 h。ECL 试剂显色,使用Image-Pro Plus 6.0 软件分析条带的灰度值,并以βactin作为内参照,分析膜上目的蛋白相对表达量。
5 统计学分析
使用SPSS 20.0 软件进行统计分析。结果用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,组间有差异进一步采用SNK-q检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠肺功能比较
与对照组比较,模型组大鼠FVC、FEV0.1和PEF水平均显著下降(P<0.05);与模型组比较,各剂量葛根素组与 3-MA 组大鼠 FVC、FEV0.1和 PEF 水平均显著升高(P<0.05),且具有剂量依赖性(P<0.05);与高剂量葛根素组比较,3-MA 组大鼠 FVC、FEV0.1和PEF水平无显著差异(P>0.05),见图1。
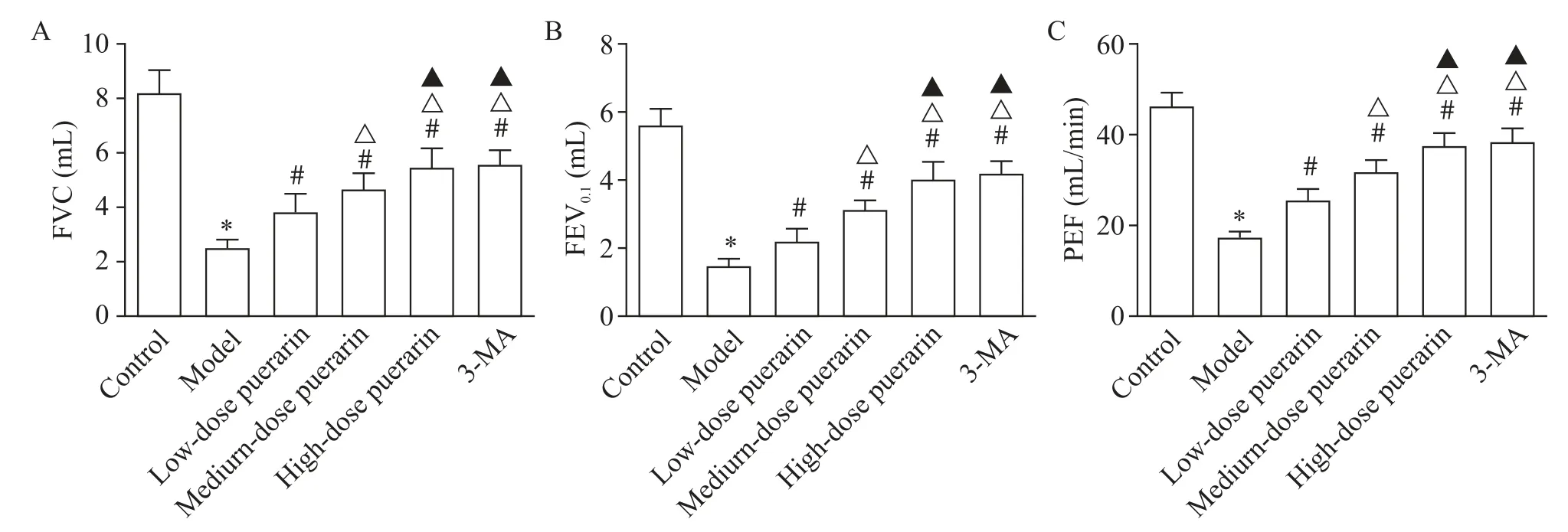
Figure 1. Changes of pulmonary function indexes in rats. A:forced vital capacity(FVC);B:forced expiratory volume in 0.1 s(FEV0.1);C:peak expiratory flow(PEF). Mean±SD. n=15.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose puerarin group;▲P<0.05 vs medium-dose puerarin group.图1 大鼠肺功能指标变化
2 各组大鼠肺泡灌洗液中炎症因子水平比较
与对照组比较,模型组大鼠肺泡灌洗液中TNF-α、IL-1β和IL-6水平均显著升高(P<0.05);与模型组比较,低、中、高剂量葛根素组和3-MA 组大鼠肺泡灌洗液中 TNF-α、IL-1β 和 IL-6 水平均显著降低(P<0.05),且随着葛根素剂量的升高而逐渐降低(P<0.05);与高剂量葛根素组比较,3-MA 组大鼠肺泡灌洗液中 TNF-α、IL-1β 和 IL-6 水平无显著变化(P>0.05),见图2。
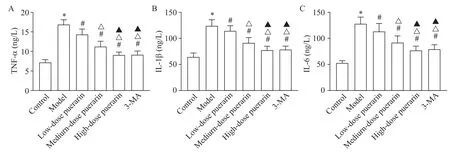
Figure 2. Levels of inflammatory factors in alveolar lavage fluid of rats. A:TNF-α;B:IL-1β;C:IL-6. Mean±SD. n=5.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose puerarin group;▲P<0.05 vs medium-dose puerarin group.图2 大鼠肺泡灌洗液中炎症因子水平比较
3 各组大鼠肺组织病理学变化比较
HE 染色结果(图3)显示,对照组大鼠肺组织结构清晰,未见病变,肺泡腔未见充血与渗出,病理学评分为1.32±0.22;与对照组比较,模型组大鼠肺组织病变明显,肺泡腔严重充血,炎症细胞大量浸润,肺泡间隔与肺泡壁增厚,病理评分(7.94±0.85)显著升高(P<0.05);与模型组比较,低、中、高剂量葛根素组和3-MA 组大鼠肺组织病变逐渐减轻,肺泡腔充血程度逐渐降低,炎症细胞浸润逐渐减少,病理评分分别 为 6.14±0.58、4.87±0.52、3.26±0.33 和 3.31±0.34,差异均有统计学意义(P<0.05);与高剂量葛根素组比较,3-MA 组肺组织病理评分差异无统计学意义(P>0.05)。
4 各组大鼠肺组织肺泡上皮细胞凋亡情况比较
TUNEL 染色结果(图4)显示,与对照组比较,模型组大鼠肺组织中肺泡上皮细胞凋亡率显著升高(P<0.05);与模型组比较,各剂量葛根素组和3-MA组大鼠肺泡上皮细胞凋亡率显著降低(P<0.05),且葛根素各剂量组间具有剂量依赖性(P<0.05);与高剂量葛根素组比较,3-MA 组大鼠肺泡上皮细胞凋亡率无显著变化(P>0.05)。
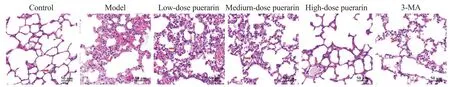
Figure 3. HE staining of rat lung tissues(×200).图3 大鼠肺组织HE染色
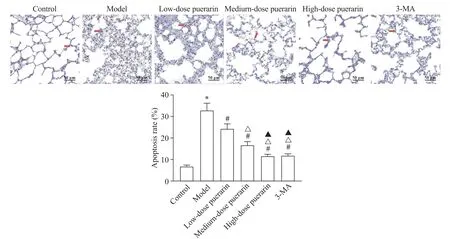
Figure 4. TUNEL staining of rat lung tissues(×200)and the apoptosis rates of alveolar epithelial cells. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose puerarin group;▲P<0.05 vs medium-dose puerarin group.图4 大鼠肺组织TUNEL染色和肺泡上皮细胞凋亡率比较
5 各组大鼠肺组织中自噬相关蛋白表达比较
与对照组比较,模型组大鼠肺组织BECN1 和LC3B 表达显著升高(P<0.05);与模型组比较,各剂量葛根素组和3-MA 组大鼠肺组织BECN1 和LC3B表达显著降低(P<0.05),且具有剂量依赖性(P<0.05);与高剂量葛根素组比较,3-MA 组大鼠肺组织BECN1和LC3B表达无显著差异(P>0.05),见图5。
6 各组PINK1-parkin通路及凋亡相关蛋白表达
与对照组比较,模型组大鼠肺组织PINK1、parkin和Bax蛋白表达均显著升高(P<0.05),Bcl-2蛋白表达显著降低(P<0.05);与模型组比较,各剂量葛根素组和 3-MA 组大鼠肺组织 PINK1、parkin 和 Bax 蛋白表达均显著降低(P<0.05),Bcl-2 表达显著升高(P<0.05),且各剂量葛根素组间均有显著差异(P<0.05);与高剂量葛根素组比较,3-MA 组大鼠肺组织PINK1、parkin、Bax 和 Bcl-2 蛋白表达差异无统计学意义(P>0.05),见图6。
讨 论
COPD 是一种以进行性气流受限为特征的炎性呼吸道疾病,主要病理表现为肺泡结构受损,肺泡腔扩大,最终导致肺功能下降[10]。吸烟是引起COPD发生的主要因素[11]。因此,本研究采用长期烟熏配合LPS气管滴注建立COPD 模型,结果显示大鼠肺组织病变明显,肺泡充血,肺泡腔扩大,大量炎症细胞浸润,肺功能指标FVC、FEV0.1和PEF 水平降低,炎症因子 TNF-α、IL-1β 和 IL-6 水平升高,提示 COPD 大鼠肺组织受损,肺功能降低,炎症反应发生,与以往研究中COPD模型[12]特征类似,提示造模成功。
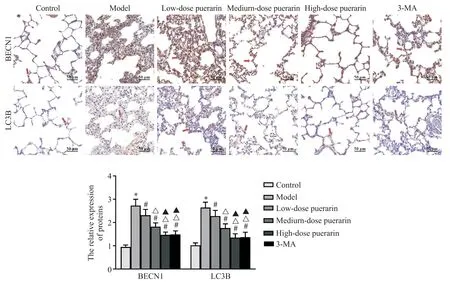
Figure 5. Expression of autophagy-related proteins in lung tissues of rats in each group(immunohistochemical staining,×200).Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose puerarin group;▲P<0.05 vs medium-dose puerarin group.图5 各组大鼠肺组织中自噬相关蛋白表达
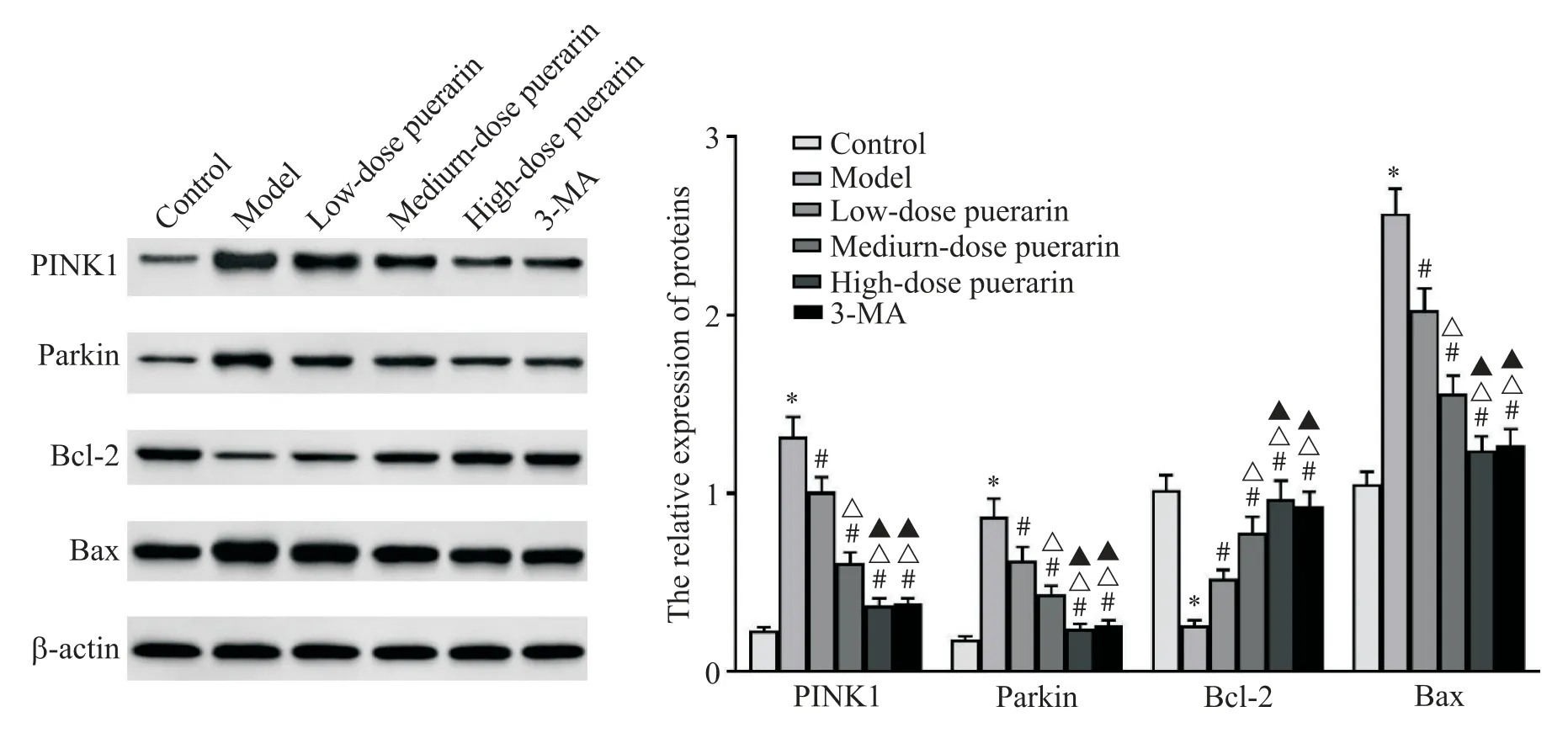
Figure 6. Western blot detection of PINK1,parkin,Bax and Bcl-2 expression in rat lung tissues. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs low-dose puerarin group;▲P<0.05 vs medium-dose puerarin group.图6 大鼠肺组织中PINK1、parkin、Bax和Bcl-2蛋白表达
越来越多的研究证实,自噬在COPD的发生与发展中发挥重要作用[13-14]。研究发现,PINK1-parkin 通路诱导的线粒体自噬在肺损伤的发展中发挥重要作用,一方面自噬能够清除受损线粒体,引起机体抗应激能力降低,加速机体受损[15-16];另一方面自噬反应的过度激活引起细胞凋亡,最终加重组织或器官损伤[17]。本研究结果显示,COPD 模型大鼠肺泡上皮细胞凋亡率升高,Bcl-2 蛋白表达降低,Bax 蛋白表达升高,自噬标志物BECN1 和LC3B 表达升高,且PINK1和parkin 蛋白表达均显著上调,提示COPD 大鼠肺组织中PINK1-parkin 通路激活,引起线粒体不断受损,导致自噬过度,诱导细胞凋亡,造成COPD发展。
由于中药多靶点、疗效好以及不良反应小等优势,在临床治疗疾病中具有重要作用。葛根素具有显著抗炎、抗肿瘤特性,目前已被广泛应用于心脑血管疾病、癌症等多种疾病的治疗[18-20]。研究发现,葛根素在内毒性急性肺损伤中可有效抑制过度炎症反应,减少炎症细胞的激活,减轻肺水肿,临床可用作肺损伤潜在抗炎药物[21]。本研究中,低、中、高剂量葛根素干预COPD 大鼠后,大鼠肺组织病理损伤不同程度减轻,肺功能恢复,肺泡灌洗液中炎症因子TNF-α、IL-1β和IL-6水平降低,提示葛根素可显著减轻炎症反应,保护肺功能。此外,葛根素对肺组织中BECN1、LC3B、PINK1、parkin 及Bax 表达均具有显著下调作用,且可上调Bcl-2 表达,降低肺泡上皮细胞凋亡率,同时本研究发现,葛根素与自噬抑制剂3-MA 作用一致,表明葛根素可能通过抑制PINK1-parkin 通路诱导的线粒体自噬反应的激活,减轻细胞凋亡,且具有一定剂量依赖性。
综上所述,葛根素可能通过调节PINK1-parkin通路诱导的线粒体自噬,抑制肺泡上皮细胞凋亡,减轻炎症反应,为葛根素在COPD 辅助治疗中应用奠定理论依据,但由于自噬反应的作用机制复杂,参与调控自噬的通路多样,因此未来还需深入探索。

