三白草酮通过调控海马Nrf2/HO-1表达减少酒精戒断大鼠抑郁样行为*
姜 敏, 李露露▲, 吴 桐, 李成冲, 王宇晨, 焦 宇, 刘艺涵,马淑丽, 郑晓宇, 赵容杰△, 赵正林△
(1齐齐哈尔医学院医学技术学院,黑龙江 齐齐哈尔 161006;2齐齐哈尔医学院精神卫生学院,黑龙江 齐齐哈尔 161006)
抑郁症(depression)主要表现为持续的悲伤情绪,并伴有一定的日常功能缺陷,是导致放弃生命的主要原因,现已成为世界范围内严重的公共卫生问题[1]。酒精作为一种非特异性药物,也是最常被滥用的药物之一[2]。酒精滥用会导致中毒和成瘾,戒断后可导致一系列情感障碍,诱发焦虑症或抑郁症等精神疾病。其发病机制非常复杂尚无明确的理论说明,多数学者认为去甲肾上腺素和多巴胺等单胺类神经递质的缺乏与抑郁症的发病相关[3],因此临床上利用单胺类神经递质治疗抑郁症。但由于该类药物的研发局限于发病机制,其适用范围十分狭窄。酒精戒断所致抑郁症的病理变化发现,氧化应激使大脑特定部位尤其是海马中大量神经细胞凋亡,抑制神经细胞再生,诱发神经系统的退行性改变会导致抑郁症[4-5]。但是目前还没有治疗效果良好的酒精戒断所致抑郁症药物。三白草酮(sauchinone,Sau)是从传统中草药三白草中提取的单体类化合物,具有清热解毒、抗炎抗氧化功效,具有细胞保护作用,广泛用于心血管系统、神经系统和免疫系统疾病的治疗。其中抗氧化作用对神经组织的再生与营养、保护作用备受学者的关注[6-8]。本实验首先建立动物模型从行为学和氧化应激指标的变化观察了Sau 对酒精戒断大鼠的抑郁样行为的改善作用,同时利用细胞实验,检测氧化应激信号通路相关蛋白的表达,进一步探讨Sau 的抗抑郁作用及其机制,为Sau 抗抑郁药物的研发提供基础实验依据。
材料和方法
1 动物
雄性 SPF 级 Sprague-Dawley 大鼠 32 只,8 周龄,体重(210±10)g,由齐齐哈尔医学院动物实验中心提供,使用许可证号:SYXK(黑)2021-013。所有大鼠均在专用IVC 鼠笼,在温度20~25 ℃,湿度30%~35%自动空气清洁设备的条件下饲养,自由摄食。
2 HT22细胞
小鼠海马神经细胞系HT22 购自BeNa Culture Collection,培养在含有10%胎牛血清(fetal bovine serum,FBS)的 Dulbecco's modified Eagle's medium(DMEM)高糖培养液中,于37 ℃、5% CO2培养箱中孵育生长。
3 主要药品与试剂
Sau 购于湖州展舒生物科技有限公司,纯度>98%;MTT 试剂盒、总蛋白测定(BCA 法)试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒、兔抗大鼠核因子E2 相 关 因 子 2(nuclear factor E2-related factor 2,Nrf2)抗体和兔抗大鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购于碧云天生物技术研究所;兔抗大鼠血红素加氧酶 1(heme oxygenase-1,HO-1)抗体购于 Santa Cruz;总超氧化物岐化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)试剂盒购于南京建成生物工程研究所;Alexa FlourTM488 goat anti-rabbit IgG(H+L)购自Life Technologies;4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)试剂购于索莱宝科技有限公司。
悬尾实验(tail suspension test,TST)分析系统和强迫游泳实验(forced swimming test,FST)分析系统(上海软隆科技发展有限公司);Gen5 酶标仪(BioTek);倒置荧光显微镜(ZEISS);FluorChem-E 化学发光成像系统(ProteinSimple);高电流电泳仪(Bio-Rad):FACSCalibur流式细胞仪(BD)。
4 主要方法
4.1 动物模型的建立、分组、给药方法 取雄性健康SD 大鼠,适应性饲养1 周后,随机分为正常对照(control)组、酒精戒断模型(model)组、低剂量Sau 治疗(low-sau)组和高剂量Sau 治疗(high-Sau)组,每组8 只。除正常对照组外,其余各组每日1 次腹腔注射酒精3 g/kg,正常对照组给予等体积的生理盐水代替酒精,连续28 d 后停止酒精注射,戒断3 d 制作酒精戒断大鼠模型[9]。在戒断 3 d 期间,Sau 低剂量治疗组(5 mg/kg)和高剂量治疗组(25 mg/kg)分别每日灌胃1 次[10],正常对照组和模型组灌胃生理盐水。末次给药30 min 后,利用蔗糖偏好实验(sucrose preference test,SPT)、TST 和FST 进行行为学检测,观察各组大鼠行为学变化。
4.2 SPT 主要用于评价实验动物快感缺失的程度判断其抑郁行为。实验时,各大鼠按照1笼1鼠单独饲养。每只鼠笼放置2 瓶1%蔗糖溶液,使其自由摄取。24 h后用相同规格纯净水置换其中1瓶蔗糖,再次自由摄取24 h 后,所有动物停止进食进水并持续24 h。随后,每个笼子提供1瓶预量体积的纯净水和1 瓶预量体积的1%蔗糖溶液,大鼠自由摄取1 h 后,取走两瓶并分别测定体积,计算每只大鼠的蔗糖偏好率[11]。蔗糖偏好率(%)=蔗糖饮用体积(mL)[/蔗糖饮用体积(mL)+纯水饮用体积(mL)]×100%。
4.3 TST 主要以动物在无可回避的压迫环境中产生绝望的不动状态来评估动物的抑郁样行为。将各组大鼠先放入安静且光线柔和稳定的操作间内适应1 h。悬尾检测装置放置于相同环境操作间内,安装好摄像头并连接电脑。将大鼠尾部距末端约2 cm处用胶带固定,倒挂于装置悬挂杆上,头距箱底部约30 cm,两侧用挡板隔开动物视线,底部放置用于收集粪便和尿液的可拆卸托盘,开始计时和录像。分析5 min 内各大鼠的不动状态的总时间。以大鼠放弃挣扎,呈不动状态记作不动[12]。每只大鼠仅测试一次,且每测试完一次都要进行排泄物和气味的清除,以避免影响下次测试结果。
4.4 FST 以动物在局限压迫环境中放弃挣扎的不动状态来评价抑郁样行为。于实验操作间内安置好各仪器设备并连接电脑,大鼠适应环境1 h后开始实验。将大鼠放入一水深40 cm的透明圆柱缸内(直径30 cm,高60 cm),水温(24±1)℃。该实验分为适应阶段(2 min)和测试阶段(5 min)两个部分,记录测试阶段大鼠不动时间。以大鼠不挣扎,呈漂浮状态,可仅头部在水面运动,后肢轻微摆动记作为不动[13]。每只大鼠测试完毕后均要清洗玻璃圆桶并更换同样温度的水,避免干扰下次实验。每只大鼠仅测试一次,每次测试完毕后需将大鼠擦干保暖后再放回原笼中。
4.5 氧化应激相关指标的检测 上述行为学测试结束后,将大鼠进行安乐死,迅速剥离海马组织并称重,按10%的配制比例于生理盐水中充分匀浆,850×g离心10 min,将海马组织匀浆上清液冻存于-80 ℃超低温冰箱中备用。然后按试剂盒操作说明分别检测海马组织中T-SOD、MDA、CAT和GSH水平。
4.6 Western blot 检测蛋白 将收集的海马组织匀浆上清用BCA 试剂盒进行蛋白定量,经SDS-PAGE分离并转移到PVDF 膜上,5%脱脂牛奶封闭1.5 h,分别加入特异性Ⅰ抗4 ℃反应24 h,再加入Ⅱ抗孵育2 h 后,用增强化学发光剂(enhanced chemiluminescence,ECL)显色。用AlphaView SA 3.4进行灰度值分析,用GAPDH作为内参照。
4.7 MTT 法检测细胞活力 HT22 细胞传代培养稳定后,在96 孔板每孔接种100 μL(2×103个)细胞,加入不同浓度(50、100、200、400、700 和1 000 μmol/L)的 H2O2培养 24 h,加入不同浓度(3、10、30 和 60 μmol/L)的 Sau 培养 24 h,每组设 3 个复孔。然后加入 MTT 孵育 4 h 以形成甲臜结晶,加入 100 μL 甲臜溶解液继续孵育4 h 结晶完全溶解后,用酶标仪于570 nm 处测定吸光度(A)值并计算各组的细胞存活率,确定最佳H2O2浓度和Sau干预浓度。
4.8 HT22 细胞分组、给药以及氧化应激指标的检测 细胞分为正常对照组(control 组)、模型组(H2O2组)、低剂量Sau 治疗组(low-Sau 组)和高剂量Sau 治疗组(high-Sau 组)。低、高剂量Sau 治疗组细胞分别予以 3 和 30 μmol/L Sau 预处理孵育 2 h,除了正常对照组外其他组以最佳浓度的H2O2处理后继续培养24 h。然后将细胞洗涤3次,加入100 μL生理盐水匀浆,600×g离心10 min,取上清按试剂盒操作说明用酶标仪进行检测。
4.9 流式细胞术检测细胞凋亡 用H2O2诱导细胞氧化应激模型后,按试剂盒说明要求,离心收集细胞,用PBS 重悬计数5 万个细胞,先后加入Annexin V-FITC 和碘化丙啶(propidium iodide,PI),室温避光孵育20 min,1 h 内利用流式细胞仪检测细胞凋亡情况。
4.10 免疫荧光实验 将HT22 细胞爬片到经组织培养物处理的圆形玻片上,分为正常对照组(control组)、模型组(H2O2组)和高剂量Sau治疗组(high-Sau+H2O2组)。H2O2诱导建模处理后经10%中性甲醛固定,5%BSA 封闭爬片,加入Nrf2 Ⅰ抗4 ℃孵育过夜,Alexa FlourTM488 goat anti-rabbit IgG Ⅱ抗37 ℃孵育1 h,DAPI 核染色10 min,抗荧光淬灭剂封片后用倒置荧光显微镜观察。
5 统计学处理
用GraphPad Prism 7.0 统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差(one-way ANOVA)分析,组间两两比较采用Newman-Keuls 法进行检验。以P<0.05为差异有统计学意义。
结 果
1 Sau对酒精戒断大鼠抑郁样行为的影响
如表1 可知,蔗糖偏好实验中,模型组大鼠蔗糖偏好率显著低于正常对照组(P<0.01),与模型组比较,低剂量治疗组和高剂量治疗组蔗糖偏好率显著升高(P<0.05 或P<0.01);悬尾和强迫游泳实验中,与正常对照组比较,模型组大鼠不动时间均显著升高(P<0.01),与模型组比较,低剂量治疗组和高剂量治疗组的不动时间均显著降低(P<0.05或P<0.01),强迫游泳实验中高剂量治疗组不动时间显著低于低剂量治疗组(P<0.01),且有剂量依赖性。

表1 Sau对酒精戒断大鼠行为的影响Table 1. Effects of sauchinone(Sau)on the behaviors of alcohol withdrawal rats(Mean±SD. n=8)
2 Sau对酒精戒断大鼠的大脑海马组织中氧化应激水平的影响
如表2 所示,与正常对照组比较,模型组大鼠TSOD、CAT 和 GSH 水平均显著降低(P<0.01),而MDA 水平显著升高(P<0.01);与模型组比较,低剂量治疗组和高剂量治疗组T-SOD、CAT 和GSH 水平均显著升高(P<0.05,P<0.01),MDA 水平显著降低(P<0.05,P<0.01);其中高剂量治疗组CAT 水平显著高于低剂量治疗组(P<0.05),且有剂量依赖性。

表2 Sau对酒精戒断大鼠海马氧化应激水平的影响Table 2. Effects of sauchinone(Sau)on the level of oxidative stress in the hippocampus of alcohol withdrawal rats(Mean±SD. n=8)
3 Sau对酒精戒断大鼠海马组织中Nrf2和HO-1蛋白表达的影响
如图1所示,模型组大鼠海马组织中Nrf2和HO-1蛋白表达显著低于正常对照组(P<0.01);与模型组比较,低剂量Sau 治疗组和高剂量Sau 治疗组大鼠海马组织中Nrf2和HO-1蛋白表达显著升高(P<0.05或P<0.01)。
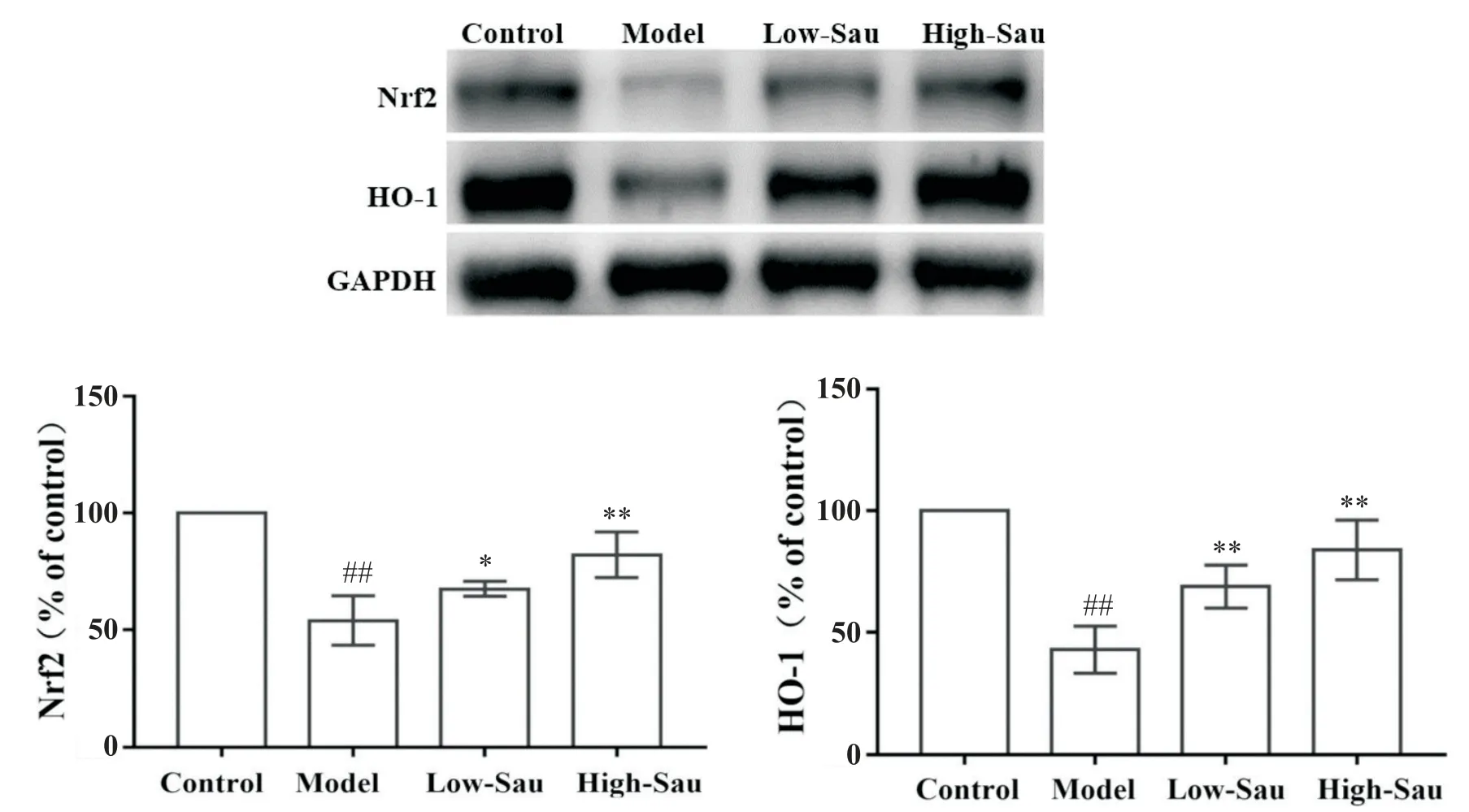
Figure 1. Effects of sauchinone(Sau)on the protein expression of Nrf2 and HO-1 in the hippocampus of alcohol withdrawal rats.Mean±SD. n=8.##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group.图1 Sau对酒精戒断大鼠海马组织Nrf2和HO-1表达的影响
4 Sau对H2O2诱导的HT22细胞活力的影响
如图2 所示,H2O2和Sau 单独处理后观察对细胞活力的影响,选择H2O2最佳处理浓度为200 μmol/L,Sau 预处理浓度分别为低剂量组3 μmol/L 和高剂量组为30 μmol/L。后续实验结果显示,与正常对照组比较,H2O2模型组细胞活力显著降低(P<0.01);与模型组比较,低剂量Sau 组和高剂量Sau 组HT22 细胞的活力均显著升高(P<0.05或P<0.01)。
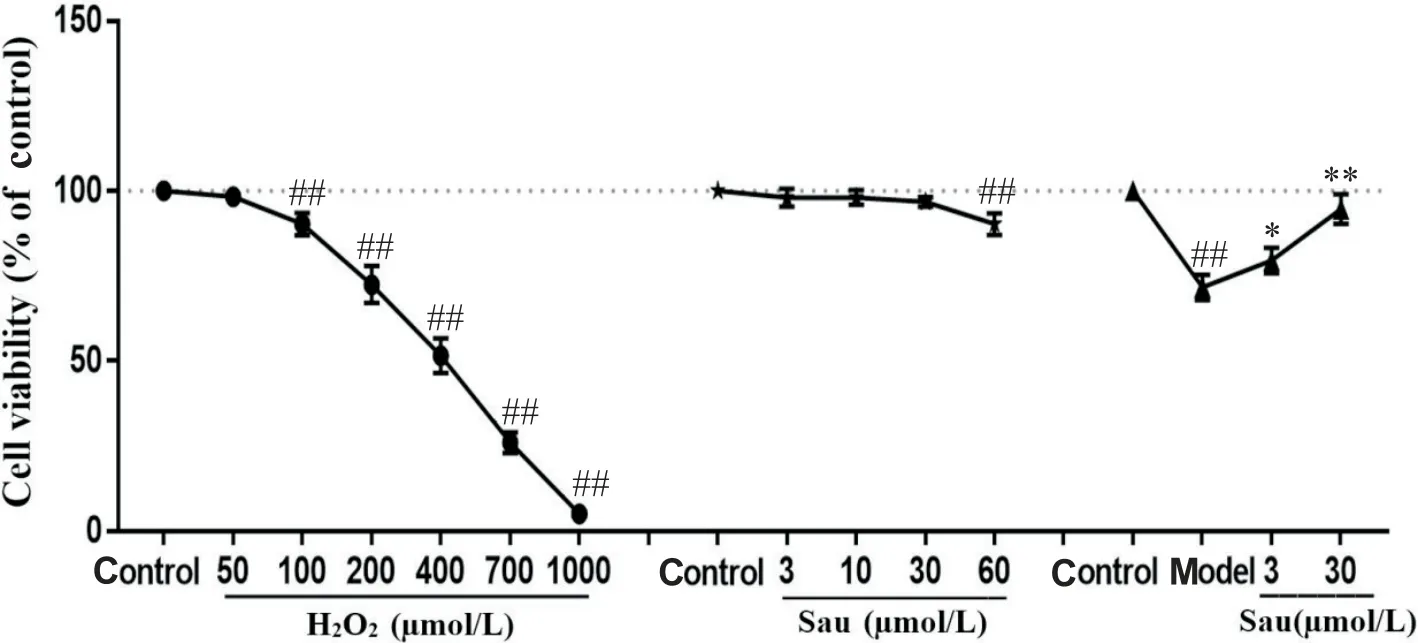
Figure 2. Effects of sauchinone(Sau)on the viability of H2O2-induced HT22 cells. Mean±SD. n=3.##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group.图2 Sau对H2O2诱导的HT22细胞活力的影响
5 Sau对H2O2诱导的HT22细胞凋亡水平的影响
如图3 所示,与正常对照组比较,模型组细胞凋亡率显著升高(P<0.01);与模型组比较,低剂量Sau组和高剂量Sau 组细胞凋亡率均显著降低(P<0.05或P<0.01)。

Figure 3. Effects of sauchinone(Sau)on the apoptosis of H2O2-induced HT22 cells. Mean±SD. n=3.##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group.图3 Sau对H2O2诱导的HT22细胞凋亡水平的影响
6 Sau 对H2O2诱导的HT22 细胞氧化应激水平的影响
如表3 所示,与正常对照组比较,模型组T-SOD水平显著降低(P<0.01),MDA 水平显著升高(P<0.01),与模型组比较,Sau低剂量组和高剂量组细胞内T-SOD 水平显著升高(P<0.05,P<0. 01),MDA 水平显著降低(P<0.05,P<0.01)。
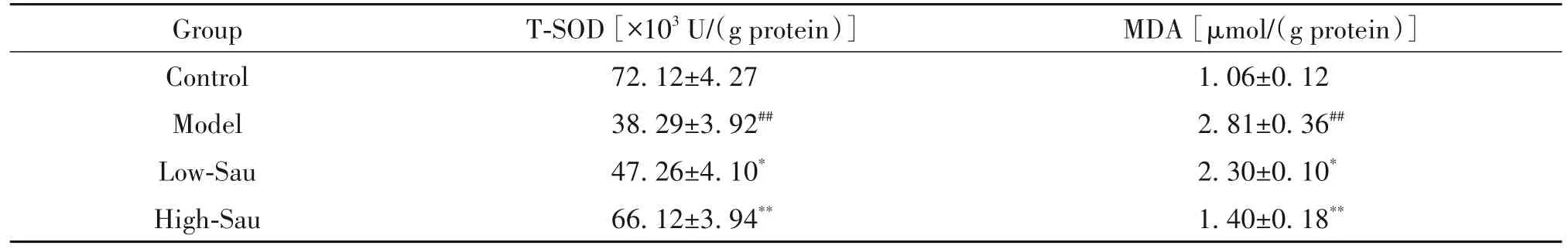
表3 Sau对H2O2诱导的HT22细胞氧化应激水平的影响Table 3. Effects of sauchinone(Sau)on the level of oxidative stress in H2O2-induced HT22 cells(Mean±SD. n=8)
7 Sau 对 H2O2 诱 导 的 HT22 细 胞 中 Nrf2 表 达 的影响
如图4 所示,正常对照组中,Nrf2 主要存在于胞质内,胞核中表达极少,而模型组细胞的胞核中Nrf2的表达量显著高于正常对照组(P<0.01),与模型组比较,Sau高剂量组细胞核中的Nrf2的表达显著降低(P<0.01)。
讨 论
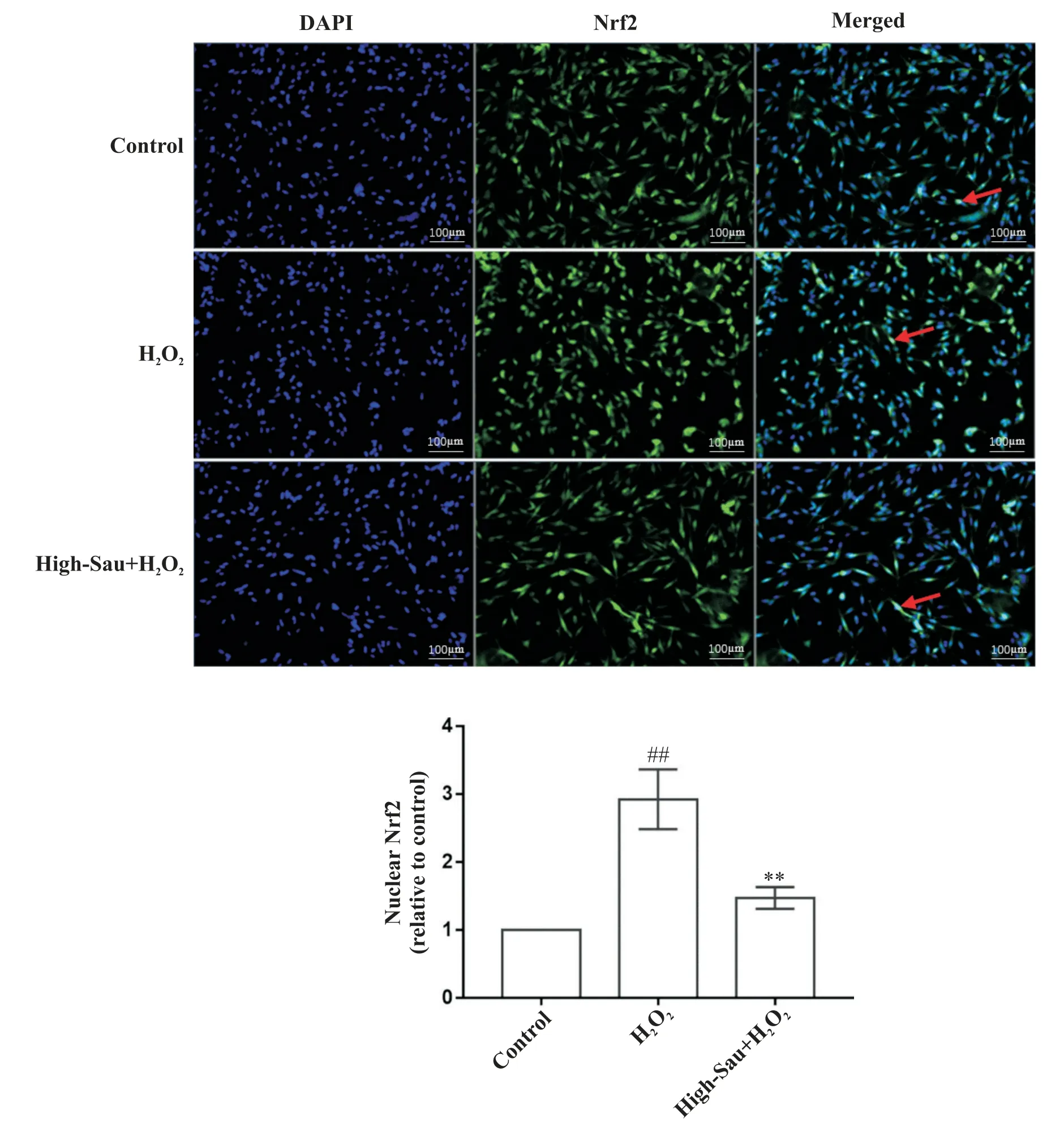
Figure 4. Effects of sauchinone(Sau)on the expression of Nrf2 in H2O2-induced HT22 cells. Red arrow:Nrf2 expressed in nuclei.Scale bar=100 μm. Mean±SD. n=3.##P<0.01 vs control group;**P<0.01 vs model group.图4 Sau对H2O2诱导的HT22细胞中Nrf2表达的影响
长期大量的饮酒会引起酒精依赖同时戒断会导致睡眠困难、焦虑和抑郁等精神症状,其发病率逐年增加,给社会和个人的生活带来严重的危害[14]。啮齿类动物天生对甜食有强烈的欲望,通过对蔗糖偏好测试能衡量动物的享乐状态或者感受快乐的能力,这是判断抑郁的基本特征之一。同时,悬尾实验和强迫游泳实验是通过动物的求生欲望与行为的绝望程度评价抑郁样行为的研究方法[15-16]。本实验行为学检测结果显示,模型组大鼠的蔗糖偏好率显著低于正常对照组,这表明酒精戒断后大鼠对蔗糖快感显著降低,TST 和FST 中不动时间显著增加,证明成功诱导典型的酒精戒断抑郁大鼠模型。同时研究观察到低、高剂量Sau治疗均有效减少酒精戒断大鼠的抑郁样行为。应激反应会导致情感的变化,有研究表明,海马具有处理、记录和储存分析记忆的功能,是压力反应和情绪的关键调节器,海马的氧化应激水平对焦虑和抑郁有重要的调节作用[17-18]。活性氧(reactive oxygen species,ROS)水平的增加会对细胞造成一系列氧化应激损伤。T-SOD 和CAT 等抗氧化酶在氧化应激中处于一线防御机制,T-SOD 能清除超氧阴离子而对细胞起到保护作用,而MDA 升高是氧化应激时细胞损伤的一个典型指标[19-20]。CAT是机体内的一种末端氧化酶,能清除细胞代谢过程中产生的H2O2,从而保护细胞免受伤害。而GSH 是一种抗氧化剂,它能防止由活性氧物质导致的细胞组分损害。本实验结果显示,酒精戒断能显著降低海马组织中 T-SOD、CAT 和 GSH 水平,增加 MDA 水平,这表明酒精戒断破坏体内氧化与抗氧化的内环境稳态诱导海马氧化应激的产生,而Sau干预后上述氧化应激指标具有良好的改善作用。因此分析行为学和氧化应激的结果显示,酒精戒断大鼠产生抑郁样行为的主要原因是海马组织的氧化应激所致,而在戒断期间给与Sau不仅能纠正氧化应激水平,也能改善大鼠的抑郁样行为。同时在细胞实验中通过凋亡和氧化应激水平的检测也得到一致的结果。
多数学者关注抑郁症的发病机制及其治疗的研究,其中认为氧化应激对神经细胞的凋亡和损伤作用是常见的机制之一。长期的酒精依赖或戒断导致持续的氧化应激状态,会产生过多的ROS,最终使体内氧化与抗氧化调节失衡,导致神经细胞的凋亡或损伤。在此过程中Nrf2 发挥关键的调节作用。Nrf2是一种新型的核转录因子,能维持体内氧化与抗氧化系统的平衡[21]。文献表明,Nrf2 常定位于胞质中,与伴侣蛋白 Kelch-like ECH 相关蛋白 1(Keap1)相连,当使Nrf2 从Keap1 解离时,它便移位到细胞核,与靶基因上的抗氧化反应元件(antioxident responseelement,ARE)结合激活抗氧化防御系统[22-23]。在氧化应激状态时,ROS 能促进Nrf2 进入细胞核内与ARE 结合,上调HO-1的表达发挥细胞的自我保护作用。很多研究表明小鼠Nrf2基因敲除后活性氧及氧化应激水平显著升高[24]。HO-1 是受 Nrf2 调节的主要酶,其启动子上含有较强的ARE,可以通过多种方式发挥很强的抗氧化作用。因此认为调控Nrf2 和HO-1 可以作为酒精戒断大鼠抑郁样行为的新的靶点[25-28]。本研究显示,酒精戒断大鼠海马组织中Nrf2和HO-1 的相对表达量显著降低,而Sau 的干预增加其表达最终减少大鼠的抑郁样行为。同时利用体外实验也表明,氧化应激时凋亡率显著增高且细胞核内Nrf2的高表达失去氧化与抗氧化的相对平衡导致细胞的自我保护机制紊乱。以上结果证明Sau 能缓解体内氧化应激水平而改善大鼠的抑郁样行为,其作用机制涉及Nrf2/HO-1信号通路。
近年来,中草药及其提取物广泛应用于各种情绪障碍相关的精神疾病的治疗,与常用的苯二氮卓类药物比较表现出副作用少疗效好的独特优越性,在各种原因所致焦虑和抑郁症的治疗中显得非常重要。Sau 是从传统中草药三白草中提取的单体类化合物,具有清热解毒、消肿利尿和抗炎之功效,通过抗炎和抗氧化等机制对肿瘤、肝炎、神经退行性病变、急性肺损伤、气道变应性疾病及细菌感染等具有良好的治疗作用,尤其对神经细胞的抗氧化作用及其保护作用备受关注。本实验采用动物与细胞实验相结合的方式,探讨Sau对酒精戒断大鼠抑郁样行为的改善作用及其机制。在动物实验中显示Sau 干预后,行为学和氧化应激指标显著改善,显著上调海马组织中Nrf2 及其抗氧化基因产物HO-1 的水平。在体外的实验中也观察到Sau 能够显著改善氧化应激所致HT22 细胞凋亡以及细胞内氧化应激水平,Nrf2从Keap1 解离后于胞质向胞核内的显著转位参与了该机制。
综上所述,本研究发现Sau对酒精戒断大鼠抑郁样行为具有显著的改善作用,其主要机制可能通过Nrf2/HO-1 信号通路的调控,调节大脑海马组织的氧化应激水平介导对神经细胞的保护作用。同时为临床上抗抑郁药物的研发提供基础实验依据。但由于针对Sau在该疾病作用机制研究报道的缺乏,且大脑各区域作用效应交错复杂,系统给药在药物作用靶点定位上又具有一定的局限性,我们暂时还无法提供更为全面的数据,后续我们将在本研究基础上,采用大脑定位埋管微量注射和药物示踪等方法,从大脑各区域及各通路做进一步探索,为该类药物的研发提供更为深入而可靠的基础实验证据。

