植物氮磷营养的长距离信号转导
王晓甜,王 威,陈嘉俊,储成才
(亚热带农业生物资源保护与利用国家重点实验室/岭南现代农业科学与技术广东省实验室/华南农业大学 农学院, 广东 广州 510642)
植物通常需要从土壤中吸收大量矿质营养元素维持其正常生长发育进程,并完成生活周期。在自然土壤中,多数矿质元素的浓度偏低,种类和浓度分布是不均匀和不连续的,且在水平和垂直尺度上均存在差异。植物作为固着生物,在其生活周期中通常需要应对复杂多变的土壤环境。在长期进化过程中,植物发展出复杂的机制来应对土壤环境变化,从而达到自身最优化生长和繁衍后代的目的。具体而言,就是植物体内存在一个稳健的营养信号调控网络,使其在异质的土壤环境中调控并维持植物自身生长。尤其在营养胁迫条件下,这个信号网络能够保证多种营养元素的协同利用和植物的适应性生长。
植物营养信号网络的一个重要组成部分是局部营养信号,即根系对其周围养分有效性的局部感知。过去20年间,采用遗传学等多种手段已经鉴定到氮、磷、铁等营养元素受体,例如硝酸盐信号的受体CHL1/AtNRT1.1/AtNPF6.3 (Chlorate sensitive 1/Nitrate transporter 1.1/NRT1/PTR family 6.3)[1],磷信号的受体SPXs (SYG/ PHO81/XPR1)[2-4],以及最近鉴定到的铁离子受体IRT1 (Iron transporter 1)等[5],并发现了相应元素的局部信号转导网络。营养信号调控网络另一更为重要的组成部分则是长距离营养信号(或系统性营养信号),即植物远端器官进行养分感知信息的长距离通信。这类信号参与调控局部营养信号由根向地上部的传递,根系养分吸收、转运和重新分配,以及植物在整体水平上的反馈。事实上,在自然状态下,植物所面对的土壤环境比试验条件更加复杂多变,也进一步增加了对植物系统性营养信号调控网络认知的复杂度和难度。随着表型组学和高通量分析技术的进步,植物营养长距离信号研究已经转向多养分交互(或整合)调控,并揭示多营养调控网络才是植物应对自然环境变化的常态。
氮和磷是植物需求量最大的矿质营养元素,是许多生物大分子的组成成分,也是决定农作物生物量和产量的关键要素。近年来,在氮磷营养的长距离信号研究领域取得诸多进展,鉴定到多个长距离信号分子,并构建了相应的调控网络。本文将概述参与氮磷营养吸收利用过程的长距离信号分子及其相关信号转导机制,以及光对氮、磷长距离信号转导的影响,并对长距离信号未来研究进行了展望。
1 氮营养的长距离信号
硝态氮(NO3-)和铵态氮(NH4+)是土壤中无机氮源的主要形式,在陆地土壤中,硝酸盐是多数植物获取氮源的主要形式[6]。在硝酸盐分布均一的环境中,高浓度硝酸盐(高硝)抑制主根伸长和侧根发生,而低浓度硝酸盐(低硝)则促进主根伸长和侧根发生[7]。在硝酸盐分布不均的自然环境下,植物根系通常表现出向营养性,即朝着高硝区域生长,同时产生大量侧根来扩大根系与土壤接触面积;而低硝区域根系侧根伸长则被抑制。根系的氮营养向性反应则会在去除顶芽后消失,提示植物地上部分对根系的可塑性调控具有重要作用[8-9],亦即植物存在长距离营养信号系统调节植物根系的可塑性。
1.1 小肽介导的系统性信号调控植物整体的氮吸收利用
分根试验表明,低硝不仅能促进高硝侧的植物侧根增多,还能通过诱导高硝侧根系中NRT2.1的表达来促进高硝侧根系对外界NO3-的吸收[9]。进一步研究发现,低硝会诱导根系产生15个氨基酸的小肽CEPs (C-terminally encoded peptides),并通过木质部长距离运输至地上部,而后被LRR受体激酶CEPR1 (CEP receptor 1)识别,CEP-CEPR信号增强并诱导合成CEPD1和CEPD2 (CEP-downstream 1和2),它们通过韧皮部由地上部长距离运输至高硝一侧的根系中,诱导NRT2.1基因的表达,提高根系吸收硝酸盐的效率[10-11](图1)。除调控硝酸盐吸收相关基因转录外,CEP-CEPR信号通路还可抑制生长素由地上部向根的转运,进而调控根系构型和侧根夹角,增大根系面积[12]。同时,低硝通过诱导CLE (CLAVATA3/EMBRYO-surrounding region related)小肽家族的基因CLE1/3/4/7的转录,抑制侧根原基生长。组织定位分析表明,CLE1/3/4/7可能由中柱细胞分泌,并被转运至韧皮部伴胞细胞中,从而被定位于韧皮部的受体蛋白C L V 1(CLAVATA1)识别后,产生系统性氮信号,负调控根系发育[13]。
植物不仅能通过根感知外界土壤中的氮营养状态,也能通过地上部感知整体氮营养状态并产生长距离信号调控根系对氮的吸收利用。植物地上部缺氮会诱导叶片产生C E P D 1/2的同源蛋白CEPDL2 (CEPD-like 2),CEPDL2通过韧皮部长距离运输迁移到根中,促进硝酸盐转运相关基因NRT2.1、NRT1.5、NRT2.2、NRT2.4和NRT3.1的转录,提高根系氮吸收能力,从而实现植株整体发育的协调(图1)[14]。因此,小肽在协调植物整体氮吸收和利用中发挥重要作用。

图1 植物长距离氮信号Fig. 1 Long-distance N signaling in plants
1.2 小肽介导的系统性信号调控豆科植物结瘤固氮
豆科植物根系不仅可以通过吸收土壤中的硝酸盐和铵盐获取氮素,还可通过与根瘤菌共生进行生物固氮。然而,共生固氮高度耗能,豆科植物会根据外界氮源供应情况调控结瘤,即在缺氮环境中,豆科植物通过消耗碳源形成根瘤进行生物固氮;在氮充足的环境中,过度结瘤会损失碳源,抑制宿主生长,因此,豆科植物启动根瘤自主调控系统(Autoregulation of nodulation,AON),抑制根瘤形成,避免宿主植物过度结瘤而浪费碳源[15]。研究表明,一些miRNA (microRNA)、小肽和蛋白质等信号分子参与了由硝酸盐介导的根系结瘤过程。
低硝会诱导蒺藜苜蓿、百脉根和大豆等豆科植物根系产生CEP1小肽,并通过木质部长距离转移到地上部与受体CRA2 (Compact root architecture 2)结合,促进miR2111前体转录,此后miR2111通过韧皮部长距离运输至根部直接抑制结瘤负调控因子E3泛素连接酶基因TML(Too much love)表达,促进结瘤[16-18]。在高硝条件下,根瘤菌侵染豆科植物后会诱导CLEs基因的表达,CLEs通过木质部长距离转运至地上部,从而激活AON途径并抑制结瘤[19]。在高硝条件下,百脉根中NIN (Nodule inception)转录因子会促进根中CLE-RS1/2 (CLE root signal 1/2)小肽合成,而后经木质部长距离运输至地上部与受体激酶LjHAR1 (Hypernodulation and aberrant root 1)结合,进而抑制根瘤形成[20-22]。研究表明,CLE-RS1/2-LjHAR1复合体可能通过以下2个途径影响结瘤:一方面抑制叶片中miR2111合成,导致由地上部转运到根中的miR2111减少,从而减弱对TML基因的转录水平抑制,阻碍根瘤菌侵染[8,23];另一方面,CLE-RS1/2-LjHAR1复合体可能通过激活细胞分裂素合成基因I P T 3(Isopentenyltransferase 3)的表达促进细胞分裂素(Cytokinin,CK)合成,细胞分裂素转运至根部抑制结瘤。但是,细胞分裂素抑制结瘤的分子机制仍不清楚[24]。同样,在蒺藜苜蓿中,高硝促使NIN-like家族成员MtNLP1激活MtCLE35的转录,翻译产生的MtCLE35被转运至地上部与MtSUNN (Super numeric nodules)受体蛋白结合,通过抑制miR2111表达影响根系结瘤(图1)[25]。综上所述,高氮通过NIN-CLE-AON途径抑制结瘤在多数豆科植物中是保守的[19]。
1.3 细胞分裂素介导的长距离氮信号调控植物生长发育
充足的硝酸盐能促进植物地上部的快速生长,然而根中的氮信号传递至地上部分并促进地上部生长发育的分子机制并不清楚。研究发现,硝酸盐处理后,木质部中细胞分裂素前体tZR (tZriboside)浓度升高,暗示在根部硝酸盐信号可能会转换成细胞分裂素信号[26-27]。进一步研究发现,硝酸盐可以诱导拟南芥细胞分裂素合成基因IPT3的表达[28],导致根系中细胞分裂素前体tZR和有活性的细胞分裂素tZ增加[27],而后tZR和tZ通过ABC类转运蛋白AtABCG14长距离运输至地上部分调控生长发育[29-30]。被转运至地上部的细胞分裂素可在不同的部位发挥功能:tZ主要调控叶片大小,而tZR通过影响WUSCHEL(WUS)和CLAVATA3(CLV3)的表达调控茎尖分生组织(Shoot apical meristem,SAM)的活性,进而调控植物地上部分的发育(图1)[31-33]。此外,细胞分裂素到达地上部分后,会促进地上部谷氨酸和谷氨酰胺合成,这些氨基酸可能作为系统性信号从地上部分转移到根调控硝酸盐的吸收[34]。
在水稻中,硝酸盐和铵盐的代谢产物是谷氨酰胺,硝酸盐、铵盐和谷氨酰胺均能诱导根中OsIPT4、OsIPT5、OsIPT7和OsIPT8的表达,但谷氨酰胺合成酶抑制剂L-蛋氨酸亚砜酰亚胺(L-methionine sulfoximine)处理则能阻断硝酸盐和铵盐对OsIPTs的诱导,说明是谷氨酰胺直接诱导根中OsIPTs的表达。研究还发现,OsIPT4是根中细胞分裂素合成的主要基因,其RNAi株系的木质部细胞分裂素含量减少,地上部各器官表现缺氮表型[35]。上述结果表明在单双子叶植物中,细胞分裂素介导的长距离氮信号是高度保守的。
1.4 光信号及光合产物对长距离氮信号的影响
植物对许多矿质元素的吸收都受到光信号和光合产物的影响[36],光合产物能够促进侧根生长,并诱导硝酸盐转运蛋白基因的表达促进硝酸盐吸收[19]。进一步研究发现,光合代谢产物蔗糖可以诱导多个AtCEP基因(AtCEP5~AtCEP9)的表达,AtCEPs被AtCEPR1识别并通过未知的机制限制侧根生长,并且这个过程需要依赖于AtCEPR1蛋白活性[37-38],上述结果表明,在拟南芥中CEPCEPR1模块能够整合碳信号和氮信号并作为负反馈环调控根系的适度生长。最新鉴定到植物感知光合产物匮乏调控硝态氮响应的关键组分 SnRK1(SNF1-related kinase 1)。SnRK1是一个保守的能量感受器,其催化亚基KIN10突变抑制了由光合产物匮乏所致的硝酸盐应答反应,暗示KIN10是光合作用与硝酸盐信号交互调控的重要枢纽。进一步研究发现,光合产物匮乏促使KIN10磷酸化NLP7并使其滞留在细胞质中被降解,进而抑制下游的硝酸盐应答反应[39]。但KIN10如何感知光合产物匮乏并使NLP7降解的机制并不清楚,光合产物如何调控氮吸收利用相关基因表达的分子机制仍然未知。
在拟南芥中,光信号通路中的核心转录因子HY5 (Elongated hypocotyl 5)是碱性亮氨酸家族成员,能接收来自不同的光感受器捕获的光信号,包括光敏色素(Phytochromes, PHYs)、隐花色素(Cryptochrome 1, CRYs)、紫外线 B (Ultraviolet-B,UV-B),并将信号传递给下游信号元件,进而调控光形态建成、根系发育、非生物胁迫响应、养分吸收等植物生长发育过程[40-41]。研究发现,HY5蛋白作为一个长距离信号分子还参与植物地上部和根系间的远程交流,协调生长发育和碳/氮平衡。拟南芥HY5在地上部促进TPS1、SWEETs等基因的表达,增强了碳同化和碳转运,并在光的作用下通过韧皮部转移到根,激活根中HY5和NRT2.1的转录,调节根的生长和硝酸盐的吸收(图1)。因此,HY5作为一个长距离信号分子协调了受光响应的碳固定和氮吸收,使植物地上部和根实现协同生长[42]。
2 长距离信号分子调控磷稳态
磷也是植物生长必需的大量营养元素,磷酸盐和偏磷酸盐是植物吸收磷的主要形式。土壤中总磷含量较高,但大部分被土壤固定而不能被植物直接吸收,因此能被植物吸收利用的无机磷(有效磷)含量较低[43]。在均质磷环境下,低磷抑制主根生长,促进侧根生长和根毛伸长,使根系充分吸收多数储藏在表层的磷酸盐[44]。然而磷在土壤中的分布是不均匀的,研究发现,局部根系生长主要受其周围磷酸盐浓度的影响,而系统性磷信号主要调节磷吸收和磷代谢相关基因的表达[45]。因此,长距离信号在调控植物磷稳态方面发挥重要作用, miRNAs、mRNA以及植物激素独角金内酯(Strigolactones, SLs)等系统性信号分子参与调控植物磷稳态。
2.1 miRNA参与调控植物整体磷稳态
越来越多的研究证明,miRNAs可以作为系统性信号参与调控相关生物学过程[46-50]。miR399是首个鉴定到的系统性调节磷饥饿信号miRNA。利用miRNA测序技术对低磷条件下的拟南芥和油菜等植物伤流液测序发现,miR399在韧皮部中大量积累,暗示miR399可能是一个长距离运输的调控因子。miR399f过表达株系与野生型的嫁接试验进一步证明了miR399在韧皮部中具有长距离移动能力[51-52]。但是miR399的转运不是可逆的, 即不能从miR399过表达植株砧木转运至野生型接穗中[53-54]。miR399从接穗移动到砧木后,通过抑制砧木中E2泛素连接酶基因PHO2(PHOSPHATE 2)的表达,进而解除PHO2对磷转运蛋白PHT1 (Phosphate transporter 1)和PHO1 (Phosphate 1)的抑制,促进磷的吸收转运(图2)。其他物种中miR399和PHO2的同源基因也陆续被鉴定,且功能相对保守[55-56],说明低磷诱导miR399从地上部转移到根部,通过影响根部磷信号途径促进磷的吸收在不同物种中是相对保守的。此外,利用黄瓜/西瓜嫁接体系进行短期磷胁迫诱导的转录组分析发现,维管系统是最早感受到植物磷胁迫并产生响应的组织,除CmmiR399外,还鉴定到CsmiR408h、CsmiR172q等6个新的CsmiRNAs受到低磷诱导,但这些miRNAs的具体功能还不清楚[57]。
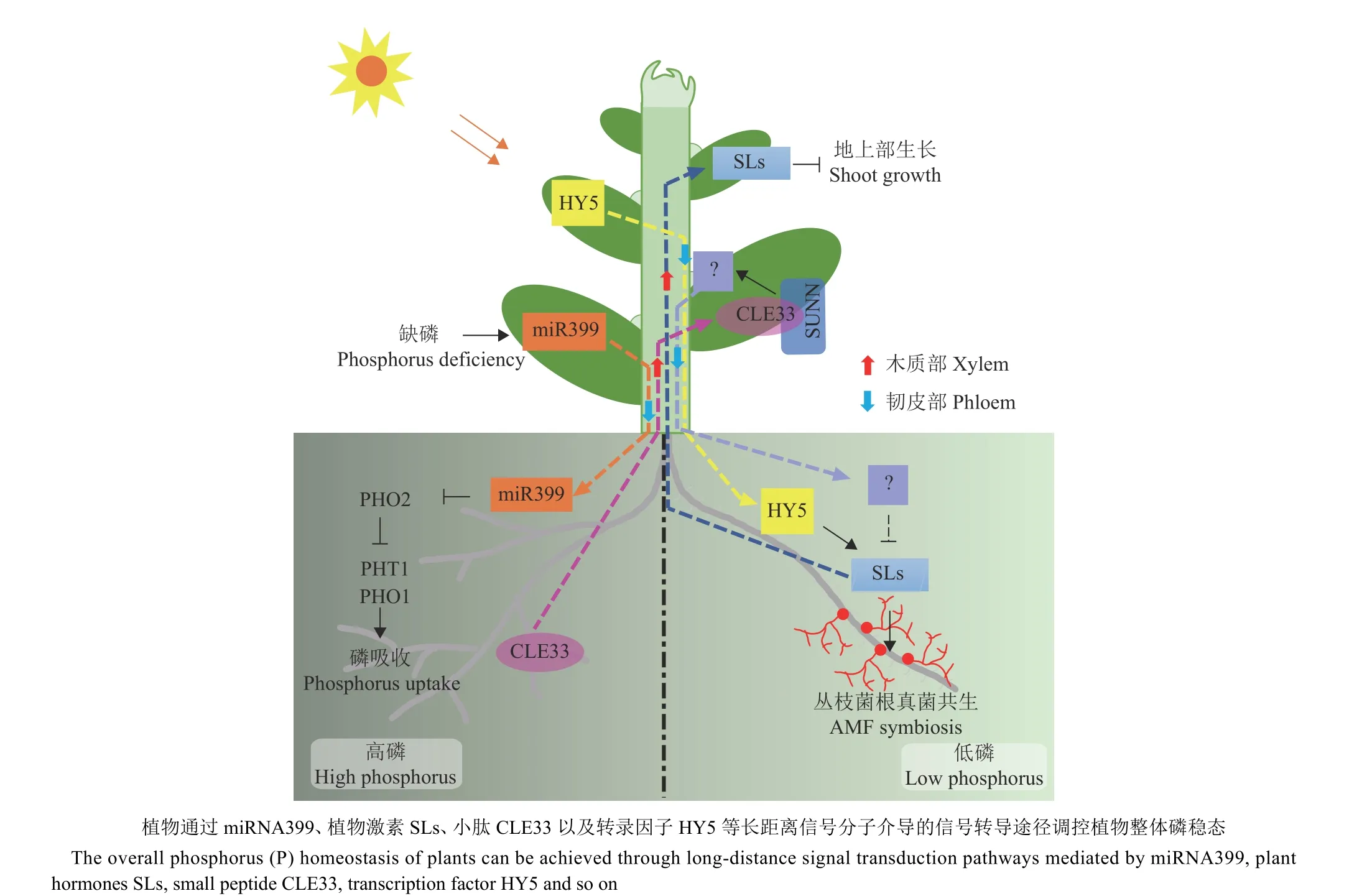
图2 植物长距离磷信号Fig. 2 Long-distance phosphorus signaling in plants
除miRNAs外,低磷胁迫还会引起韧皮部数百个mRNA的含量变化,这些 mRNA可能以核糖核蛋白复合物(Ribonucleoprotein complexes,RNPCs)的形式将低磷信号传输至靶器官,引发相应的磷胁迫应答反应,但这些mRNAs特异转运至靶器官的机制还不清楚[57-58]。研究还发现源于韧皮部的lnRNAs (Long non-coding RNAs)也可能作为非细胞自主性的信号分子参与调控植物整体磷稳态[59]。
2.2 SLs调控不同磷环境下的丛枝菌根真菌共生
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)能与超过80%的陆生植物共生,帮助植物高效吸收磷[60]。SLs是类胡萝卜素衍生出的类萜内酯,因其能促进寄生杂草独脚金属种子萌发而得名,在植物株型建成中发挥重要作用,能作为长距离信号分子抑制植物侧芽的伸长,进而抑制分枝的产生[61]。此外,SLs也是AMF共生的系统性信号,SLs促进能量代谢和菌丝分枝,激活共生信号通路[62]。与高氮影响豆科植物固氮菌共生的作用类似,低磷通过促进SLs合成促进AMF共生,而高磷则抑制共生。
在拟南芥中,低磷胁迫诱导根中SLs增加,同时木质部SLs也随之增加,地上部分枝减少;而在SLs合成突变体中,低磷并不能诱导SLs增加,提示SLs可能作为根-茎部的长距离信号调控植物发育[63-64]。进一步研究发现,高磷会诱导MtCLE33表达,其蛋白产物MtCLE33被转运至地上部后被受体MtSUNN识别,产生未知信号下调SLs合成基因的表达,减少SLs的合成并抑制AMF共生。此外,AMF共生会诱导MtCLE53表达,其蛋白产物通过与MtCLE33相同的方式抑制AMF共生(图2)[65]。这些研究揭示了植物通过感知外界磷有效性和内在共生环境2种方式精细调控菌根共生水平的分子机制。结合硝酸盐通过CLE-SUNN模块抑制结瘤,这些研究共同说明植物会根据根系养分环境并通过相对保守的途径调控固氮微生物和丛枝菌根真菌与根系的共生,但是CLE-SUNN如何调控SLs的合成,SLs又如何影响丛枝菌根的共生还不清楚。
HY5蛋白作为长距离调控因子不仅介导光信号调控的植物碳氮平衡,也影响AMF共生。在番茄中,红光诱导HY5转录因子经过韧皮部从叶片长距离转移至根部,直接激活SLs合成基因的转录,促进根部SLs的合成,从而提高AMF在番茄根系中的定植和磷的吸收(图2)[66]。在低磷胁迫下,HY5还能诱导磷饥饿响应基因PHT1.1等基因的表达并促进磷的吸收[67]。综上,HY5作为一个长距离转运的调控因子,在整合光信号与氮磷吸收方面发挥重要作用。
3 结论与展望
长距离信号在维管植物器官间信号交流中发挥重要作用,而鉴定长距离信号分子并进行相关研究通常需要依赖嫁接技术。例如,利用种间嫁接研究不同嫁接物种间小分子、蛋白质以及RNAs的生物合成和迁移;利用突变体和野生型植株(或过表达植株)植株之间的嫁接检测基因产物是否具有长距离信号功能;将目标蛋白与荧光标签蛋白融合,或将目标基因的转录本与外源序列融合,通过与野生型材料进行嫁接可用于检测目标蛋白或RNA的可移动性;不同条件处理嫁接后的植物用来揭示各种参与协调植物对环境响应的移动信号。然而,嫁接不亲和限制了该技术的大范围应用。最近研究表明,分泌到胞外区域的β-1,4-葡聚糖酶可以促进细胞壁重建,提高异种嫁接成功率,为克服种间嫁接不相容性提供了可能[68]。
植物通过整合外部养分状态和内部养分需求,产生长距离信号分子并经由维管系统运输至靶器官,进而转换为养分信号调控养分吸收利用,产生发育信号改变根系结构以及产生共生信号影响微生物与植物的共生。植物主要通过上述方式维持植物体内的营养稳态。虽然目前已经鉴定到多类信号分子,并解析了其作用机制,但仍有很多生物学问题有待解决:1)目前还无法精准判定在韧皮部移动的信号分子是来源于韧皮部还是其他器官;2)长距离信号分子进行长距离转运的共有特性(或理化特征)有哪些? 3)长距离信号分子在特定的组织装载/卸载的机制是什么? 4)单向转运和双向移动的长距离信号分子的作用机制是什么?上述问题的解决对理解植物组织器官间信号交流和植物整体协同发育具有重要意义。
此外,养分相关长距离信号分子在作物育种改良方面研究还比较欠缺。目前鉴定的多是调控根系结构和养分吸收效率的长距离信号分子,地上部分各器官养分分配及再利用相关的长距离信号分子鲜有报道。而地上部分恰恰是养分发挥生物学功能并影响经济产量的重要场所,鉴定协调地上部养分分配的长距离信号分子,对于作物育种改良具有重要意义。

