基于GC-MS和网络药理学探讨当归-肉桂药对的抗炎作用机制
曾格格,刘毅,刘天琪,黄振阳,丁晨薇
(湖北中医药大学药学院/湖北省药用植物研发中心,武汉 430065)
按照中药配伍“相须、相使、相畏、相杀、相恶、相反”的原理,体现四气五味、升降浮沉、归经等中药药性理论,药对已经成为现代中医临床常用的配伍组合[1]。中药当归(Angelica sinensisRadix)来源于伞形科植物当归(Angelica sinensis(Oliv.)Diels)的干燥根,当归甘、辛、温,归肝、心、脾经。现代药理学研究发现,当归不仅养血活血,其有效成分当归多糖、藁本内酯还具有抗炎、抗血小板凝集以及抗氧化等药理作用[2]。中药肉桂(Cinnamomi cortex)来源于樟科植物肉桂(Cinnamomum cassiaPresl)的干燥树皮。肉桂辛、甘、大热,归肾、脾、心、肝经。肉桂中所含的肉桂醛等成分具有抗菌、抗炎、抗糖尿病、抗寄生虫等药理作用。现代研究证实,当归、肉桂合用可以扩张周围血管,改善微循环,增加局部血液循环,促进炎症吸收和局部消肿作用[3]。炎症作为一种保护性免疫反应,炎症反应不足会导致病原体持续感染,而过度炎症则导致慢性或系统性炎症性疾病[4]。许多疾病的本质均为炎症反应。因此,挖掘新型抗炎药物对于解决炎症性疾病具有重要作用。在《景岳全书》《备急千金要方》等相关著作中,当归-肉桂作为药对制备出的各种复方制剂,常用于治疗月经不调、寒湿痹痛、肌肤麻木及关节不利等症[5],疗效显著,但目前关于当归-肉桂药对抗炎活性成分相关研究较为鲜见。因此,本研究采用GC-MS(气相色谱-质谱)对当归、肉桂及其药对进行比较分析,再借助网络药理学筛选出抗炎主要活性成分、关键靶点及潜在信号通路,从系统生物学角度探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 仪器手动固相微萃取(SPME型)进样装置,德国IKA公司;气相-质谱-计算机联用仪(Agilent 6890/5973型),美国Hewlett-Packard公司;顶空瓶(15 mL);65 μm聚二甲基硅氧烷-二乙烯基苯(PDMS/DVB)萃取纤维头,美国Supelco公司;电子天平(ALC-210.2型),北京赛多利斯天平有限公司。1.1.2药材当归、肉桂药材均购于湖北辰美中药有限公司,经湖北中医药大学药学院生药教研室鉴定,分别为伞形科植物当归的干燥根及樟科植物肉桂的干燥树皮。
1.1.3 药材的前处理将当归、肉桂药材分别用粉碎机打成粉末并过16目筛,取出备用。
1.2 方法
1.2.1 GC-MS色谱与质谱条件
1)GC条件。色谱条件HP-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:从50℃开始,以10℃/min升温至230℃,保留3 min;载气:高纯度He(99.999%),柱流速:0.8 mL/min,进样口温度:230℃。
2)MS条件。EI源;离子源温度230℃,电离能70 eV;四级杆温度150℃;扫描质量范围35˜ 550m/z。
1.2.2 顶空固相微萃取条件将当归-肉桂药对粗粉混合,以萃取吸附量多少、能否达到最佳萃取效果、总峰面积尽可能大作为参考要求。将样品量、萃取温度、萃取以及解析时间分别进行单因素考察。最终确定GC-MS的最佳条件:精密称取当归-肉桂药对粉末0.6 g(当归、肉桂各0.3 g),置于15 mL顶空瓶中,插入装有65 μm PDMS/DVB型萃取纤维头的手动进样器,100℃预平衡20 min,再伸出萃取头顶空萃取15 min,取出后立即插入色谱仪进样口(温度230℃),解吸3 min。
1.2.3 网络药理学研究
1)成分数据收集与获取。将当归-肉桂药对挥发性成分CAS号输入中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmspsearch.php)[6]搜索栏进行检索,获取化合物的相关靶点信息。并在Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)[7]搜索栏输入成分的CAS号,得到其分子结构,并保存为Canonical SMILES格式。将下载的SMILES格式文件导入Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)[8],选定研究物种为“Homo sapiens”,得到成分的对应靶点,整合TCMSP和Swiss Target Prediction靶点结果,删去重复的作用靶点,得到组分潜在作用靶点。
2)疾病靶点获取。搜索GeneCards数据库(https://www.genecards.org)[9]和TTD数据库(http://bidd.nus.edu.sg/group/cjttd/)[10],以inflammation为关键词进行检索,获得作用靶点,将上述数据库所获取的靶点,删除重复值后进行合并。
3)潜在作用靶点获取。使用UniProt蛋白质数据库(https://www.uniprot.org)[11]将疾病靶点与药物成分的潜在靶点统一规范为Gene Symbol,其后将化合物、疾病的靶点录入Venny 2.1.0软件(https://bioinfogp.cnb.csic.es/tools/venny/)在线作图工具平台,绘制韦恩图,得到两者交集(即共同靶标),作为潜在作用靶点。
将TCMSP和Swiss Target Prediction数据库收集的潜在作用靶点及其对应成分分别导入Cytoscape 3.7.2软件[12],构建“药物-成分-靶点”网络图,使用Network Analyzer功能对网络进行分析,根据节点Degree、Betweenness、Closeness筛选出其抗炎的主要活性成分。
1.2.4 PPI网络构建及分析将疾病与药物的交集靶点输入STRING数据库[13]获取靶标蛋白互作网络关系,构建蛋白相互作用网络模型,设置minimum required interaction score为0.4,删除孤立点;获得蛋白相互作用信息,并将其导入Cytoscape 3.7.2软件,构建PPI网络并进行拓扑指标分析,筛选出关键靶点。
1.2.5 富 集 分 析利 用“DOSE”“clusterProfiler”“pathview”程序包(Bioconductor)[14]对疾病与药物的交集靶点进行生物信息富集分析,包括GO分析以及KEGG通路分析。
2 结果与分析
2.1 当归-肉桂药对挥发性成分分析
通过选定的萃取条件对当归-肉桂药对进行试验,得到当归-肉桂药对GC-MS总离子流。通过质谱数据库检索及文献比对,从当归-肉桂药对中共检测出51个峰(图1),初步鉴定出35种成分,占总挥发性成分的70.53%。其中,挥发性成分含量较高的有α-蒎烯(29.80%)、Δ-杜松烯(8.59%)、(3E)-3,7-二甲基辛-1,3,6-三烯(7.97%)、(-)-菖蒲烯(6.64%)、β-榄香烯(4.17%)、β-石竹烯(2.87%)、α-律草烯(2.42%)等(表1)。

表1 当归-肉桂药对挥发性成分分析结果

图1 当归-肉桂药对挥发性成分的总离子流
2.2 潜在靶点收集
根据药对的CAS号,在TCMSP及Swiss数据库中得到的预测靶点,合并且删掉重复的作用靶点,共得到靶点398个。通过Therapeutic target datebase数据库、GeneCards数据库得到炎症相关基因靶点1 639个,在Venny 2.1.0软件在线作图工具平台上输入成分、疾病的靶点,绘制韦恩图,两者取交集后得到共同靶点184个(图2)。
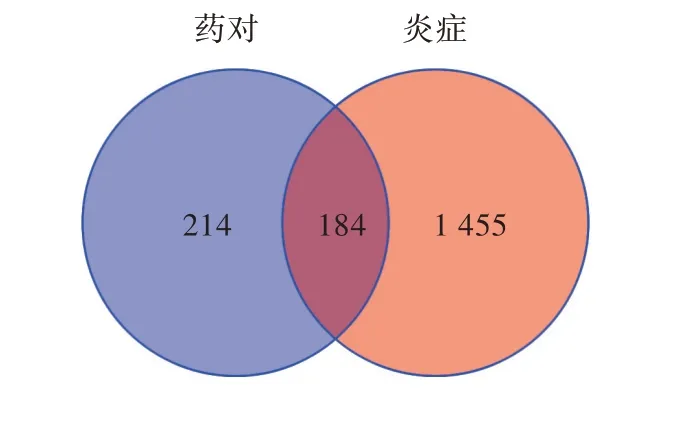
图2 成分、疾病靶点的韦恩图
2.3 “药物-成分-靶点”网络构建及分析
将化学成分及184个潜在作用靶点导入Cytoscape 3.7.2软件,进行网络绘制(图3),此网络由219个节点和659条边构成,并通过Network Analyzer对网络图进行分析。结果显示,当归-肉桂药对重要的抗炎活性成分包括α-蒎烯、β-榄香烯、β-石竹烯、α-律草烯、(-)-异洒剔烯、肉桂醛、二正戊基酮、别罗勒烯、苯乙烯、(-)-菖蒲烯、邻甲氧基肉桂醛等,均能与多个靶点相连接。同时,又可共同作用于一些靶点,体现了挥发油多成分、多靶点、多途径的综合调节特点。

图3 药物-成分-靶点网络
2.4 PPI网络构建
在STRING数据库中输入184个潜在作用靶点,得到蛋白相互作用信息,使用Cytoscape 3.7.2软件对上述数据进行可视化分析,构建PPI网络,并对网络进行筛选,以高于介度(Betweeness)、紧密度(Closeness)的中位数且连接度(Degree)大于2倍中位数为标准,筛选出35个关键靶点(表2),其中度值(Degree)最高的为TNF,能与128个蛋白发生相互作用,其 次 是IL-6、IL-1β、AKT1、STAT3、MAPK3、TLR4等,分别能与125、107、104、84、83、79个蛋白发生相互作用。PPI网络见图4,图形颜色越深、图形越大,靶点度值越高,说明其对应的节点在网络中越重要,反之,颜色越浅,节点越小,代表度值越低。
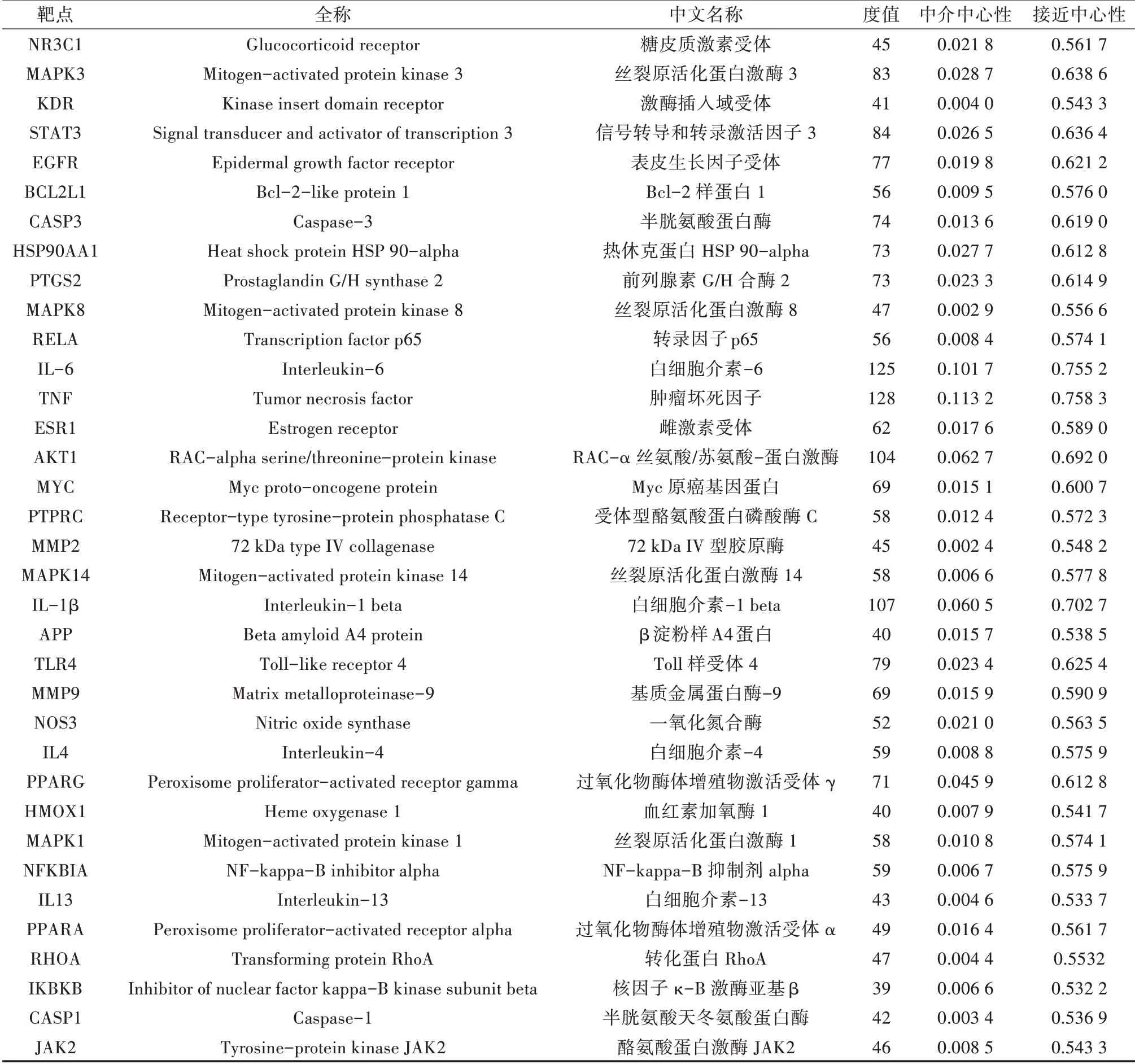
表2 关键靶点信息

图4 当归-肉桂药对蛋白质相互作用网络
2.5 靶点通路分析
利用“DOSE”“clusterProfiler”“pathview”程序包(Bioconductor)对疾病与药物的交集靶点进行GO功能富集分析及KEGG信号通路富集分析。得到1 296个生物学过程(Biological process,BP)、31个细胞组成(Cellular component,CC)、89个分子功能(Molecular function,MF),设定P<0.05,将每一类按照显著性进行排序,将排在前10的GO富集条目和排在前20的KEGG富集条目通过气泡图的形式进行展示,圆圈大小或线条长度表示富集在GO和KEGG的基因数目,颜色代表富集的显著性。
由图5可知,当归-肉桂药对发挥抗炎作用主要涉及的生物学过程(BP)包括对脂多糖的反应(Re-sponse to lipopolysaccharide)、对细菌来源分子的反应(Response to molecule of bacterial origin)、对营养水平的反应(Response to nutrient levels)等;细胞组成富集分析(CC)包括膜筏(Membrane raft),膜微区(Membrane microdomain),膜区(Membrane region)等;分子功能富集分析(MF)包括细胞因子受体结合(Cytokine receptor binding)、血红素结合部位(Cytokine receptor binding)、类固醇结合(Steroid binding)等。

图5 GO功能富集分析
KEGG通路分析结果(图6)显示,当归-肉桂药对发挥抗炎作用排名前20的信号通路,关键通路包括脂质和动脉粥样硬化(Lipid and atherosclerosis)、人巨细胞病毒感染(Human cytomegalovirus infection)、乙型肝炎(Hepatitis B)、点样受体信号通路(NOD-like receptor signaling pathway)等,表明挥发油可通过作用于不同的生物过程和通路协同发挥抗炎作用。
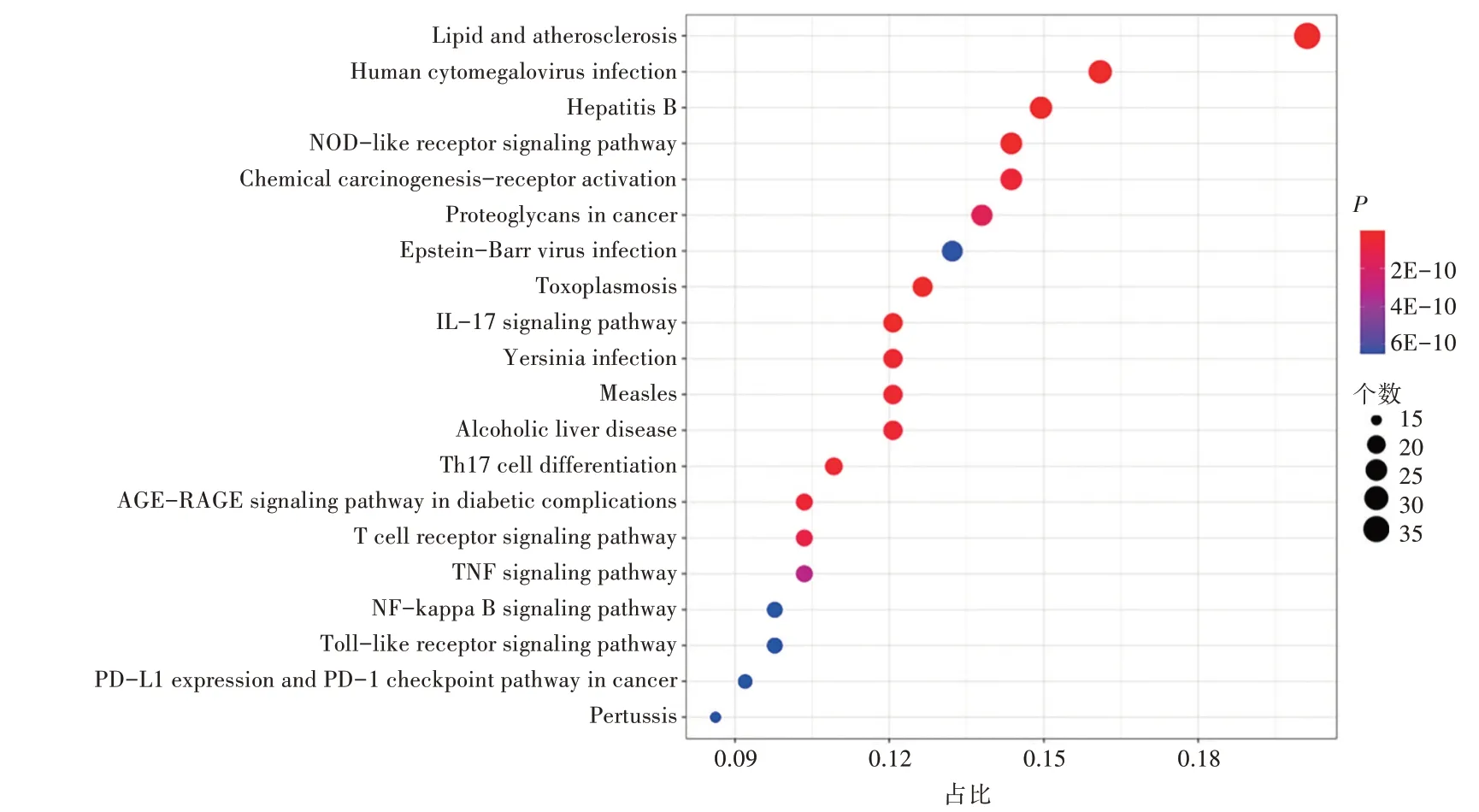
图6 KEGG通路富集分析
3 小结与讨论
本研究采用GC-MS对当归-肉桂药对的挥发性成分进行比较分析,从当归-肉桂药对中鉴定出35个成分,占总挥发性成分的70.53%。将药对与炎症潜在作用靶点及其对应成分分别导入Cytoscape 3.7.2软件,构建“药物-成分-靶点”网络,筛选出其主要的活性成分,发现α-律草烯,α-蒎烯、正丁烯基苯酞、β-石竹烯、β-榄香烯、Δ-杜松烯等挥发性成分,有研究表明其均具有良好的抗炎、抗癌、镇痛等作用,具有较高的保健和医疗应用价值,还具有抗氧化、抗衰老、抗炎、保护心血管、防治肿瘤、改善免疫功能等作用[15-18]。α-蒎烯能抑制大鼠巨噬细胞中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、NO的生成及核转录因子-κB信号通路(NF-κB通路),从而具有抗炎作用[19];β-石竹烯、β-榄香烯通过对PPARA-RXRA-NCOA2信号轴与PTGS2、PTGS1、IL-6等炎性因子的潜在作用,从而发挥产热、减脂、抗炎作用[20]。PPI网络分析结果表明,从184个潜在作用靶点中筛选出35个关键靶点。当归-肉桂药对主要通过TNF、IL-6、IL-1β、AKT1等炎症因子相互作用协同发挥抗炎作用。肿瘤坏死因子(TNF)[21]在抑制炎症反应之外可以诱发降压以及肾脏利尿排钠反应;IL-6作为一种由T淋巴细胞、巨噬细胞、中性粒细胞等细胞分泌出来的炎性细胞因子,具有较突出的调节细胞增殖及分化、免疫抑制等功能;白细胞介素-1β(IL-1β)作为目前临床工作中第一个被发现的白细胞介素,主要功能在于参与内源性致热源与炎症反应[22]。KEGG通路结果表明,当归-肉桂药对主要通过调节脂质和动脉粥样硬化(Lipid and atherosclerosis)、乙型肝炎(Hepatitis B)、点样受体信号通路(NOD-like receptor signaling pathway)、弓形体病(Toxoplasmosis)、IL-17信号通路(IL-17 signaling pathway)、耶尔森菌感染(Yersinia infection)、Toll样受体(Toll-like receptor)、TNF等信号通路发挥抗炎作用。其中,IL-17信号通路被认为可影响mRNA转录,在炎症反应中起关键作用,IL-17是一种强有力的炎症性白细胞介素,能激活其他促炎细胞因子的表达[23],其主要由辅助性T细胞(Th17细胞)和其他来源产生,包括自然杀伤细胞、肥大细胞和中性粒细胞。TNF信号通路可通过CD14+巨噬细胞共同刺激和激活固有层T淋巴细胞(CD14+细胞膜结合的TNF与固有层T细胞上的TNFR2相互作用)来调节肠道炎症。总之,本研究采用GC-MS对当归-肉桂药对进行分析,并运用网络药理学方法揭示了抗炎活性成分及其作用机制,结果表明,当归-肉桂药对通过多种成分、多靶点共同调控炎症信号通路及炎症疾病通路,影响炎症生物学过程,发挥抗炎作用,从而治疗疾病,为当归-肉桂药对后续研究及临床应用提供理论依据和方向。

