兰州百合鳞片气培腐烂病病原菌的分离与鉴定
胡雨萌,曹彩霞,吕莉珍,巨秀婷,
(青海大学,a.农牧学院;b.高原花卉研究中心/青海省园林植物与观赏园艺研究重点实验室,西宁 810016)
兰州百合(Lilium davidiivar.unicolor)属川百合的变种,味甘而不苦,被称为甜百合,其鳞片紧密包合、色泽白皙、肉质丰厚[1],多年生可食用植物,主要种植在甘肃省中部地区[2],也是中国的传统药用植物[3]。兰州百合以无性繁殖为主,最常用和繁殖系数最高的材料是鳞片[4]。气培法繁殖是在人工控制条件下将兰州百合鳞片裸露于空气中培养的一种无性繁殖方式[5]。利用气培法生产兰州百合种球,操作方法简单易行,且投资较少,生长周期短,繁殖速率高,可进行规模化生产[6]。气培过程虽不使用培养基质和营养液,但在培养初期鳞片仍易发生腐烂病害,使得繁殖速率受到影响,降低繁殖系数。
百合是一种较易感病的植物,病害可能成为生产中的重要制约因素[7],且真菌性病害占较大比重[8],并已有多种百合在培养过程中发生此类病害的相关报道[9-11]。兰州百合病害的病原菌研究主要集中在鳞茎腐烂方面,在贮藏期间分离得到引起鳞茎腐烂的病原菌分别为黄曲霉和米根霉[12];在生长期间发生的兰州百合枯萎病主要是由镰刀菌侵染所引起的土传病害,会使肉质根和基盘变褐腐烂[13]。目前,关于兰州百合在气培过程中鳞片腐烂病的研究鲜见报道。
为明确兰州百合在气培过程中发生鳞片腐烂病的原因,并确定其病原菌种类,本研究采集在气培初期出现腐烂病害的发病组织,对病原物进行分离、纯化、致病性测定,并对致病菌进行形态学及分子生物学的双重鉴定,为深入探究兰州百合鳞片在气培过程中腐烂病的发病规律及在生产过程中进行有效的病害控制提供理论依据。
1 材料与方法
1.1 病样采集
选取饱满、无病虫损伤的兰州百合鳞茎,剥取鳞片消毒,置于具有透水孔的催培盘中进行空气培养。气培初期(3˜7 d),收集所有出现褐色、变软、溃烂症状的疑似有腐烂病发生的鳞片,进行病原菌分离。
1.2 病原菌的分离与纯化培养
采用组织分离法,用无菌水清洗具腐烂症状的兰州百合鳞片,将病健组织交界处剪成5 mm×5 mm的小块,用75%乙醇消毒30 s,7.5%次氯酸钠处理3 min,无菌水冲洗3次;置于PDA平板培养皿中培养,培养箱温度25℃,培养3˜5 d。保留同批PDA培养基作为空白对照。待长出菌丝后,挑取不同菌落边缘,分别置于PDA培养基中进行进一步纯化,在25℃培养箱培养3˜5 d,多次分离直至纯化,观察菌落形态。菌株编号方式为菌落编号-菌落分离培养皿编号-纯化培养皿编号(如1-A-11、1-B-1等)。
1.3 致病性测定
根据柯赫氏法则选取健康的兰州百合鳞片,用75%乙醇进行表面消毒,无菌水清洗。在超净工作台内用灭菌手术刀将消毒后的健康鳞片划伤,并用灭菌接种针挑取分离纯化得到的菌株边缘菌丝,将菌丝覆盖在健康鳞片的伤口上,每种菌重复3次,并设空白对照。将接种的兰州百合鳞片置于有浸水滤纸的培养皿中,保湿培养,每天检查滤纸是否湿润,若滤纸变干,在培养皿中加无菌水,直到滤纸湿润,水略多于滤纸表面,补水完成。在25℃培养箱中培养,观察并记录发病情况。
1.4 形态学鉴定
将致病菌菌株的菌丝挑出,用压片法制成临时玻片,置于电子显微镜(Nikon DS-Fi2)下观察菌丝及孢子形态。
1.5 分子生物学鉴定
利用CTAB法进行致病菌DNA提取,用真菌鉴定的通用引物对致病菌菌丝DNA进行ITS-PCR扩增。参照扩增程序[11]进行优化:预变性94℃,34 min;变性94℃,1 min;退火54℃,1 min;延伸72℃,1 min,共36个循环;最后72℃,10 min;4℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测,使用凝胶成像系统观察扩增结果。将500 bp左右的清晰条带进行切胶回收,送往生工生物工程(上海)股份有限公司进行序列测定。
利用NCBI中提供的Blast工具对所得序列进行同源性比对分析,并下载与致病菌菌株相似度最高的ITS序列,采用邻接法,运用MEGA 7.0软件构建系统发育树。
2 结果与分析
2.1 病害症状
色泽洁白、品相良好且饱满的兰州百合鳞片(图1A)放置在催培盘中进行气培。培养初期发病鳞片凹面变红,培养7˜9 d鳞片顶部及基部开始形成略显褐色的点状物,逐渐扩展成为不规则的褐色病斑,随着培养时间的延长,病斑逐渐向四周扩展,腐烂组织不断增加,培养15 d左右整个鳞片软化腐烂(图1B),无分化小鳞茎能力。在25℃、500 lx气培环境条件下兰州百合鳞片腐烂率可达11.5%。

图1 兰州百合鳞片腐烂病症状
2.2 病原菌的分离纯化、致病性测定
采集鳞片腐烂病不同发病组织9份,分离纯化后共获得18株真菌分离物并全部进行致病性检测。其中,1-A-11、10-A-1、10-A-2、1-B-1菌株接种于兰州百合健康鳞片后,培养5 d开始出现不同程度的腐烂症状,并与自然发病的典型腐烂病症状一致。菌株1-A-11(图2A)、10-A-1(图2B)、10-A-2(图2C)接种培养7 d后,接种部位均出现规则的褐色病斑,病斑上附着白色丝状物,病斑中央呈腐烂状,随着培养时间延长并逐渐向四周扩展(图2);3个菌株接种发病率分别为95%、75%、75%。菌株1-B-1的接种部位除出现上述症状外,还伴有灰色霉层产生(图2D),接种发病率为100%。对照在气培过程中生长良好,无任何发病症状(图2E)。在回接的发病部位分离到与原接种菌形态一致的分离物,再次根据柯赫氏法则进行致病性检测,验证得到菌株1-A-11、10-A-1、10-A-2、1-B-1为致病菌。
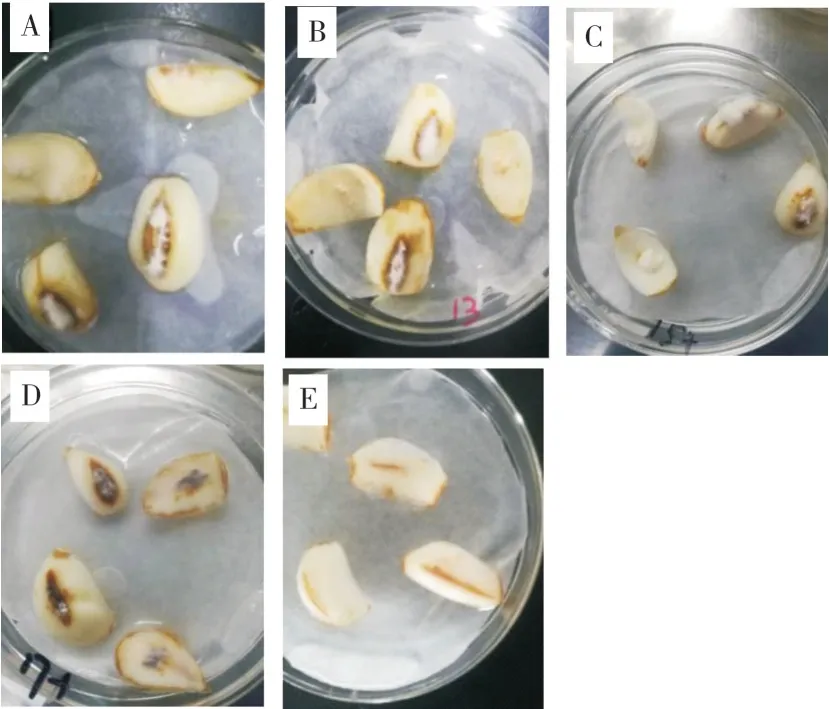
图2 人工接种病原菌兰州百合鳞片的感病症状
2.3 形态学鉴定
菌株1-A-11、10-A-1、10-A-2、1-B-1分别在PDA培养基25℃恒温培养后,按照培养性状和形态特征可大致分为2类。
2.3.1 以1-A-11、10-A-2为代表的菌株菌落正面菌丝呈致密丝绒状,白色并附有淡黄色(图3A),菌落背面中心呈淡紫色轮纹,基物不变色,分支较少(图3B)。小型分生孢子呈椭圆形或卵圆形,无色,中间宽,两端渐尖,有1˜2隔,大小为(4.5˜13.1)μm×(1.2˜3.7)μm;大型分生孢子镰刀状,两端略尖,有2˜3隔,大小为(26.4˜42.1)μm×(3.9˜6.7)μm(图3C、图3D)。可初步鉴定病原菌类型为尖孢镰刀菌(Fusarium oxysporum)。
2.3.2 以10-A-1、1-B-1为代表的菌株在PDA培养基上菌落正面呈圆形,菌丝为棉絮状(图3E),背面为明显的浅紫色放射状菌落,有隔菌丝,分支较多,菌丝内有圆形内容物(图3F)。小型分生孢子数量多,链状生长,有棒形、柱形,单细胞或有1˜2隔,大小为(4.8˜13.9)μm×(1.4˜3.2)μm;大型分生孢子呈镰刀状,两端尖,有3˜5个隔膜,大小为(23.8˜ 42.5)μm×(4.1˜7.1)μm;产孢细胞为单瓶梗,未见厚垣孢子(图3G、图3H)。初步鉴定为富士镰刀菌(Fusarium fujikuroi)。

图3 菌落形态及镜检
2.4 分子生物学鉴定
以菌株1-A-11、10-A-1、10-A-2、1-B-1的菌丝DNA为模板,经通用引物ITS1/ITS4扩增后,得到ITS序列长度为500˜600 bp的条带(图4)。测序后进行Blast同源性比对,菌株1-A-11与Fusarium oxysporumstrain MJ-23(登录号:KF751873)相似性最高,为99.47%;菌株10-A-2与Fusarium oxysporumf.sp.lentis isolate FLS65(登录号:KU671042)一致性达99.82%;菌株10-A-1与Fusarium fujikuroiisolate YN27(登录号:MN696097)序列相似性为99.82%;菌株1-B-1与Fusarium fujikuroistrain SAPB7(登录号:KX343958)相似性最高,为99.64%(图5)。

图4 4株菌株rDNA-ITS序列的PCR扩增
基于rDNA-ITS序列构建系统发育树(图5),表明4个病原菌菌株1-A-11、10-A-2、10-A-1、1-B-1与镰刀菌属的多条序列聚集在一个大的树状分支上,其中,菌株1-A-11、10-A-2与尖孢镰刀菌(登录号:KF751873、KU671042、MF629741)聚在同一小分支上,并与形态学鉴定结果一致,将其鉴定为尖孢镰刀菌;菌株10-A-1、1-B-1与富士镰刀菌(登录号:KX343958、MN696097)聚在同一小分支上,同样与形态学鉴定结果一致,将其鉴定为富士镰刀菌。

图5 基于rDNA-ITS序列构建4种兰州百合鳞片腐烂病病原菌及相关菌株的系统发育树
3 小结与讨论
在百合病害中,鳞茎腐烂病是近年来发生最普遍的真菌性病害,发病率达20%˜30%。在1926年首次证实该病害是由镰刀菌引起[14],且在龙牙百合[15]、西班牙百合[16]、兰州百合[17]中已有相关报道。镰刀菌可为害百合植株各器官,尤其是地下鳞茎,严重时会对百合产量和品质有很大影响。镰刀菌形态多样,并在生长过程中会发生较大的形态变异,单纯应用形态学鉴定的方法很难将其准确鉴定到种[18]。近年来,在形态学鉴定的基础上利用分子生物学鉴定镰刀菌的方法被广泛应用[19]。通过形态特征并辅以分子生物学的手段,也是近年来有效鉴定病原微生物的途径[20,21]。本研究通过组织分离、致病性测定以及柯赫氏法则验证获得4株病原菌株,利用形态学特征和分子生物学手段,4株菌株鉴定为2类镰刀菌。在尖孢镰刀菌生长特性研究中也表明其培养过程的前、后期形态上会发生变化,且同一镰刀菌在同一环境中培养颜色也会发生阶段性的变化[22]。
潘其云等[23]在百合镰刀菌枯萎病的研究中认为病害的发生与温湿度关系密切,且枯萎病的发病适温为20˜26℃,说明在此温度范围是镰刀菌生长和繁殖的最佳温度。而兰州百合鳞片进行气培时,选择的环境温度为22℃,非常适宜镰刀菌的生存,也是腐烂病害发生的病因之一。因此,鳞片消毒和空气环境因子的确定在气培过程显得尤为重要。
镰刀菌是一种既可以侵染植物又具有广泛寄主的土传病害,可对多种作物造成危害。针对现有的研究基础,并且利用真菌基因组较小这一特点,后续可利用镰刀菌进行无毒基因克隆,获得抗性基因,进行抗性种质的研究,以期解决兰州百合生产甚至是更多作物生产过程中由镰刀菌引起的真菌性病害问题。

