免举宫器封闭宫颈的改良腹腔镜根治术在早期宫颈癌中的应用
雷翠蓉,黄一琴,姜红薇
(重庆大学附属肿瘤医院妇科肿瘤中心,重庆 400030)
宫颈癌是妇科最常见的恶性肿瘤,绝大多数宫颈癌都是持续感染高危型HPV所致[1]。虽然疫苗的普及和宫颈癌三级预防措施的有效实施极大提高了宫颈癌的防控效果,但是宫颈癌仍然是严重危害妇女健康的主要疾病。2020年全世界约有604 000例新发病例,其中有342 000例患者死亡[2],在低收入国家情况更为严峻[1-4]。因此,加强宫颈癌三级预防,提高宫颈癌疫苗普及率,在治疗效果较好的宫颈癌早期阶段早诊早治尤为关键[5]。2018年Ramirez等[6]发表的腹腔镜宫颈癌手术(laparoscopic approach to cervical cancer,LACC)研究引发了早期宫颈癌手术入路的重新思考,主要集中在腹腔镜术中举宫器的使用及无瘤原则的应用。此后,改良腹腔镜宫颈癌根治术及更多的前瞻性、多中心、不同术式宫颈癌根治术临床研究陆续开展。本院自2018年开展免举宫器改良腹腔镜宫颈癌根治术,术中尽可能模拟开腹手术的操作步骤并遵循无瘤原则,让无瘤与微创并行。本研究回顾性分析我院同一主刀医生2018年完成的早期宫颈癌根治术资料,其中开腹组45例、腔镜组38例,对2组患者的围术期情况进行比较,并行全程管理,观察其3年生存情况,以探讨免举宫器封闭宫颈的改良腹腔镜根治术在早期宫颈癌治疗中的可行性,为其临床治疗提供依据。
1 资料与方法
1.1 临床资料
收集2018年1~12月就诊于重庆大学附属肿瘤医院妇科肿瘤中心的83例早期宫颈癌患者的临床资料,将行免举宫器封闭宫颈改良腹腔镜根治术的38例患者纳入腔镜组,行传统开腹手术的45例患者纳入开腹组。2组患者平均年龄、国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO) 2018分期、病理类型等资料比较差异均无统计学意义(P>0.05),具有可比性,见表 1。纳入标准:①术前经组织病理学确诊为宫颈癌;②影像检查无远处转移;③经2名有经验的妇科肿瘤高级职称医生查体诊断为宫颈癌ⅠB1、ⅠB2或ⅡA1期(FIGO 2018);④同一高级职称主刀医生完成的宫颈癌根治术,治疗后进入微信群随访,全程管理。排除标准:①既往有次全/全子宫切除史;②近期有盆腔化疗或放疗史;③随访资料不全或失访。所有患者术前均经过充分沟通,自愿选择开腹或改良腹腔镜手术。本研究得到了重庆大学附属肿瘤医院伦理委员会的批准(CZLS2022187-A)。

表1 2组宫颈癌患者临床资料比较
1.2 手术方法
2组患者术前完善相关常规检查,术前12 h给予聚乙二醇电解质口服灌肠,术前30 min给予一组抗生素预防感染,术中气管插管全身麻醉,手术超过3 h追加一组抗生素,围术期其他用药及护理基本相同。
开腹组患者取平卧位,取下腹正中绕脐切口或者旁正中切口,切口长18~20 cm,逐层进腹后全面探查,无保留卵巢要求者高位结扎双侧漏斗韧带,并凝闭输卵管,然后清扫盆腔淋巴结(包括Cibula淋巴结分组的1级盆腔淋巴结及2级髂总淋巴结组),再行常规宫颈癌根治术。
腔镜组患者取大直卧位,于肚脐取1个约0.2 cm的切口,置气腹针,充入CO2建立气腹,腹腔内压力12 mmHg,于脐上3~4 cm处作1 cm横行切口,置入镜头;改头低足高位,在镜头引导下于下腹左右侧麦氏点、左右脐旁约7 cm处作4个操作孔。进镜全面探查,首先凝闭双侧输卵管,无保留卵巢要求者高位结扎双侧漏斗韧带。然后按照髂总→髂外→腹股沟深→闭孔→髂内血管旁的顺序整块切除盆腔淋巴结(包括Cibula淋巴结分组的1级盆腔淋巴结及2级髂总淋巴结组),清扫一侧淋巴结后及时将其装袋并密闭,用灭菌注射用水反复冲洗创面,同法处理对侧淋巴结。再行改良腹腔镜宫颈癌根治术,采用1-0可吸收线“8”字缝合双侧宫角吊宫,助手左手持钳牵拉吊宫缝线协助暴露术野,右手用吸引器协助主刀完成广泛子宫切除。处理完各韧带,确定游离足够长阴道后,用预先准备好的套扎线套扎宫颈穹窿及部分阴道,结扎封闭宫颈,完全封闭状态下于结扎线下方3 cm处离断阴道,广泛切除全子宫并经阴道完整取出。术后用灭菌注射用水反复冲洗,检查无渗血及损伤后结束手术。
术后根据病检结果并结合Sedlis标准及腺癌四因素模型行补充治疗,包括放疗和/或化疗。治疗结束后按照宫颈癌监测及随访要求进行随访复查,邀请患者进入微信群,于群内不定期发送肿瘤相关康复信息,并敦促患者按期返院复查,有异常症状者随时返院复查。由妇科肿瘤专科医生根据影像、活组织病理检查结果确定是否复发。随访时间为术后3年,前2年每3个月随访1次,随后每6个月随访1次,通过电话等方式进行。无进展生存期是指患者出院后至复发时间,总生存期是指患者出院后至随访结束或病死时间。
1.3 观察指标
统计2组患者的围术期情况,包括:术中出血量、输血情况、手术时间、肛门排气时间、引流管拔除时间、住院时间;统计2组患者围术期并发症,包括:术中损伤、术后感染、淋巴囊肿、下肢麻木、切口愈合不良、下肢血栓;统计2组患者术后病检结果,包括:宫旁切除宽度、阴道切除长度、阴道切缘阳性情况、神经及脉管受累情况、盆腔淋巴结切除及阳性淋巴结比例等。记录患者术后放疗、化疗情况。根据随访结果计算患者术后3年无进展生存率和总生存率。
1.4 统计学方法

2 结果
2.1 围术期主要指标比较
腔镜组术中无输血病例,2组输血情况比较差异有统计学意义(P<0.05);腔镜组术中出血量、肛门排气时间、住院时间、引流管拔除时间均少/短于开腹组,差异有统计学意义(P<0.05);2组患者手术时间比较,差异无统计学意义(P>0.05),见表 2。
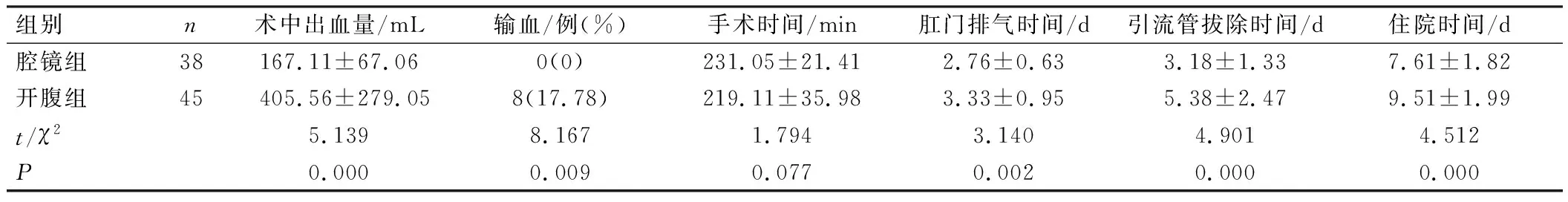
表2 2组围术期主要指标比较
2.2 围术期并发症比较
腔镜组患者术中损伤、术后感染、淋巴囊肿、下肢麻木、切口愈合不良、下肢血栓等围术期并发症总发生率低于开腹组,差异有统计学意义(P<0.05),见表3。
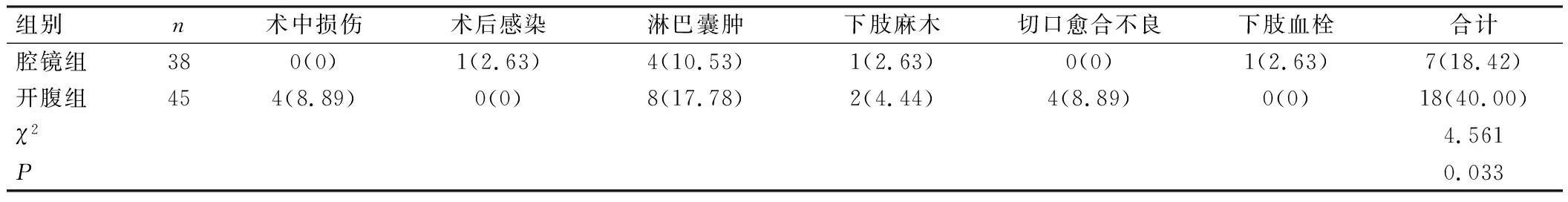
表3 2组围术期并发症比较[例(%)]
2.3 术后情况
2组患者盆腔淋巴结切除数目、阴道切除长度、宫旁切除宽度、阳性淋巴结比例、神经及脉管受累等情况比较,差异无统计学意义(P>0.05),所有患者术后阴道切缘及宫旁切缘均无阳性。术后有35例患者行盆腔外照射放射治疗,18例行化疗,2组术后补充放化疗比例比较,差异无统计学意义(P>0.05),见表4。
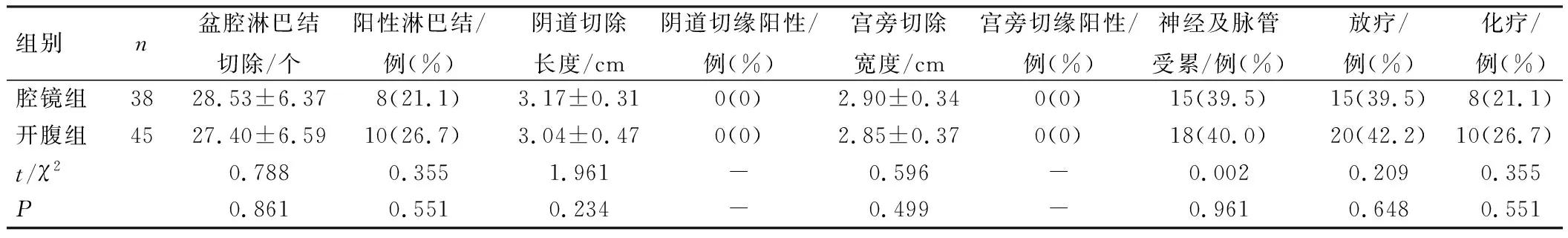
表4 2组患者术后病检及术后放化疗情况比较
2.4 2组患者随访情况
2组患者术后随访32~43个月,中位随访时间为37.7个月。2组均有3例复发,2例死亡。腔镜组患者术后 3年无进展生存率和总生存率分别为 91.60%、94.10%,开腹组术后3年无进展生存率和总生存率分别为93.40%、96.60%,2组比较差异均无统计学意义(P>0.05),见图1。
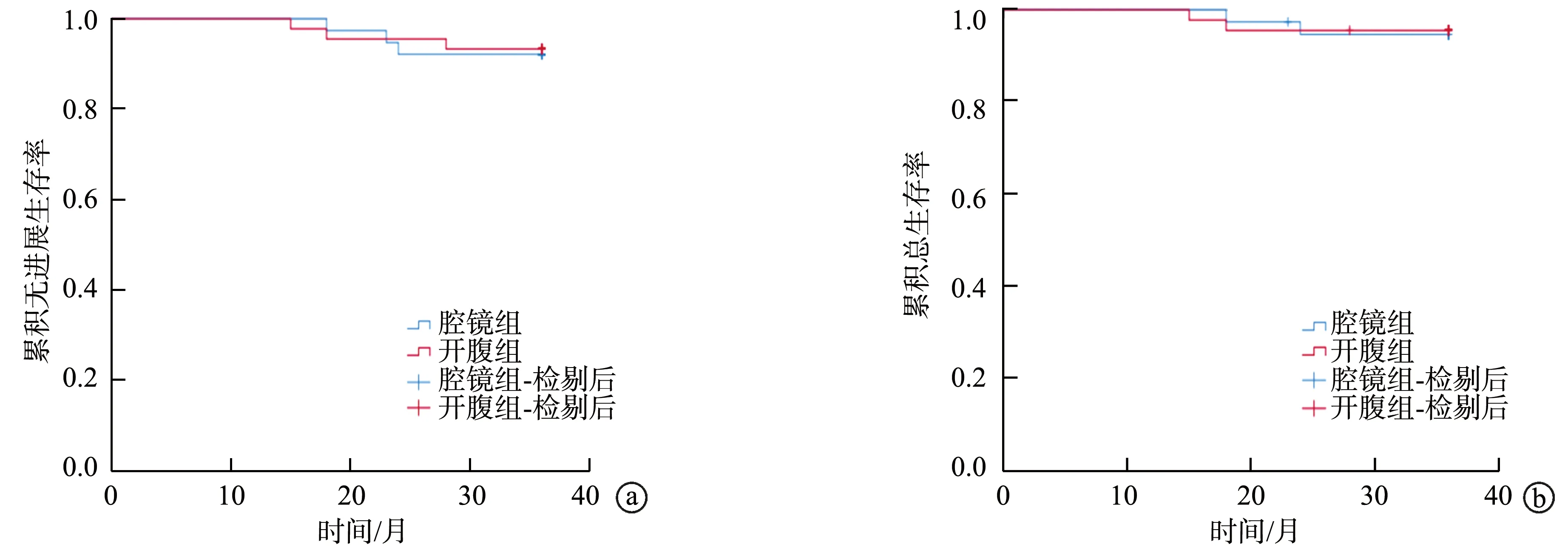
a:术后3年无进展生存率;b:术后3年总生存率
3 讨论
手术是早期宫颈癌最主要的治疗手段[7],宫颈癌的规范治疗及严格手术质量控制可减少术后并发症,提高患者生活质量[8]。根治性子宫及双侧盆腔淋巴结切除术是早期宫颈癌的首选治疗方法,手术切除范围包括部分主韧带、宫骶韧带、阴道上段和盆腔淋巴结,必要时切除腹主动脉旁淋巴结[7]。2018年一项多中心、随机、对照临床研究(LACC研究)引起了妇瘤界的震动,该研究比较了开腹和微创宫颈癌根治术之间的无进展生存率和总生存率,结果显示,开腹手术组的无进展生存率和总生存率均高于腹腔镜组[6]。基于该LACC研究,2019年更新的美国国立综合癌症网络指南(第3版)对早期宫颈癌患者仅推荐行开腹手术治疗[9]。
LACC研究的发表引发了国内外妇瘤界对宫颈癌手术方式的重新思考,也对宫颈癌治疗及手术质量的管理提出了更多疑问和挑战。腹腔镜手术伤口小、视野清晰、解剖清楚、利于教学、术中出血少、恢复快、住院时间短等优点是业内推崇腹腔镜手术的主要原因,但是对于肿瘤治疗,远期的无进展生存率和总生存率更为关键,腹腔镜手术与开腹手术的争论主要是肿瘤学的远期结局。关于肿瘤学结果,Mendidivil等[10]对146例早期宫颈癌患者的临床资料进行回顾性分析显示,开腹手术、腹腔镜手术和达芬奇机器人手术后60个月患者的无进展生存率、总生存率均无明显差异。也有研究认为腹腔镜手术与开腹手术的远期无进展生存率和总生存率无明显差异[11-12]。部分研究者根据肿瘤组织学类型、病灶大小及分期、是否行宫颈锥切等行多因素分析,进一步探寻早期宫颈癌腹腔镜手术的适应证[13-14]。相关指南提出,FIGO 2009年分期为ⅠB1期且肿瘤直径≤2 cm的宫颈癌是腹腔镜手术的适应证[15-16]。
对于腹腔镜手术能否继续应用于早期宫颈癌的治疗业内意见不一,其面临的挑战主要有:①需寻找腹腔镜手术治疗宫颈癌导致其肿瘤学预后差的原因;②需进一步探寻早期宫颈癌腹腔镜手术的适应证。LACC研究提出,术中使用举宫器挤压宫颈导致肿瘤入血、举宫棒刺破子宫造成肿瘤经腹腔扩散及持续的CO2气腹是导致患者无进展生存率和总生存率下降的可能原因[6]。2021年Kanao等[17]提出了“术中肿瘤溢漏(intro-operative tumor spillage,IOTS)”的概念,指由于医源性因素导致肿瘤细胞溢漏至患病器官以外的无瘤区域,并认为腹腔镜下行子宫切除术时,举宫器的使用破坏了局部肿瘤的完整性,使得肿瘤细胞可以通过阴道断端、穿孔的子宫以及输卵管溢漏至盆腔。因此,免举宫器及密闭肿瘤的改良腹腔镜宫颈癌根治术及更多的前瞻性、多中心、不同术式宫颈癌根治术的临床研究陆续开展。
自2018年以来,我院妇科肿瘤中心积极寻找原因,改良了腹腔镜宫颈癌根治术,在遵循指南及所有患者充分知情的情况下,参加全国多中心、前瞻性、早期宫颈癌不同手术入路的临床研究。该手术的改进要点在于手术开始即凝闭双侧输卵管,避免使用举宫器,通过吊宫达到暴露视野的目的,并在完全封闭宫颈的情况下广泛切除子宫,实现了复制开腹手术无瘤原则的微创手术。
免举宫器封闭宫颈的改良腹腔镜根治术优势明显,可最大限度保证无瘤。宫颈癌根治术选用任何举宫器都不可避免地会压迫癌组织,导致癌细胞通过直接压迫入血或者进入宫腔,甚至经输卵管进入腹腔,导致肿瘤的散播种植、转移。研究表明,与免举宫器相比,使用举宫器术中肿瘤包膜破损率及肿瘤腹腔转移率均显著增加[18-19]。本研究通过悬吊子宫并摆动至不同位置来达到暴露视野的目的,整个过程中未使用举宫器,很好地避免了肿瘤挤压入血及举宫棒穿透宫腔进腹的可能;同时,在切开阴道前用预制套扎线圈完全封闭宫颈及肿瘤,避免了肿瘤直接暴露于腹腔。在传统腹腔镜手术中,淋巴结清扫可能会按照不同部位分块切除,清扫的盆腹腔淋巴结通常放置在同侧髂窝,切除子宫后再经阴道取出。如果淋巴结存在转移,肿瘤细胞长期暴露在腹腔内,将增加肿瘤细胞转移种植的概率。本研究术中所有淋巴结采取整块切除并及时装袋,避免了肿瘤暴露及遗漏,淋巴结整块切除更符合肿瘤外科治疗原则;每个术野结束操作后均用大量灭菌注射用水反复冲洗,及时吸走可能残存的肿瘤细胞。有研究显示,经过预处理的非污染组与可能存在腹腔肿瘤的污染组相比,患者4.5年生存率分别为95.9%和86.6%,远处复发率分别为0.4%和3.5%,差异显著[20]。在开放性宫颈癌根治术中,用1把大直角钳封闭宫颈病灶,可避免癌组织直接暴露,完全隔绝癌组织与腹腔的接触,同时用2把小直角钳夹住阴道切缘上端,确保阴道切除足够长度。传统腹腔镜手术在切开阴道时通常无保护措施,导致宫颈病灶部分或全部暴露于腹腔中。有研究报道,随着肿瘤直径的增加,暴露、复发和转移的风险也随之增加,无进展生存率和总生存率都有可能降低[18-19]。本研究在游离足够长的阴道长度后,在宫颈病灶下方进行阴道套扎封闭宫颈及病灶,尽可能复制开腹手术的操作步骤,然后在套扎线下方离断阴道,避免了宫颈癌组织腹腔暴露。此外,改良腹腔镜根治术中采取大直卧位,避免了膀胱截石体位的复杂摆放,减少了患者不适,降低了术后静脉血栓风险,且减少了举宫的人力消耗。
免举宫器封闭宫颈的改良腹腔镜根治术围术期安全可控。本研究中,改良腹腔镜根治术中均无损伤,术中出血量、肛门排气时间、住院时间、引流管拔除时间等均少/短于开腹组,围术期并发症总发生率低于开腹组,与部分研究结果较一致[21-22]。本研究结果表明,改良腹腔镜宫颈癌根治术在免举宫器封闭状态下切除宫颈癌组织,近期手术质量安全有保障,无严重并发症。
另外,本研究中所有手术操作均为同一名高级职称的妇科肿瘤医生及其团队协作完成,手术方式均为Ⅲ型根治性子宫切除术和盆腔淋巴结切除术,这较好地保证了手术过程及切除范围的质量控制。2组患者盆腔淋巴结切除数目、阴道切除长度、宫旁切除宽度、阳性淋巴结比例、神经及脉管受累情况等无明显差异,所有患者术后阴道切缘及宫旁切缘均无阳性。同时,我中心为手术、放疗、化疗为一体的妇科肿瘤治疗中心,患者术后可以及时补充放化疗,可确保患者后续的规范治疗及随访。本研究2组术后补充放化疗比例无明显差异,术后3年无进展生存率和总生存率亦无明显差异,与Kohler等[23]研究结果一致。
综上所述,免举宫器封闭宫颈的改良腹腔镜根治术围术期安全,可操作性强,能最大限度确保无瘤,全程管理随访3年无进展生存率、总生存率与开腹手术无明显差别。免举宫器封闭宫颈的改良腹腔镜宫颈癌根治术可能是未来宫颈癌患者的一种选择。但本研究为单中心回顾性研究,且样本量不大,随访时间偏短,研究结果可能存在偏倚。虽然本研究腹腔镜手术步骤基本复制了开腹手术,但是腹腔镜手术中CO2气腹的影响尚不能忽视,相信未来更多设计良好的多中心前瞻性临床研究的开展,将为宫颈癌手术治疗提供更好的方案。

