胰腺癌组织富含亮氨酸重复序列蛋白55基因的表达和启动子区甲基化状态及其临床意义
金晶 陈颖 陈燕 许金芳 于齐宏 庞亚南 满晓华 吴洪玉 吕顺莉
1海军军医大学第一附属医院消化内科,上海 200433;2海军军医大学军队卫生统计学教研室,上海 200433
胰腺癌恶性程度高,5年生存率低,早期诊断困难,近年发病率呈上升趋势。我国国家癌症中心2017年统计数据显示,胰腺癌在我国男性恶性肿瘤发病率为第7位,女性第11位,占恶性肿瘤相关死亡率的第6位[1],因此早期诊治显得尤为重要。近年来,越来越多的研究证实DNA的异常甲基化在肿瘤的发生和发展过程中起重要作用,肿瘤细胞DNA总体甲基化水平低于正常细胞,但在某些特定区域如启动子区CpG岛处于高甲基化状态,可诱导基因突变、基因缺失,抑制基因表达,使抑癌基因丧失功能[2-4]。本研究应用甲基化芯片杂交筛选出富含亮氨酸重复序列蛋白55(leucine rich repeat containing 55,LRRC55)基因,观察其在胰腺癌中的甲基化状态,分析其mRNA表达与临床特征的关系,探讨LRRC55基因参与胰腺癌发病的潜在机制,以期对胰腺癌早期诊断提供新靶标。
材料与方法
一、标本收集
收集2019年5月至2021年5月间海军军医大学第一附属医院普外科37例行手术切除并经病理学证实的胰腺导管腺癌组织及其癌旁正常组织(距肿瘤2 cm之内)。随机选取2例胰腺癌组织及癌旁组织行LRRC55基因甲基化检测;记录其余35例患者的年龄、性别、肿瘤部位、肿瘤大小、分化程度、临床分期、是否有淋巴结转移及血CEA、CA19-9水平等指标。另收集2例正常胰腺组织标本,2例健康成人外周血标本作为对照。标本置于液氮中保存。
二、细胞培养
人胰腺癌细胞株PaTu8988由德国Marburg Phillips大学分子生物学和分子病理学研究所Elsasser博士惠赠,人胰腺癌细胞株ASPC1购于中国科学院细胞库。细胞株置含小牛血清的DMEM培养液中,于37℃、95%湿度、5% CO2培养箱中培养。
三、胰腺癌组织和胰腺癌细胞株LRRC55基因启动子区CpG岛甲基化检测
采用亚硫酸氢盐测序法(bisulfite sequencing PCR,BSP)检测LRRC55基因启动子区CpG岛甲基化状态。以酚氯仿法抽提2例胰腺癌组织及癌旁组织、2株胰腺癌细胞株及2例正常成人外周血白细胞DNA,紫外分光光度计(NanoDrop ND-1000,美国)测定DNA纯度和浓度。DNA亚硫酸氢盐修饰和回收纯化按EZ-DNA Kit试剂盒(北京天漠科技开发有限公司)说明书操作,置于-20℃保存。引物设计参考Pubmed GenBank中报告的LRRC55基因(GeneID:219527)序列,应用methyl-primer express1.0软件设计,由上海生工生物工程有限公司合成。LRRC55甲基化正向引物序列为5′-GTAGGAAAATAGGTAGCGTTAGGTC-3′,反向引物序列为5′-AAAAAAACCGAAAATAATACCACG-3′,扩增片段为130 bp;LRRC55-BSP正向引物序列为5′-GGTTTAGAAAAATGAGTTTG-3′,反向引物序列为5′-CCTTCATCCCAACATCCCTT-3′,扩增片段为256 bp;内参β-actin正向引物序列为5′-TGGTGATGGAGGAGGTTTAGTAAGT-3′,反向引物序列为5′-AACCAATAAAACCTACTCCTCCCTTAA-3′。PCR反应条件:BSP退火温度为53.3℃,甲基化退火温度为61.3℃,菌落PCR退火温度为60℃。PCR产物经含0.5 mg/L溴化乙锭的1.8%琼脂糖胶进行鉴定,用复日FR-980生物电泳图像分析系统摄影。
四、胰腺癌组织LRRC55基因mRNA表达检测
采用实时定量PCR法检测35例胰腺癌及癌旁组织、2例正常胰腺组织中LRRC55基因mRNA的表达。采用TRizol试剂(美国Invitrogen公司)提取组织总RNA,分光光度计测定总RNA纯度和浓度。取1 μg总RNA在20 μl反应体系中一步法转录cDNA(美国Takara公司)。LRRC55引物和探针混合液购自Thermo Fisher公司。以GAPDH作为内参,正向引物序列为5′-GCACCGTCAAGGCTGAGAAC-3′,反向引物序列为5′-ATGGTGGTGAAGACGCCAGT-3′,由上海英骏生物有限公司合成。PCR反应条件:95℃ 10 s,95℃ 5 s,60℃ 34 s,共40个循环。由仪器自带软件获取Ct值,采用2-△△Ct公式计算LRRC55 mRNA相对表达量。
五、统计学处理
应用SPSS 24.0软件进行数据分析。胰腺癌和癌旁胰腺组织间LRRC55基因mRNA表达量以M(Q1,Q3)表示,两组间比较采用非参数配对秩和检验法。采用Spearman法或Wilcoxn符号秩检验分析LRRC55基因mRNA表达量与临床特征间的相关性。P<0.05为差异有统计学意义。
结 果
一、胰腺癌组织和胰腺癌细胞株LRRC55基因启动子区CpG岛甲基化水平
LRRC55基因启动子区CpG岛在2例胰腺癌组织和2株胰腺癌细胞株(PaTu8988、ASPC)中为高甲基化状态,平均甲基化率为53%、71%;在2例癌旁组织、2例正常胰腺组织和2例健康成人外周血标本中为低甲基化状态,平均甲基化率分别为8%、11%、9%(图1)。
二、胰腺癌组织LRRC55基因 mRNA的表达
35例胰腺癌组织和对应癌旁正常胰腺组织LRRC55基因mRNA的相对表达量分别为0.21(0.02,1.00)、0.98(0.33,3.66),胰腺癌组织mRNA表达量显著低于癌旁组织,差异有统计学意义(P=0.003,图2)。
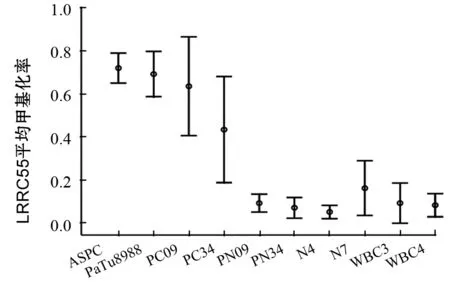
图1 LRRC55基因在各样本中BSP克隆测序结果比较
三、LRRC55基因mRNA表达量与胰腺癌临床特征之间的相关性分析
相关性分析结果显示,胰腺癌组织LRRC55基因mRNA表达与肿瘤分化、CEA(r=-0.423,P=0.011)显著相关,而与患者年龄、性别、肿瘤部位及大小、CA19-9水平、有无淋巴结转移及临床分期均无相关性(表1)。
讨 论
肿瘤的发生发展是多因素、多基因参与的复杂过程,其中包括原癌基因及肿瘤抑制基因的改变、错配修复基因的突变、DNA甲基化和微卫星不稳定性等。DNA甲基化是影响基因表达的重要机制之一,与肿瘤发生有着密切联系,肿瘤中DNA甲基化主要为总体甲基化水平降低和特定区域高甲基化[3,5-7]。基因总体甲基化水平降低导致染色体不稳定、DNA修复基因、细胞周期调控基因、血管形成及细胞凋亡基因相应的CpG岛的甲基化,促进肿瘤细胞的形成[8-10]。在肿瘤细胞中CpG岛DNA甲基化是较为显著的异常表观遗传改变,发生高甲基化的特定区域一般是跨越管家基因和肿瘤抑制基因启动子的CpG岛区,作为表观遗传调控因子能够诱导基因编码区突变或使基因失活而促进肿瘤的发展[11-13]。肿瘤早期即可表现为肿瘤抑制基因甲基化水平的升高,因此异常DNA甲基化认为可用来评估癌症前期进展的潜在早期诊断生物标志物[11]。
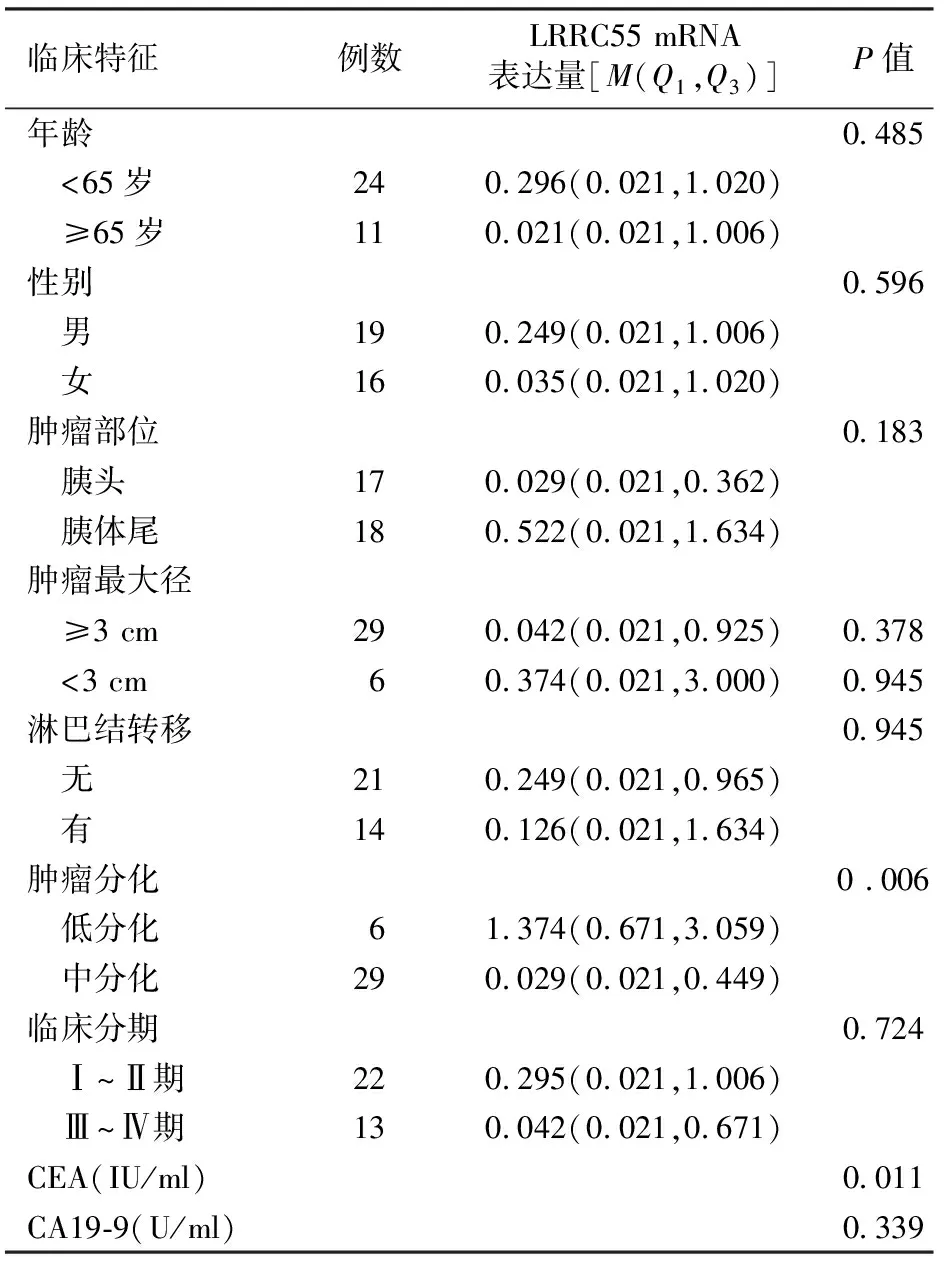
表1 胰腺癌组织LRRC55基因mRNA表达量与临床特征之间的关系
笔者前期应用甲基化芯片杂交筛选出LRRC55基因,该基因定位于11q12.1,有2个外显子,是LRRCγ亚基家族的成员之一,可有效调节BK通道激活的电压依赖性[14]。通道的激活可以同时受到膜电势和胞内钙离子浓度的调控,使钾离子流出细胞外,细胞超极化,细胞兴奋性降低,从而调节细胞多种生理功能。LRR结构域在BK通道γ亚单位的表达、细胞表面转运和通道调节功能的调节中起关键作用[15]。有研究显示LRRC55在成人大脑内侧缰核、小脑和脑桥中表达升高,可能对神经元兴奋性具有独特的影响[16]。LRRC55在局灶性节段性肾小球硬化、糖尿病肾病和膜性肾病患者肾小球足细胞中表达增加,同样在血管紧张素Ⅱ诱导足细胞损伤小鼠模型中足细胞表达升高,可能通过增加足细胞BK通道电流密度产生相应影响[17]。本研究结果表明LRRC55基因启动子区CpG岛在胰腺癌组织和细胞株中均呈高甲基化状态,同时该基因mRNA在胰腺癌组织中呈低表达,并与肿瘤分化程度、血CEA水平明显相关。DNA 甲基化是表观遗传最具有特征性的机制之一,可调控基因的特异性表达,抑癌基因、肿瘤转移抑制基因、激素受体基因和DNA修复基因等启动子区高甲基化可使其表达降低或不表达,而癌基因启动子区低甲基化则使其表达升高,从而促进肿瘤的形成。这表明LRRC55基因启动子区高甲基化,导致其mRNA在胰腺癌中低表达,从而造成肿瘤分化程度的不同。
综上所述,LRRC55基因启动子高甲基化状态可能是胰腺癌发生、发展的早期事件,该基因可能是胰腺癌的潜在抑癌基因。LRRC55是否通过BK通道参与其中还需进一步深入研究,探讨该基因在胰腺癌发生发展中的作用机制。
利益冲突所有作者声明无利益冲突
作者贡献声明金晶:研究操作、数据整理、论文撰写;陈颖、陈燕、于齐宏、庞亚南:研究指导、数据整理;许金芳:数据整理、统计学分析;满晓华、吴红玉:研究操作;吕顺莉:研究设计、研究指导、论文修改

