不同手术方式对颈动脉狭窄患者血尿酸及白细胞介素-6 的影响
李 娜 蔡许超
随着人口老龄化及生活方式的改变,脑卒中已超越缺血性心脏病成为我国首位的致死及致残原因,给家庭和社会带来经济负担。脑卒中的首要原因是颈动脉疾病,其次是动脉血栓形成,动脉斑块脱落和栓塞,动脉夹层形成和内膜下血肿[1-2]。颈动脉狭窄被认为是脑卒中的危险因素之一,颈动脉粥样硬化是颈动脉狭窄最主要的病因,颈动脉内膜剥脱术(carotid Endarterectomy,CEA)及颈动脉支架植入术(carotid Artery Stenting,CAS)是治疗颈动脉狭窄的主要手段。对于短暂性脑缺血发作或非致残性卒中等患者,CEA比药物治疗更有效;对于有临床症状的单侧颈动脉狭窄70%~99%的患者,CEA 能有效降低脑卒中的风险,有效率约为药物治疗的3 倍[3-6]。20%的脑卒中是由颈动脉硬化狭窄引起的[7]。据研究证实,血尿酸(uric Acid,UA)及白细胞介素-6(interleukin-6,IL-6)与颈动脉粥样斑块形成密切相关[8-10],而两者在颈动脉狭窄手术治疗中的变化研究鲜有涉及,本研究旨在通过研究UA 与IL-6 在CEA 与CAS 围手术期的变化,为颈动脉狭窄的手术治疗提供新的思路。
1 临床资料
1.1 一般资料 2018 年6 月至2022 年1 月在杭州市第一人民医院血管外科住院治疗的颈动脉狭窄患者共135 例为研究对象。其中CEA 治疗的患者纳入CEA 组63 例,CAS 治疗的患者纳入CAS 组40 例,另选择同期保守治疗的颈动脉狭窄患者32 例为对照组。本研究所有程序均按照机构和/或国家研究委员会的道德标准进行,并符合1964 年《赫尔辛基宣言》原则。
1.2 颈动脉狭窄诊断标准[3]颈动脉狭窄的诊断主要依据患者的临床症状、体格检查以及影像学检查来确定。目前主要应用于颈动脉的血管影像学检查方法主要包括:颈动脉超声、经颅彩色多普勒、CT 血管成像(CTA)、数字减影血管造影(DSA)。其中,DSA 为检查的“金标准”,一般狭窄50%以下定义为轻度颈动脉狭窄,50%~70%定义为中度颈动脉狭窄,70%以上定义为重度颈动脉狭窄。
1.3 纳入及排除标准 纳入标准:(1)符合颈动脉狭窄诊断标准;(2)行手术治疗的患者需符合行CEA或CAS 手术指征;(3)均完成血清UA 及IL-6 检测且临床资料保存完整;(4)所有患者均接受抗血小板及他汀类药物基础治疗。排除标准:患有或服用可能引起UA 及IL-6 异常的疾病及药物。
2 方 法
2.1 治疗方法 CEA 组患者麻醉成功后沿胸锁乳突肌前缘切口,1%利多卡因封闭颈动脉窦,注意保护面神经下颌支。游离颈总、颈外、颈内及甲状腺下动脉,分别阻断颈内、颈外、甲状腺下和颈总动脉。纵行分别切开颈内和颈总动脉,根据狭窄或闭塞的程度选择是否放置转流管。剥离切除内膜及斑块,颈内动脉远端的内膜缘稍作固定。用肝素盐水冲洗动脉管腔,根据颈动脉腔径是否选择例工血管补片成形。开放颈内动脉使颅血返流排气,再阻断,后依次开放颈外动脉、颈总动脉、甲状腺下动脉、颈内动脉,切口放置引流管后缝合[12]。CAS 组患者麻醉成功后,经股动脉穿刺置入8F 鞘并置入导管和导丝,外周静脉给予1 mg/kg 肝素,放置保护伞,推注造影剂,确定患者颈动脉狭窄的部位和程度,选择合适支架(大于血管内径10%,且能够跨越狭窄段)。沿导丝置入合适的支架释放。手术过程中操作要注意动作轻柔缓慢,防止损伤血管或出现支架移位。对照组患者常规接受二联抗血小板+他汀类药物治疗。其中抗血小板与降脂治疗作为颈动脉狭窄的基础治疗,无论是否接受手术治疗,均贯穿于整个治疗周期。
2.2 实验室指标检测 分别于术前,术后第1、3 天,术后1 周及随访1、3 个月时抽取上肢肘窝正中静脉血液标本,置于-70 ℃冰箱保存。采用美国IL-6 定量检测试剂盒(ELISA)及BECKMANLX20 全自动生化分析仪检测血清IL-6 及UA 浓度变化。
2.3 影像学检查 入院前均行德国西门子ACUSON SC2000 心血管超声,探头频率4 MHz 的颈动脉超声进行检查,测定狭窄率,狭窄70%~99%入院。入院后采用SIEMENS Sensation64 层螺旋CT 颈动脉和脑动脉CT 血管成像。
2.4 统计学方法 应用SPSS 20.0 软件进行数据分析,使用Shapiro-Wilk 正态性检验,符合正态分布的计量资料采用均数±标准差()表示,多组均数比较采用重复测量资料的方差分析,组间比较采用LSD 检验,P<0.05 认为差异有统计学意义。
3 结果
3.1 三组颈动脉狭窄患者一般资料比较 CEA 组63 例,男38 例,女25 例,年龄55~74(62.52±11.15)岁;CAS 组40 例,男23 例,女17 例,年龄55~80(67.32±8.15)岁;对照组32 例,男18 例,女14 例,年龄52~77(63.51±11.12)岁。三组患者的基线资料比较,差异无统计学意义(P>0.05),具有可比性。
3.2 三组颈动脉狭窄患者术前血清UA 及IL-6 水平比较 与对照组比较,三组术前血清UA、IL-6 水平比较,差异无统计学意义(P>0.05),见表1。
表1 三组颈动脉狭窄患者术前血清IL-6 及UA水平比较()

表1 三组颈动脉狭窄患者术前血清IL-6 及UA水平比较()
注:CEA 组给予颈动脉内膜剥脱术治疗;CAS 组给予颈动脉支架置入术治疗;CEA 为颈动脉内膜剥脱术;CAS 为颈动脉支架植入术;UA 为尿酸;IL-6 为白细胞介素-6
3.3 CEA 组及CAS 组患者手术前后血清各时间点IL-6 变化 IL-6 组间、时间及交互作用的整体差异均有统计学意义(F组间=29.685,P <0.01;F时间=516.623,P<0.01;F交互=238.735,P<0.01)。两两比较并结合主要数据分析:组内比较:CEA 组随着治疗时间的进展,IL-6 水平先升高后降低,术后第1 天较术前显著增高(P<0.05),自第3 天开始明显下降,随访至术后3 个月IL-6 恢复至术前水平(P>0.05);CAS 组随着治疗时间的进展,IL-6 水平先升高后降低,后再次升高,其中术后第1 天较术前显著增高(P<0.05),术后自第3 天起至术后1 周IL-6 水平明显下降(P<0.05),术后第1、3 个月较术前显著升高(P<0.05)。组间比较:两组术前IL-6 水平无明显差异(P>0.05),术后第1、3 天,CEA 组IL-6 水平显著高于CAS 组(P<0.05),术后1 周时,两组IL-6 水平接近(P>0.05);术后第1 个月开始,CEA 组IL-6 水平处于下降趋势,CAS 组IL-6 水平高于术前及前一时间点,差异有统计学意义(P 均<0.05)。见表2、图1。
表2 CEA 组及CAS 组患者手术前后各时间点血清IL-6 变化(pg/dL,)
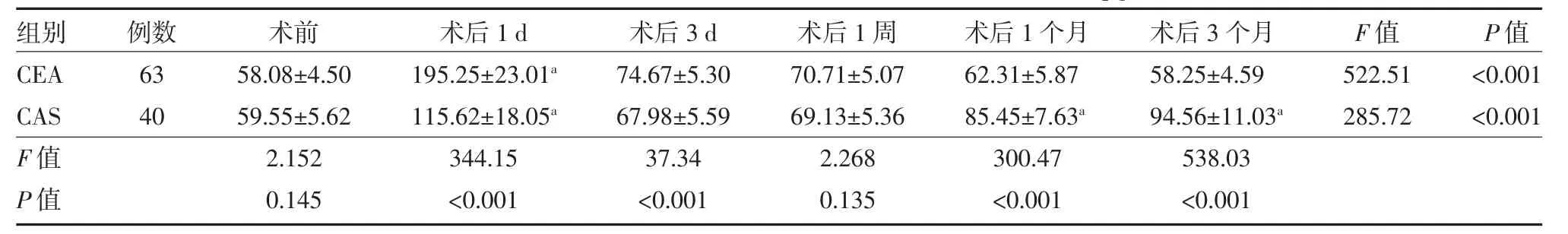
表2 CEA 组及CAS 组患者手术前后各时间点血清IL-6 变化(pg/dL,)
注:CEA 组给予颈动脉内膜剥脱术治疗;CAS 组给予颈动脉支架置入术治疗;CEA 为颈动脉内膜剥脱术;CAS 为颈动脉支架植入术;IL-6 为白细胞介素-6;UA 为尿酸;与同组术前比较,aP<0.05
3.4 CEA 组及CAS 组患者手术前后各时间点血清UA 水平变化 UA 组间、时间及交互作用的整体差异均无统计学意义(P>0.05)。组内比较:两组UA 水平均未随治疗时间变化而发生明显变化,差异无统计学意义(P>0.05);组间比较:两组治疗前后UA 水平相近,差异无统计学意义(P>0.05)。见表3。
表3 CEA 组及CAS 组患者手术前后各时间点血清UA 水平变化(μmol/L,)
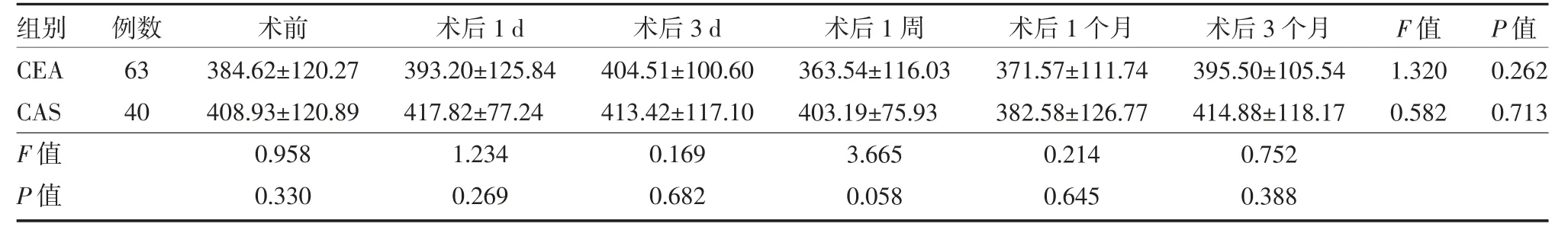
表3 CEA 组及CAS 组患者手术前后各时间点血清UA 水平变化(μmol/L,)
注:CEA 组给予颈动脉内膜剥脱术治疗;CAS 组给予颈动脉支架置入术治疗;CEA 为颈动脉内膜剥脱术;CAS 为颈动脉支架植入术;UA 为尿酸;与同组术前比较,aP<0.05
4 讨论
外科手术是颈动脉狭窄的重要治疗手段,CEA和CAS 同为外科预防缺血性脑卒中的重要手术方案,尽管多数国际指南推荐首选CEA 手术[11],并且有证据证明CEA 手术可以更好地控制围术期乃至中远期再狭窄、心梗、脑卒中及死亡等并发症,但是随着人口老龄化的进展以及材料器械的飞速发展,CAS在临床中的应用越来越多,因此,CEA 与CAS 在选择上仍存在一定的争议[12-13]。通过明确生物学标志与疾病及手术方式的关联,可以减少不良事件的发生,改善患者的预后。
研究表明,高UA 是动脉硬化的危险因素之一,与动脉硬化成正相关[14]。在本研究中,无论CEA 组还是CAS 组的患者与对照组患者之间UA 水平无差异,而两者之间并无明显差异。高UA 和颈动脉粥样硬化的狭窄具有相关性[14],而在对围手术期多个节点的血UA 检测发现CEA 组及CAS 组血UA 水平变化不大,和手术本身及手术方式的选择不具备相关性。在本研究中,由于样本量的限制,未能将斑块的性质、大小、颈动脉狭窄的程度以及生活方式等进行分析,无法进一步分析血UA 的水平是否与颈动脉狭窄的严重程度具有相关性,仍需要进一步的探讨。
IL-6 作为一种潜在的促炎细胞因子,对血管细胞间黏附分子在血管中的表达具有一定的促进作用,可以促进内皮下单核细胞、巨噬细胞的迁移,从而导致动脉粥样硬化形成[15],通过对IL-6 的检测可以预估动脉粥样硬化的进展。本研究也表明CEA组、CAS 组术前与对照组IL-6 水平大致相同,差异无统计学意义。术后第1 天两组IL-6 水平均有增高,差异有统计学意义(P<0.05),两组炎症因子水平均有所提升,其中CAS 组患者炎症因子水平明显低于CEA 组,表明CAS 和CEA 均能引起机体炎症反应的发生,而CEA 组影响更为明显,这可能是由于与CAS 相比,CEA 中使用的全身麻醉,且切口较大,更易在术后引起机体的应激反应,进而使炎症因子水平增加更为明显[16];术后第3 天开始,IL-6 水平降低(P<0.05),表明术后大约在第3 天开始创面愈合,炎症反应明显下降。在术后1 个月时,CEA 组的IL-6 水平持续下降,而CAS 组的IL-6 水平开始增高,之后CAS 组IL-6 水平继续呈上升趋势(P<0.05);在术后第3 个月时,CEA 组IL-6 水平恢复至术前水平(P>0.05);而CAS 组IL-6 水平持续上升,较术前有较大差异(P<0.05)。CEA 的下降可能是内膜斑块的切除后消除了炎症反应,而CAS 的增高可能是因为扩张的支架持续刺激血管内膜,内皮细胞分泌炎性因子IL-6,同时扩张支架刺激血管中膜刺激平滑肌细胞增生,引起再狭窄。当然,如果延长该研究,在术后更长的时间里检测IL-6 水平的变化,能够更好地了解术后IL-6 的变化趋势。
综上所述,血UA 和IL-6 在动脉粥样硬化的形成及进展中扮演了重要角色,降低高尿酸血症患者血UA 水平,减少炎性因子释放,从而达到降低血管事件风险的目的。炎性因子的水平变化也证明CEA在颈动脉狭窄的治疗中仍然优于CAS,所以在条件允许的情况下CEA 仍是首选。

