高岭石与CO2溶液反应实验研究
唐洪明 张文锦 彭东宇 卢浩 唐浩轩 周翊
1.西南石油大学地球科学与技术学院 2.中海石油湛江分公司 3.油气藏地质及开发工程国家重点实验室·西南石油大学
超临界CO2在地质、油气、环保等领域应用广泛,如成岩作用与孔隙演化、基于混相理论的强化油/气开采(CO2-EOR/EGR)、基于吸附理论的驱替煤层气/页岩气开采(CO2-ECBM/ESGR)等,同时在压裂、钻井等领域都有突破性进展,对实现碳达峰和碳中和的“双碳”目标也具有重要意义。CO2注入法和CO2驱油法被认为是开发中最绿色环保的方法[1]。在向地层注入CO2过程中,其形成的弱酸性环境对储层中的矿物会产生一定的影响,尤其是分布在颗粒表面和孔喉处的黏土矿物,外来流体率先与其接触,若反应剧烈且产生固相,可能对储层造成一定损害。
有关高岭石在酸中的行为,一部分学者认为高岭石在酸中反应较弱,尽管高岭石中Al相对含量较高,但受溶液pH值的影响程度仍然弱于蒙脱石与伊利石[2]。酸处理后不仅晶体结构未被破坏,其整体稳定性反而得以改善[3]。高岭石质子交换所需活化能较高,难以突破反应“能垒”,因此在弱酸中以物理吸附为主[4];另一部分学者认为随反应条件的变化,高岭石在酸中有一定程度的化学溶解[5],随温度的升高,高岭石在CO2中溶解速率变化率高于其他黏土矿物[6]。Cama等建立了在酸性条件下pH值和温度对高岭石总溶解速率影响的方程[7]。对于矿物内部各元素的溶解,Carroll等认为低pH值下高岭石溶解速率取决于Al的溶出速率,而高pH值下则取决于Si的溶出速率[8-9]。
国内在高岭石与CO2作用的研究方面大多以岩石整体为实验对象,反应后再拆分研究各矿物变化特征,而不同组分的岩石中单矿物的反应规律并不一致。国外相关研究手段精细但过于单一,且大多以纯水为介质,无法反映实际情况。针对上述问题,避免受不同矿物间结构和组成差异的影响,评价不同单矿物在CO2溶液中的化学特征,本研究优选高岭石为实验对象,利用XRD、XRF、ICP、SEM等手段,探讨其在CO2-盐水体系中的变化特征,为成岩演化提供有力支撑,同时为现场试验开展气/水交替驱可行性研究提供重要参数。
1 实验器材与方案
实验装置主要包括CWYF-1型高温高压反应釜(江苏海安),ZYB-Ⅲ型岩心加压真空饱和装置(分子泵,江苏联友),ICP-OES(Agilent-5110型),ICP-MS(Agilent-7900型),X射线荧光光谱仪(PANalytical-PW2424 XRF),X射线衍射仪(Smartlab 9K),场发射扫描电镜(FEI Quanta 650 FEG),MacroMR12-150H-I型核磁共振分析仪(苏州纽迈)。
注入气体为99.9%(y)工业纯CO2样品。实验流体取自新疆530井区克下组地层水,矿化度为24 000 mg/L,水型为NaHCO3型,反应温度为储层温度(65 ℃),为使反应中的CO2超过超临界态达到液态,反应压力取10 MPa。实验所用样品取自临兴康宁地区石盒子组地区沙溪庙组野外露头,为保证所优选矿物纯度,反应前对其进行标定。X衍射谱线中具有7.1Å、3.58Å(1 Å=1×10-4μm)两个特征峰(见图1)。根据XRF测试,矿物中Si含量大于Al,黏土矿物中以高岭石为主(见表1)。
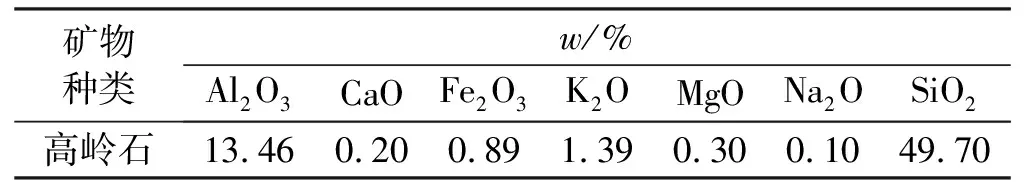
表1 矿物XRF标定结果

为获得反应前后矿物晶体结构、元素含量、矿物形貌及表面元素分布的变化,分别开展矿物粉末、富含单一矿物的岩石碎块与CO2的反应实验研究。岩块岩粉规格、反应装置分别见表2、图2。

表2 高岭石静态反应实验参数表
(1)与岩石粉末反应。①实验前准备:将典型单一矿物样品研磨至0.15 mm粒径后,抽提烘干,制成粉样,并对岩心样进行XRD及XRF测试,标定初始衍射曲线及元素,石英d(101)峰作为标志峰;②静态反应:将固相与液相以1∶3(质量比)混合均匀后装入试管中,再放入反应釜中充分反应,分别于7天、30天取出,并将岩粉与流体分离;③反应后测试:测试元素变化、衍射曲线变化以及反应液离子含量变化。

(2)与岩心碎块反应。①实验前准备:将富含单一矿物的岩石制成1.0 cm×1.3 cm×0.6 cm的若干碎块,将碎块一分为二,并对部分做氩离子抛光,反应前对样品称量(m0),利用扫描电镜观察反应前样品表面形态并做能谱分析,EDS扫描范围为6 mm2×6 mm2;②静态反应:将碎块与流体以1∶3(质量比)装入试管中,再放入反应釜中充分反应,分别于7天、30天取出,并将碎块与流体分离,碎块在清水中浸泡2 h后烘干;③反应后测试:反应后测试反应液离子含量变化,观察扫描电镜下矿物溶蚀、孔隙结构变化、沉淀物产状以及元素分布情况。
反应前后参数变化幅度(率)K的计算见式(1)。
(1)
式中:Ai为反应后参数;A0为反应前参数;A可代表反应物质量(g)、特征峰强度(扣除基线后,cts)、元素相对含量(%)等。
2 结果与讨论
2.1 液相成分变化及分析
高岭石粉末与CO2反应后各离子含量变化均较小。在反应0~7天后,Ca2+的质量浓度由214 mg/L降至182 mg/L(见图3(a))。结合XRD分析可知,此时溶液中产生了CaCO3沉淀;Mg2+的质量浓度由39 mg/L升至76 mg/L,溶液中新增Si4+(质量浓度由0 mg/L增至15 mg/L)、Al3+(质量浓度由0 mg/L增至0.35 mg/L),说明高岭石能够参与反应,但反应强度十分微弱。一方面,存在于高岭石边缘的Al-O八面体和Si-O四面体的Al、Si发生溶蚀作用,但由于在酸性环境中,羟基与H+反应,使黏土带正电性。电荷分布于铝氧二八面体(Al-OH+H+→Al++H2O),此时硅氧四面体比铝氧八面体更稳定,暴露在酸中的Al-O被溶解产生少量Al3+;另一方面,由于黏土矿物由细而分散的含水层状硅酸盐和含水非晶质硅酸盐矿物组成,其本身富含一定量非晶态硅(如硅胶铁石等),这些非晶硅质的稳定性远不及硅氧四面体中的硅,更易于被酸溶蚀。在反应7~30天后,各离子含量趋于平缓,说明反应逐渐达到平衡。在10 MPa、65 ℃下饱和CO2盐水pH值为3.1~3.2,但在盐水中CO2溶解度降低,稳定时pH值可达6.14[10],此时Al3+已开始沉淀。核磁T2谱表明,富含高岭石碎块反应0~30天后峰面积由10 295 a.u.增加至10 458 a.u.(见图3(b)),其变化幅度相对较小,但峰面积总体略有增大,表明高岭石存在轻微溶蚀作用。

2.2 固相成分变化及分析
为进一步明确在实验条件下高岭石与CO2反应的强弱程度,对其中固相组分进行分析,反应前后固相成分变化包括高岭石粉末固相元素和晶面结构变化,以及富含绿泥石岩心微观形貌变化。
反应前后对同一样品进行XRD测试表明,高岭石粉末在反应后两组特征峰变化不明显,反应7天后d(001)仅下降4.2%,d(002)下降6.27%;反应7~30天后d(001)下降2.79%,d(002)下降6.7%,总体下降程度不明显,说明高岭石在反应30天后晶面结构未遭破坏(见图4),而在0~7天内的反应强度明显高于7~30天,结合液相离子含量变化,溶解反应在0~7天内已达平衡。石英峰几乎没有变化,表明体系中未有结晶态的SiO2产生。此外,反应7天后在晶面间距为3.032 Å处有新峰产生,生成的新矿物为CaCO3。随着CO2不断补充,反应不断进行,生成的CaCO3在7~30天内溶解。因此,Al-O八面体的溶解使部分晶格遭受破坏,使特征峰相对强度下降,而整体峰形峰位与反应前保持一致且保存完整,表明反应后总体变化较小。
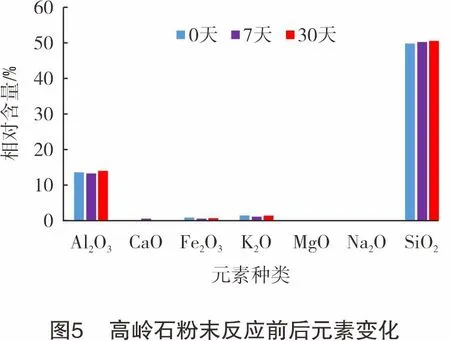
XRF测试结果表明,与反应前固相中元素含量相比,高岭石粉末(44~75 μm)反应前后各元素含量变化较小,反应0天、7天、30天后,Si/Al(质量比,下同)分别为3.69、3.76、3.64,Si/Al基本保持不变,说明CO2对高岭石结构中硅氧四面体和铝氧八面体影响均较小(见图5)。此外,反应0~30天,Ca2+先上升后下降,说明产生了CaCO3沉淀,随后被溶解,与XRD测试结果一致。通过反应前后电镜能谱观察对比发现,反应0~30天,高岭石各元素含量基本无明显变化(见图6(a)~图6(c)),部分片状高岭石边缘可见轻微溶蚀作用,集合体状高岭石未见明显破坏(见图6(d)~图6(f))。溶液中溶解的Si/Al(质量比)介于1~3,即不按高岭石中Si和Al的组成配比进行的,且优先释放硅。这是由于溶解过程中Al3+从高岭石表面的晶格结构中溶出后又重新沉淀。溶解发生在边缘表面,这与Wieland等人的研究结果一致[11-13]。由于在酸性环境中,高岭石边缘的Al-OH羟基与H+结合,使黏土带正电性,电荷分布于铝氧二八面体(Al-OH+H+→Al++H2O),而硅氧四面体无电荷分布,因此硅氧四面体比铝氧八面体更稳定。

3 高岭石与CO2反应机理分析
CO2超临界压力为7.1 MPa,在10 MPa、60 ℃下,CO2在水中的质量分数约为4.6%,黏度约为0.04 mPa·s,密度为0.3 g/cm3,其溶于水中存在如式(Ⅰ)~式(Ⅳ)4个平衡,根据Le Chatelier原理,使平衡(Ⅰ)向右移动,CO2(aq)的增加又会导致平衡(Ⅱ)的产生。碳酸的形成,显著增加了质子(H+)浓度,从而降低体系的pH值。CO2饱和盐水在储层条件下所达到的pH值约为4~5.5[14]。
CO2(sc)+3H2OCO2(aq)+3H2O
(Ⅰ)
H2O+CO2(aq)H2CO3
(Ⅱ)
(Ⅲ)
(Ⅳ)
pH值<4时,高岭石表面形成富Si贫Al层,Al的溶解速率比Si高;在pH值为5~8时,高岭石的Al、Si溶解反应很弱。反应本质是吸附的H+使Al-O-Si键的连续断裂产生Al3+和H4SiO4。在分子间相互作用中,Al-O八面体表面比Si-O四面体表面对CO2的吸附亲和力更大,这是因为高岭石Al-O表面的羟基比Si-O四面体表面的基底O原子具有更高的活性。交换性Na+的存在对CO2的吸附有显著影响,吸附能显著增加,而水分子的存在对CO2吸附强度影响不大。这与唐凤翔等的研究结果一致,只是由于温度压力的不同,使得溶解的pH值范围略有差异[15-18]。由于1∶1的层间结构以及氢键的存在,CO2不易进入层间域,难以破坏其中的硅铝骨架,因此高岭石在CO2-水-矿物体系中较为稳定。实验结果表明,高岭石与CO2的反应较为微弱,结构与性质的改变不明显。
高岭石分子间作用力以氢键为主,由于晶体内部几乎无类质同像替代,其不需活性阳离子(如K+、Na+等)来平衡电荷,因此电荷主要分布在晶体边缘。阳离子交换能力低,外来离子不易进入层间,在酸性条件下较为稳定。此外,高岭石中不含活性阳离子,在成岩演化过程中常作为酸性介质下的产物出现在地层中,是储层条件下相对较为稳定的黏土矿物。也有许多研究表明,高岭石为长石和伊利石等在阳离子较少时与CO2反应的产物[19]。结合前人研究成果,本实验中高岭石溶解平衡受公式(Ⅴ)控制,正向反应强度较弱,反应平衡常数K较小。
Al2Si2O5(OH)4+6H+2Al3++2SiO2+5H2O
(Ⅴ)
高岭石与CO2反应具有的意义:一方面,高岭石在酸中的稳定性进一步证实了成岩演化中酸性流体注入后各类黏土矿物的转化方向;另一方面,若储层黏土矿物含量较高,且以高岭石为主,当CO2注入该储层时,其对储层影响较小,矿物捕集类型应以物理吸附作用为主,而非化学固碳作用。
4 结论与认识
(1)高岭石与CO2反应后整体变化较小,反应30天后晶面结构未被破坏,固相中Si、Al含量变化较小,液相中新增Si4+、Al3+,微观形貌变化较小,集合体未见明显溶蚀,片状单体可见轻微溶蚀。
(2)高岭石与CO2反应后溶蚀作用较弱,从成岩演化上看,高岭石形成于酸性环境;从结构上看,Si与Al不按1∶1溶解。在酸性条件下,高岭石边缘的Al易与H+结合,使Al-O八面体稳定性弱于Si-O四面体。
(3)0~30天内,高岭石在CO2溶液中稳定存在的原因有:其分子间作用力为氢键,Al-O八面体和Si-O四面体在结构上排列紧密;其不存在类质同像,不含低价态活性阳离子。
(4)对于CO2与高岭石的物理吸附作用需进一步做比表面测试。流体中油对CO2溶解度及反应进程也有一定影响,需结合含水饱和度开展富高岭石岩心动态驱替实验,更全面地分析论证反应规律。

