CRISPR专利争夺的启示
朱雅姝
安砾
2020年的诺贝尔化学奖授予了CRISPR基因编辑技术及其发明者,也由此将长达10年之久的CRISPR专利争夺战推到了大众视野之中。CRISPR基因编辑技术是一项典型的源自科研院校基础研究的成果,在其科技成果转化过程中出现的专利纷争,揭示了美国院校及发明人的专利运营策略。通过尽可能详尽的资料调研,可以了解到其中涉及的专利申请、全球布局、竞争保护等直接影响成果转化成败的因素,从而为我国优化基础科研成果转化路径带来重要的启示和借鉴意义。
前言
基于CRISPR系统的基因编辑技术无疑是目前生物技术领域最具革命性的突破。这个被称为“基因魔剪”的技术,在被发明还不到10年之后就获得了2020年诺贝尔化学奖。
但是,在CRISPR领域迅猛发展的同时,CRISPR技术发明人之间的专利纠纷也鏖战多年。一方是哈佛大学和麻省理工学院博德研究所(Broad Institute)的张锋团队(以下简称张锋团队),另一方是加州大学伯克利分校、维也纳大学和埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)的团队(以下简称CVC团队),CVC团队中的核心成员Jennifer Doudna和Emmanuelle Charpentier正是诺奖获得者。双方自2013年起均基于该技术创立了多家公司,并对全球其他不同应用领域的公司有多方授权,所创公司多数已上市,专利战也由此开始。双方专利战的最终结果不仅直接影响所创企业的市值,而且会影响已经获得部分授权的公司是否构成侵权,或者其他公司需要向谁支付专利许可费用等商业利益。
这场事关百亿美元市场的纠纷已经持续了10年之久。在欧洲,CVC团队暂时处于上风,张锋团队屡屡受挫;但在北美张锋团队获胜,2022年2月28日美国专利和商标局(USPTO)裁定张锋团队拥有在真核细胞中使用CRISPR基因编辑技术的专利。这也意味着CVC团队失去了该技术在最重要的应用领域的专利优先权,即无法应用于医疗、育种等真核生物领域。而且,从CVC团队获得专利许可的公司有可能要重新考虑向张锋团队申请授权。
CRISPR的专利之争是一场非常典型的涉及学院派科技成果转化过程的专利纷争,其中包含了专利竞争策略、专利布局战略、专利申请模式和专利运营模式的信息。其发明人所创立的成果转化公司经历融资、上市甚至并购,成果转化模式也清晰明确。在此,本文会对CRISPR技术研发和全球专利现状进行简要的全景概览,重点对两大团队的专利纠纷过程进行分析对比,解析其专利运营模式和竞争策略,提炼关键因素或借鉴方案,以期为基础研究领域新技术成果的转化应用带来有价值的启发。
CRISPR技术的背景概述
科学技术相关发明专利的申请离不开科学原理的发展,通过对研究历程的路径梳理,可以更清晰地看到科技成果的专利化运营思路。值得注意的是,通过对全球专利态势的研究,可以看到我国在专利运营和布局策略上的不足,也从而为进一步增强我国科技成果转化实力指引努力的方向。
基因编辑的概念及CRISPR技术的意义
科学家们探索生命运行机制时,需要修改细胞中的基因进行分析研究,被称之为基因编辑(Gene Editing),即对生物体基因组特定目标基因进行修饰的基因工程技术或过程,可以实现对目标基因的敲除、插入和突变校正。早期的基因编辑技术包括:同源重组、锌指核酸酶(ZFNs)、转录激活样效应因子核酸酶(TALEN)等;但由于这些技术精准度不够,操作复杂、效率低,而限制了其广泛的商业化应用。
2012年基因编辑出现革命性突破——CRISPR/Cas9系统技术被证明在试管中能够精确切割DNA,成功编辑基因组,使得科学家们能在几周内精准改变生命密码。正如诺贝尔化学委员会主席克拉斯·古斯塔夫森所说:“这种基因工具拥有强大的力量,影响我们所有人。它不仅使基础科学发生了革命性的变化,而且制造出了新奇的作物,并将催生开创性的新疗法来治愈很多疾病。”因此,自2012年被发明以来,CRISPR系统技术备受资本市场瞩目,相关专利权的归属争夺决定着资本各方的直接利益。
CRISPR专利全球态势概况
第一,专利保护具有严格的地域性特点。地域性是专利保护最重要的特质之一,即各国主管机关依照其本国法律授予的知识产权,只能在其本国领域内受法律保护。如果专利权人希望在其他国家享有专利保护权,就必须依照其他国家的相关法律另行提出专利申请。所以两大团队在美国提出专利申请的同时也在欧洲提交申请。专利纠纷也分属两个地域,并须依据当地法规进行裁定。
第二,近年全球CRISPR/Cas9相关专利数量突飞猛进。随着近10年的研发,以CRISPR技术体系申请的相关专利数量飞速增加。2006年最早开始出现CRISPR/Cas9的专利申请,但直至2012年底之前,有关专利均不涉及基因编辑领域的应用。2012年开始,CVC团队和张锋团队相继在欧美申请了CRISPR系统用于基因编辑领域的专利,自此,全球CRISPR/Cas9基因编辑技术专利数量呈现爆发性的增长,并且在之后几年里持续走高(见图1)。2013—2016年间全球相关专利申请数量达到年均增长率89%,2019年达到顶峰。基于incoPac数据,截至2022年3月,全球共计申请数量6936件。
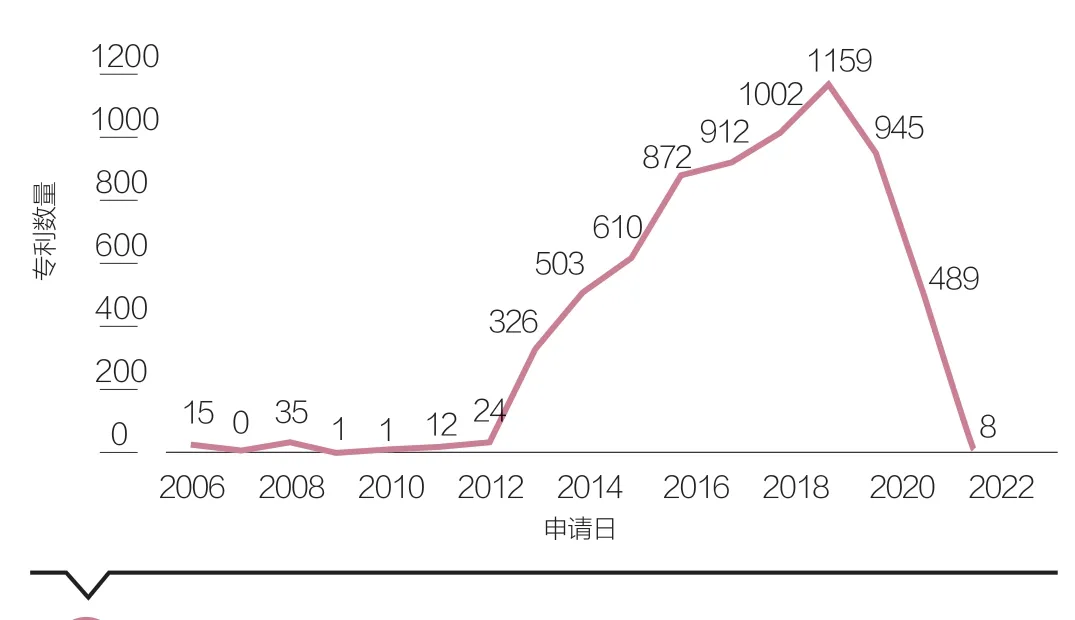
图1 2003—2022年CRISPR/Cas9相关专利申请数量变化趋势
两大团队在该领域占据主导地位并且竞争激烈。通过分析申请人可见,美国为主要申请人所在地区,全球申请数量位列前三名的分别是博德研究所、麻省理工学院、哈佛大学,均属于张锋团队,并多为共同申请,三者合作紧密度极高。第4位的Editas Medicine公司由张锋-George Church创立。第13、14位的Caribou Biosciences、CRISPR Therapeutics公司由CVC团队的Jennifer Doudna和Emmanuelle Charpentier分别创立(见图2)。
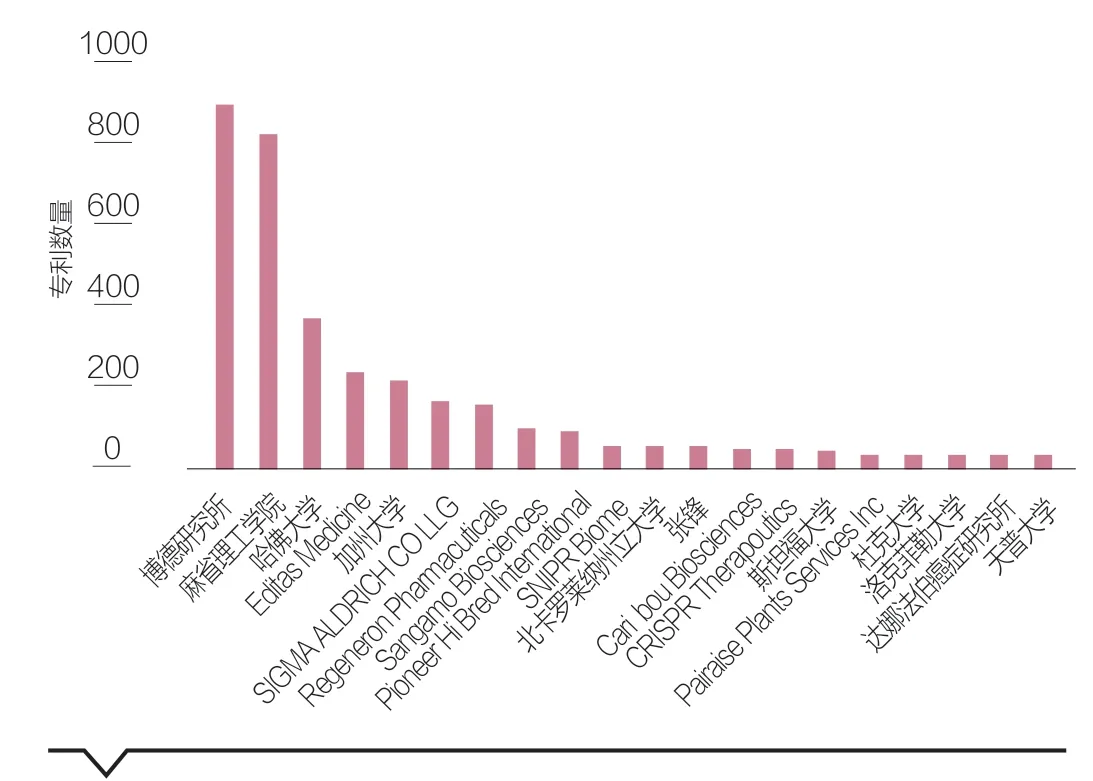
图2 全球CRISPR/Cas相关专利申请数量TOP20
国际大型企业对新技术领域的专利布局极为重视。图2中除了两大专利竞争团队成员(院校、个人及其创业公司)之外,最典型的就是几家国际大型企业了。如位于前十的申请人就有:Sigma-Aldrich(著名的全球化学及农业领域的美国企业)、再生元制药(Regeneron Pharmacuticals,是一家美国的全球性生物制药公司)和Pioneer Hi Bred(源自美国陶氏杜邦的一家全球种业公司),它们的2021财年全球销售额都在百亿美元以上。而这三家企业所覆盖的商业领域,正是CRISPR基因编辑技术的典型应用场景——农业、合成化学、医疗。可见作为全球性的大型企业,在新兴科技领域的技术跟踪、专利布局上都有着极其敏锐的嗅觉和极快的执行速度。
我国在全球该领域专利申请数量中的占比越来越大。随着我国在基因编辑领域的科研实力与知识产权保护意识不断增强,国内专利申请数量紧追而上。基于PatSnap数据,截至2022年3月全球申请人中,我国排名前十的申请人主要包括:中国科学院遗传与发育生物学研究所为首,以小麦农业安全生产等遗传育种研究为主;其次为中国农业大学、北京大学、博雅辑因(北京)生物科技有限公司、山东舜丰生物科技有限公司、华中农业大学、上海科技大学、江南大学、百奥赛图(北京)医药科技股份有限公司、中国农业科学院作物科学研究所等。我国专利在技术上着重于其产业化领域的应用,其中农业育种领域的应用占有较大比重;专利权人之间的研发合作较少;专利出海布局的更少。
美国是全球该领域关注度最高的技术争夺市场,我国是最重要的专利布局国家之一。截至2022年5月的incoPat全球专利优先权国别分析:美国以2904件位居第一;中国受理量排位第二,达到了613件;欧洲专利局以215件位列第三。由于我国在医疗、农业、工业等应用领域拥有着巨大的市场,外国申请人从一开始就注重全球化布局,占据我国专利池优势。2013年我国在CRISPR/Cas9基因编辑领域的35件专利申请中,就有23件来自国外机构与企业。其中,美国是最重视全球专利布局的国家,截至2019年国外在中国申请CRISPR相关专利最多的是美国,专利申请量为591项,占国外在我国申请专利总数的73%。
综上,CRISPR/Cas9编辑技术比较活跃的国家包括中国、美国、欧盟、日本等相关国家和地区,其中美国在该技术领域具有绝对的优势和影响力,也可见美国基础科学的创新能力之强大。CRISPR相关专利技术应用领域主要集中于医学、农业和工业领域;其中,医学是最大的应用领域,其专利产出量约为工业和农业领域专利数量的总和。
从技术角度可以看到中国专利申请上的关键差距:其一,部分专利来源于其他国家在该领域的技术布局,而非我国自身的科技创新成果;其二,部分专利虽是我国科研成果,但侧重于生物育种、医疗中的应用,而非基础研究的开创成果,这部分可能涉及来自底层核心技术的基础专利的许可。也意味着在未来商业化中,可能要依赖国外专利权人的专利进行实施,从而产生相关技术许可与转让费用。
两大发明团队之间的专利争夺
CVC团队在论文发表及专利申请的时间上均早于张锋团队,但专利授权时间晚于张锋团队,授权的技术内容有所不同。两大团队展开了长达十多年之久的专利争夺战,其重点在有关真核生物的应用方向上。
两大竞争团队的科学发现及核心专利申请状况
CRISPR/Cas9系统被证明作为新一代的基因编辑工具而发表在国际顶级学术期刊的时间是2012—2013年。同期有三个科研团队分别独立发布了研究成果,相关核心技术的专利申请都是提前进行。
CVC团队方面,成员包括:Emmanuelle Charpentier和加州大学伯克利分校的Jennifer A.Doudna。发表论文包括:2012年8月两人合作在Science发表论文,首次阐述清楚了CRISPR/Cas9系统的基本原理(这是获得诺奖级别的奠基性工作),并解析了crRNA:tracrRNA复合体与Cas9蛋白的基因编辑功能,证明了CRISPR/Cas9能够作为新一代的基因编辑工具,只是其研究均是在细菌等原核生物上进行的。申请专利方面,最先在欧美申请,但美国授权时间晚于张锋团队,授权内容不同。
1)欧洲:2012年加州大学伯克利分校(CVC团队)率先在欧洲专利局提交了将CRISPR/Cas9基因编辑技术用于无细胞(Cell-free)系统中的专利申请。欧洲专利局分别于2017年5月13日和2018年2月28日准许了不同保护范围的授权。
2)美国:(申请号:13/842859)专利优先权日为2012年5月25日(在美国专利局最初的临时申请日),申请日是2013年3月15日。同族专利在美国的专利授权时间更晚,为2018年6月19日,并且仅授权了基因编辑的方法,而涉及的RNA序列及复合物、实验试剂盒的权利要求尚在审查中。
张锋团队方面,成员包括:哈佛大学-麻省理工学院博德研究所的张锋、丛乐(张锋学生)以及刘如谦(David R.Liu,化学生物学和治疗科学项目主任)。发表论文方面,2013年1月3日,张锋作为通讯作者,张锋的学生丛乐作为第一作者在Science发表论文,介绍了如何将CRISPR基因编辑技术应用于小鼠与人类的细胞之中(这是首次证明真核细胞中可以应用CRISPR系统),并且证明了可以一次性利用几段不同向导sgRNA来实现对基因组的多点精确操作,效率非常高。申请专利方面,在美国通过加速审查获得优先授权,但在欧洲的申请被撤销。
1)美国:博德研究所(张锋团队)在美国先提交了CRISPR/Cas9基因编辑技术在体外用于真核细胞的专利申请(申请号:No.8697359),其专利优先权日是2012年12月12日,申请日2013年12月12日。值得注意的是,张锋的律师提出快速处理这项应用专利申请的要求,利用了“适用专利加速审查程序”,于2014年4月15日先被授予一项专利权(US201314054414A)。之后一年,相继又批准了十多项专利申请。
2)欧洲:在欧洲提交的专利申请并不顺利。2018年3月23日,欧洲专利局(EPO)的反对部门(OD)认为优先权要求无效,并因缺乏新颖性而撤销了其专利。
George Church团队方面,成员包括:哈佛大学医学院的George Church(张锋的博士后导师)和杨璐菡(George Church的学生,当年秋季毕业)。发表论文方面,2013年1月3日,George Church作为通讯作者,杨璐菡作为第一作者在Science杂志上发表论文,证明CRISPR系统可用于人类细胞基因组编辑(与张锋同期,首次证明真核细胞中可以应用CRISPR系统)。申请专利方面,该团队与张锋团队在之后的成果转化中保持密切合作,既有共同申请专利也有共创公司,因而在之后的专利竞争中处于同一战队中。
两大团队专利权争夺的焦点
自2015年起,两大团队为CRISPR/Cas9系统(包括真核细胞在内的)的基因编辑技术专利权归属展开激烈争夺。由于专利法规有典型的地域性特点,在此对美国和欧洲的专利诉讼分别进行解析。仅基于已有的公开资料,通过技术和法理的梳理,可以揭示专利保护及布局策略的关键信息。
第一,美国地域的专利诉讼相对更为激烈和复杂。张锋团队在美国2014年起优先获得授权。2015年起,CVC团队在美国地域内提出专利诉讼,屡次败诉。
专利争议所涉及的法律依据包括:一是发明人先申请制。《美国专利法》中关于先完成人和先申请人的发明授予规定为“先申请制”,以专利申请日作为标准确定专利申请的顺序,最先提出专利申请的人优先取得专利。如果两人各自独立完成了相同的发明并申请专利权,原则上应授权给申请日在先的发明人。
为确保公平,对于披露,设置了宽限期1年的时间规定,即发明人在其专利申请日的前1年之内所作出的披露不会使其丧失此项发明的专利;或者在其专利申请日的前1年之内发明人与他人均披露了此项发明,但发明人的披露行为早于他人的,同样不影响发明人取得专利权。这一项特殊规定,使得公开披露发明内容不会影响到“新颖性”这一必要专利审查条件。在科研界,科学家通常都会发表学术论文以公开其学术发现。当两位科学家各自独立完成了相同的发明之后,都发表论文公开了各自的发明,而且都在公开一年之内申请专利,此时先公开者才可能被授予专利权。据此,美国实际执行的是发明人先申请制。
只看时间点的话:两大团队均是在发表论文前先申请专利,CVC团队无论是论文发表时间还是专利申请日(优先权日)均早于张锋团队。
二是被授予专利还须满足的实质性条件:非显而易见性。《美国专利法》第103条规定了判断具有非显而易见性的条件,即要求保护的发明与现有技术之间存在差异,在申请日之前(《美国专利法》修改前为发明日前),该差异对于本领域内普通技术人员来讲不是显而易见的。这个差异是指技术层面上已经实现的差异。对非显而易见性的判断较为灵活,专利审查人员需要充分的专业知识,拥有一定的自由裁量空间。
对于张锋团队所申请专利的技术是否为其他普通技术人员无法显而易见地掌握的,是否为无法显而易见地从CVC团队申请的专利中获得,这就决定了能否认定张锋团队是一项新的发明。
争议焦点方面:一是是否为同一发明。CVC团队的专利是在细菌(原核生物)和体外Cell-free环境中应用CRISPR/Cas9技术系统进行基因编辑。张锋团队的专利是在小鼠和人类细胞(真核生物)中应用CRISPR/Cas9技术系统进行基因编辑。那么,从专业领域进行判断和认定,CVC团队的应用范围是否包括了张锋团队的应用就至关重要了。为此,张锋团队提交了上千页的材料(包括实验记录、对方公开场合的演讲等)以举证这是一项完全新的发明。
二是谁是发明的先完成人、先申请人。这一点的判断是从属于第一条认定为同一发明的,如果不是同一个发明也就不存在先后之争了。但如果CVC团队能证明张锋的发明是本质上相同的,那么以先完成人和先申请人的优势即可夺得专利权。
因此,CVC团队在2015年首次诉讼时,认为两者专利本质上属于同一发明,而要求美国美国专利与商标局(USPTO)启动冲突审查程序,以确定与CRISPR/Cas9系统相关的美国专利的所有权。所以,张锋团队如何举证是至关重要的。
最新裁决:张锋团队是一项新发明的先申请人。2022年2月28日美国专利和商标局最终裁定:张锋团队拥有在真核细胞中使用CRISPR基因编辑技术的专利。裁定要点是,CVC团队没有证明他们是第一个在动物细胞中使用CRISPR的人,其最初论文只是描述了它在细菌中的用途。因此,张锋团队是这项发明(在真核细胞中使用CRISPR基因编辑技术)的先完成人和先申请人,并且这是一项有别于CVC团队专利申请的新发明。
第二,欧洲地域的专利诉讼涉及国际专利的申请模式。CVC团队在欧洲专利局2012年率先提交申请,并于2017年起获得授权。2019年张锋团队提起上诉,但专利申请被撤销。专利争议所涉及的法律依据方面,涉及专利的海外布局策略,即选择最适合的海外专利申请的方法和途径,从而既高效又安全地获得全球不同国家的专利授权。依据国际专利组织的公约,申请海外不同国家的专利有三种途径:
直接申请途径:直接向目标国家的专利主管机关递交申请文件。由于准备材料烦琐,流程缓慢,会出现被别人抢先申请的风险。因此国际上常用的是以下两种方法。
《巴黎公约》途径:通过《巴黎公约》向所须申请的国家递交申请文件。
PCT途径:通过PCT(Patent Cooperation Treaty,专利合作条约)途径递交申请文件。
不同途径之间较为关键的是对优先权日的相关规定。但最终是否授予专利,依然由所进入的目标国国家专利法规及审查来决定。因此,在国际申请时,既要明确选择申请途径的策略,又要严谨准备以满足国际申请条件和目标国法规规定。
争议焦点方面,一是优先权是否有效,二是是否符合目标国专利法规。此处争议焦点均取决于申请人在申请时是否严格遵循了所选国际申请途径的法规,手续是否合规。张锋团队在欧洲的申请是通过PCT途径进入的,其要求遵从美国临时申请的优先权,以占据专利先申请制的优势,并以此在2019年提出上诉。但是在2020年1月欧洲专利局的裁定中败诉。因为,根据欧洲专利公约要求,通过PCT途径的申请,在进入欧洲专利局审查阶段时,要求必须前后两个申请的申请人是一致的。但美国的一项申请中存在PCT申请中没有提到的申请人。因此被欧洲专利局撤销其专利申请。所以,未符合目标国专利法规的要求,成为败诉的关键。
专利诉讼历史关键事件方面,自2015年起,两大团队分别在欧洲和美国的专利局提出申诉。为便于比较和理解,关键信息列于表1。

表1 专利诉讼历史关键事件
可见,双方团队在CRISPR专利权持有领域中,各有胜负。张锋团队虽然获得了美国地域的专利权,拥有了在真核细胞中使用CRISPR基因编辑技术的专利,但是在欧洲地域的专利申请未获得任何有效进展。另一方CVC团队在欧洲地域被授予了专利权,但在美国地域的专利诉讼中失败,不再具有CRISPR/Cas9基因编辑技术在真核细胞中的专利。
专利诉讼结果对商业赛道的影响巨大
2022年2月28日的这一最新裁决对于国际基因编辑商业赛道的影响是巨大的。股市动荡是最快速的效应之一,直接影响到由发明人创立的衍生公司。在此消息公布的随后纳斯达克周一盘后交易中,Editas Medicine公司(张锋团队创立)股价上涨了8.2%,而Intellia Therapeutics公司、Caribou Biosciences公司(CVC团队创立)股价分别下跌了9.75%和8.8%。
更深远的影响则是对已从CVC团队获得专利许可授权的在美运营的第三方公司,例如生物技术公司SAGE LABS、医药公司NOVARTIS以及CVC团队自己创立的IntelliaTherapeutics、CRISPR Therapeutics等。他们将面临无法在美国继续应用该技术开发人类疾病治疗、农业育种等方面的商业市场,并可能承担巨大的已支付等专利许可费用的损失。为此,他们还必须与张锋团队再进行商谈以确认是否可以再获得相关领域的授权。
然而,CRISPR的专利纠纷并没有终结,至今也没有完胜的赢家。因为CRISPR基因编辑是一种平台技术,在医疗上有广泛的用途,这场纠纷很可能未来会以法律和解、交叉许可协议甚至专利池的形式结束。由于双方仍有许多索赔和反诉悬而未决,这一问题可能需要数年时间才能完全解决。张锋团队在一份声明中表示,他们愿意达成和解,并表示“所有机构应该共同努力,确保技术获取的广泛性、开放性,并继续探索如何最好地实现这一点”。
专利纠纷的胜诉因素启示
专利申请策略遵循时间优先原则
在科学论文发表和专利申请的时间点上都是尽早申请原则。但这二者之间的先后顺序,需要考虑各地域专利法规对新颖性的评判标准(披露规则)。现实中,多以最严格的标准来执行,即申请专利在先,尽量不公开披露任何发明信息。由于美国2013年3月16日专利法的变更,使得这个时间点很容易成为一个关键性争议节点。而由于CRISPR的文献发表和专利申请恰巧跨越2012—2013年,因此在审查及后续诉讼争议时会涉及两种法规依据。很明显,两大团队对其专利保护的策略均采取了国际上通行的从严标准——先申请,并尽早披露。可见,这样的策略可为其后续对抗争议建立一些可依据的法理基础。
同时,需要熟悉专利法规的细则和操作方案,能够在多团队拼速的情况下,运用一些特殊规定申请加速专利审查流程,最早获得授权。
专利布局策略须具有前瞻性对全球考量
专利保护涉及全球范围,如何制定全球专利布局策略,规避未来的竞争风险,都是需要在专业人士的支持下尽早考虑的。本案例中,双方团队都利用了自己的地域优势,分别优先在欧洲、美国申请;同时也都开展了全球申请策略,包括PCT申请。
在申请时就需要采取一些策略以便获得布局优势。常用的一个策略是,使其知识产权组合多样化,从而优先获得先前专利申请的后续翻新。例如张锋团队发现并申请了Cpf1的专利保护,这是Cas9蛋白的一个强有力的替代品。
专利保护需要大量充分、有说服力和可信度的证据材料
在早期开展科学研究的时候即具有专利认知,能够保留所有详实、有效的实验记录和数据,以备未来有可能遇到专利诉讼时作为证据维权。同时需要具有在整个专利生命期内的留存证据意识。
专利运营必须有专业的专利代理人或律师支持
毋庸置疑,专利代理人或律师的专业度是决定胜负的关键。熟悉全球专利法案、规则;能够基于现实情况做出有利的方案选择和判断,识别优势证据,清楚准确的主张诉求等,每一个细节都不可或缺。
例如,张锋团队在2017年第一次的“专利干预”重审时就强调,双方的专利权主张是完全不同的两个内容,而不是基于对方先申请人的主张上对峙:张锋团队是将CRISPR/Cas9系统限定于真核细胞使用,而CVC团队只是在描述CRISPR/Cas9系统,并未限定于任何应用环境之下,因而是完全不同的发明。同时,向USPTO提供了证据,证明真核细胞中的使用并不是显而易见的;使用CVC团队专利中的CRISPR/Cas9常规实验操作是无法在真核细胞中成功编辑基因的。可见,专利律师在其中必然发挥了关键作用。
专利转化的前景取决于科学家的研究洞察力
科学家具有敏锐的科研洞察力,能够清楚判断所研发成果的应用价值领域,以及其对未来商业化的准确认识,是至关重要的。这才是决定研究方向、技术成果的应用领域,以及专利申请的主张范畴的基石。CVC团队最大的失误就是没有将真核细胞纳入其专利申请范畴。然而该技术最大的潜在经济价值几乎都在真核生物领域——人类医疗、植物育种改良等。张锋团队则从一开始的基础研究就专注于真核生物,或许他们很早就意识到了该技术未来能发挥最大价值的领域。
专利转化离不开科学家所在院校的鼎力支持
以上所有的关键因素,都是基于科学家所在院校的大力支持。本案例中,双方团队背后所依靠的院校才是最关键的支撑。科学家并不具备专业的专利系统知识,也没有足够的精力去应对冗长繁杂的国际诉讼。无论是在早期的科研环境支持上,还是后期成果转化、专利申请、专利布局和专利诉讼中,都可以看到所在院校的支持力量。加州大学和麻省理工学院都有非常成熟的科技成果转化支持体系,比如麻省理工学院设有技术授权办公室(Technology Licensing Office,简称TLO),负责校内从发明披露、技术评估、专利保护到最终商业价值转化的典型大学技术转移流程,不仅流程清晰高效,工作人员也极为专业。

