水稻甲基转移酶家族成员OsMT1 突变体的创建及功能分析
田 瑶,王馨翊,王 鑫,兰志鹏,周诗晨,杨晓颖,胡又川,梁闪闪,张泗举,栾维江
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
甲基转移酶是一类能够催化甲基化反应的酶,通常以S-腺苷-L-甲硫氨酸(SAM)为甲基供体,在调控动植物生长发育中具有重要作用.根据所选择底物的不同,可将甲基转移酶分为遗传物质甲基转移酶和非遗传物质甲基转移酶[1]. 遗传物质甲基转移酶可以催化遗传物质DNA 的甲基化反应,以SAM 为甲基供体,将甲基转移至靶序列的特定碱基上.非遗传物质甲基转移酶主要以SAM 为甲基供体,以激素、蛋白质残基及芳香族化合物为底物[2],将甲基转移至这些底物上,参与染色体的形成和激素及激素衍生物的合成. 近年来,科学家们对以激素作为底物的甲基转移酶家族进行了深入的研究,并以最早鉴定出的水杨酸甲基转移酶(SAMT)[3]、苯甲酸甲基转移酶(BAMT)[4]和可可碱合酶(TCS)[5]为基础,将其命名为SABATH 家族. Seo等[6]、Qin 等[7]和Hippauf 等[8]发现SABATH 家族成员还可催化茉莉酸(JA)、吲哚-3-乙酸和苯甲酸/水杨酸(SA)等发生甲基化反应,使SABATH 家族进一步扩大.
模式植物拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)中分别有24 和41 个SABATH 家族成员[9],其中大多数成员的功能未知.在拟南芥中,AtJMT 是一个JA 甲基转移酶基因,在不改变茉莉酸含量的情况下,过量表达AtJMT 可以使内源茉莉酸甲酯的含量增加3 倍[6].水稻中OsJMT1 能甲基化JA,过量表达OsJMT1能够提高水稻基础和褐飞虱诱导的茉莉酸甲酯(MeJA)水平,从而调节植物的生长和防御[10].在水稻中过量表达OsJMT1 会影响水稻的小穗发育,使籽粒产量下降[11].本研究利用CRISPR-Cas9 基因编辑技术对水稻SABATH 家族中的OsMT1 基因进行编辑,获得转基因植株,对编辑植株进行测序分析,得到目的基因的突变体材料,并利用该突变体对OsMT1 基因的功能进行探究.
1 材料与方法
1.1 材料
粳稻品种中花11(Oryza sativa L.ssp. Japonica cv.Zhonghua11)及其CRISPR-Cas9 基因编辑材料.
1.2 CRISPR-Cas9 载体的构建
首先从NCBI(www.ncbi.nlm.nih.gov)数据库中获得OsMT1 基因的序列,分析该基因的结构域,将靶点设计在结构域前或结构域中.之后利用E-CRISPR 在线设计平台(http://www.e-crisp.org)分析OsMT1 基因的编码序列,按照(N)20NGG 的特点选择合适的靶点,并对靶点序列进行比对,选择特异性好的靶点.按此原则,最终在OsMT1 基因的第2 个外显子上选择了2 个靶点(TG1 和TG2),靶点TG1 的序列为5′-TCGAGGAAGCTCACGCGTCGC-3′,TG2 的 序 列 为5′-CCTACTGCCTCATGTGGCGC-3′.利用PCR 扩增出含有靶点的目的片段,与含有sgRNA 结构的载体进行连接,获得U6a::TG1-sgRNA 和U6b::TG2-sgRNA 融合载体.用Bsa I 对U6a::TG1-sgRNA、U6b::TG2-sgRNA 以及CRISPR-Cas9 载体进行酶切后,再使用T4 DNA 连接酶进行连接,获得最终的重组载体.
1.3 转基因植株的分子检测
利用鉴定正确的CRISPR-Cas9 重组载体,通过农杆菌介导的遗传转化法获得转基因植株,用CTAB 法提取每个单株叶片的基因组DNA,再利用载体上特有的潮霉素标记基因进行PCR 分子检测. 检测引物Hyg-F 的序列为5′-GGAGCATATACGCCCGGAGT-3′,Hyg-R 的序列为5′-GTTTATCGGCACTTTGCATCG-3′.扩增程序为:95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30 个循环,72 ℃终延伸7 min,4 ℃保存.
1.4 转基因植株的突变类型分析
构建CRISPR-Cas9 重组载体时,设计了2 个靶点(TG1、TG2),由于2 个靶点之间的距离较远,因此设计2 对特异性引物分别进行检测. 检测引物的序列如表1 所示.经过PCR 扩增和琼脂糖凝胶电泳检测后,将扩增产物送至生工生物工程(上海)股份有限公司进行测序,得到结果后,通过DSDecodeM 网站(http://dsdecode.scgene.com/)对突变位点进行解码,并将测序结果与野生型序列进行比对,分析突变类型.
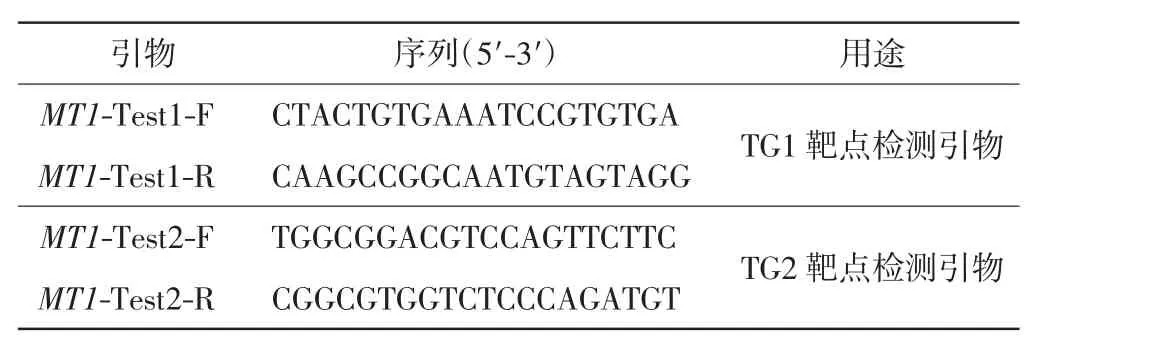
表1 OsMT1 基因编辑位点的检测引物及序列Tab.1 Primers for the detection of the OsMT1 editing sites
1.5 盐胁迫处理及表型统计
选取成熟且饱满的野生型种子和不同编辑类型的突变体种子进行消毒,在34 ℃恒温箱中催芽.将催芽后的种子分别摆在含有50、100 及150 mmol/L NaCl的Agar 培养基上生长,以不含NaCl 的Agar 培养基作为空白对照.在28 ℃、12 h 光照、12 h 黑暗循环的条件下培养7 d 后,分别测量野生型和OsMT1-CRISPR编辑突变体的地上以及地下部分的长度,拍照记录.
2 结果与分析
2.1 CRISPR-Cas9 载体的构建
OsMT1 基因序列的全长为2 180 bp,含有4 个外显子和5 个内含子,编码序列总长为1 143 bp,共编码380 个氨基酸,第2 至4 个外显子上含有SAM 依赖性羧甲基转移酶(Methyltransf_7)结构域,因此在第2 个外显子上选择TG1 和TG2 2 个靶点,如图1(a)所示.将2 个靶点分别连接到含sgRNA 结构的表达载体中,获得U6a::TG1-sgRNA 和U6b::TG2-sgRNA 中间融合载体. 之后用Bsa I 酶切U6a::TG1-sgRNA、U6b::TG2-sgRNA 和CRISPR-Cas9 空载体,并使用T4 DNA连接酶连接,获得含有TG1 和TG2 2 个靶点的重组载体.对获得的中间融合载体及最终重组载体进行菌落PCR鉴定,结果表明扩增出了预期的目的片段,如图1(b)所示.对重组载体进行酶切鉴定,得到了预期的含有TG1 和TG2 2 个靶点的目的条带,如图1(c)所示,表明2 个靶点成功连入了CRISPR-Cas9 空载体中,载体构建成功.
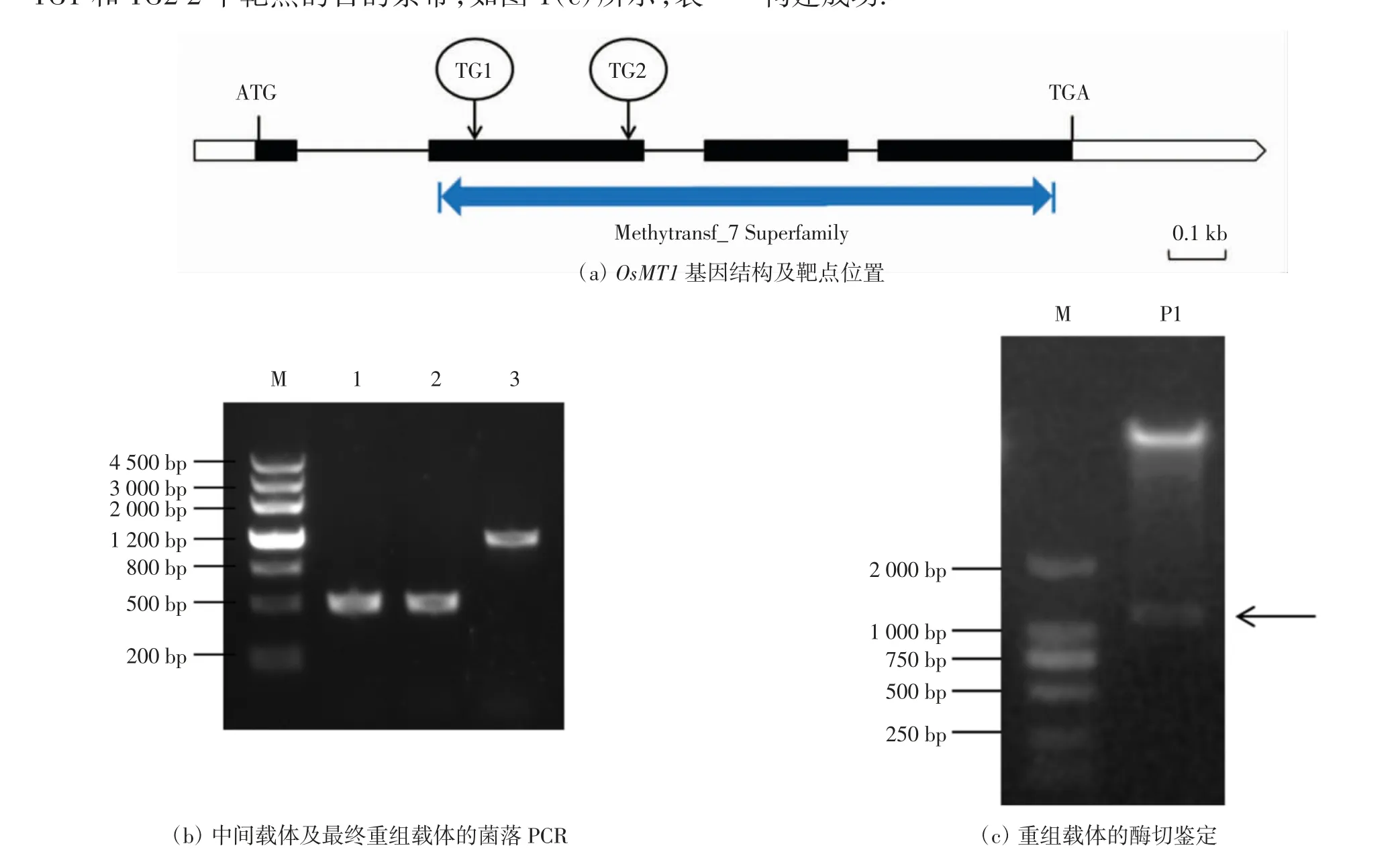
图1 OsMT1 基因CRISPR-Cas9 表达载体的构建Fig.1 Construction of CRISPR-Cas9 vetor for OsMT1
2.2 转基因植株的获得及编辑类型分析
重组载体构建成功后,通过农杆菌介导的遗传转化法,经过诱导、继代、侵染、筛选、分化、生根等过程,共获得45 株转基因植株.用载体中特异的潮霉素抗性基因进行鉴定,结果如图2 所示.由图2 可以看出,45 株植株中有32株为转基因阳性植株.

图2 转基因植株的分子检测Fig.2 Molecular detection of the transgenic plants
种植部分转基因阳性植株,获得T2代转基因株系,利用靶点特异性检测引物对T2代转基因植株进行PCR测序分析,发现有5 种编辑类型,如图3 所示.由图3(a)可以看出,osmt1-1 编辑突变体是TG1 和TG2 2 个靶点都发生了编辑的纯合突变体,在TG1 的PAM 序列前插入了1 个A 碱基,在TG2 的PAM 序列前10 bp 处插入了1 个A 碱基.由图3(b)可以看出,osmt1-2 编辑突变体仅在TG1 靶点发生了编辑,该突变体在TG1 靶点处的2 条链分别发生插入和缺失,其中一条同源染色体在PAM序列处插入1个A 碱基,而另外一条染色体在PAM 序列处缺失3 个碱基,测序出现了连续的套峰.由图3(c)可以看出,osmt1-3 编辑突变体是在2 个靶点都发生了编辑的纯合突变体,在TG1 的PAM序列后缺失9bp,在TG2的PAM 序列前10 bp 处插入了1 个A 碱基.由图3(d)可以看出,osmt1-4 编辑突变体也是在2 个靶点都发生了编辑的纯合突变体,在TG1 的PAM 序列前1 bp 处插入1 个T 碱基,在TG2 靶点的PAM 序列前9 bp 处缺失3 bp.由图3(e)可以看出,osmt1-5 编辑突变体在TG1靶点处发生了杂合编辑,在一条同源染色体上的PAM序列前插入了1 个A 碱基,在另一条同源染色体对应位置处插入了1 个T 碱基,未出现连续的套峰;在TG2靶点的PAM 序列前10 bp 处插入了1 个A 碱基.
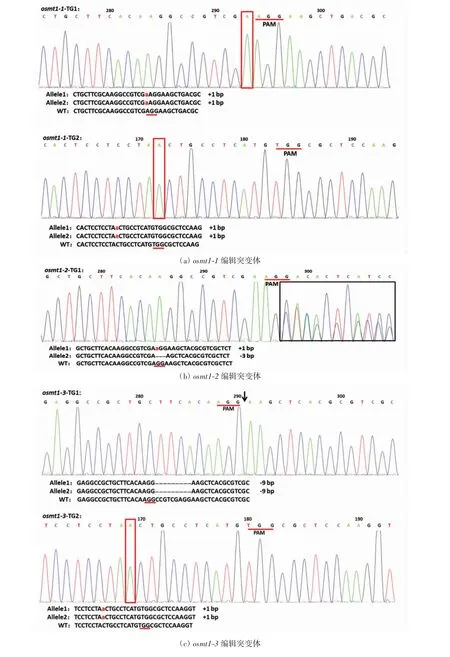
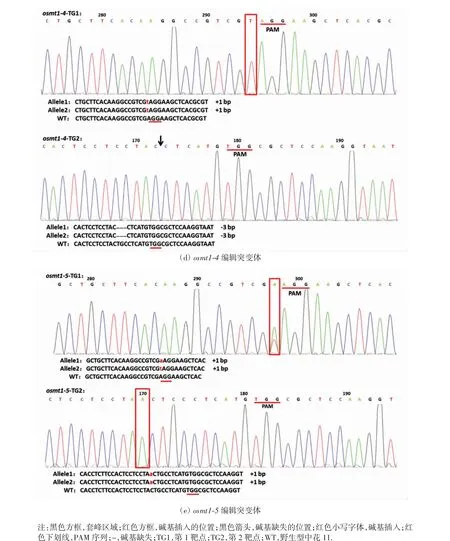
图3 编辑突变体的测序分析Fig.3 Sequencing analysis of editing mutants
2.3 突变植株的氨基酸类型分析
OsMT1 基因编码序列总长为1 143 bp,共编码380 个氨基酸. 利用DANMAN 软件对3 种纯合编辑类型的突变体植株进行氨基酸序列分析发现,与野生型相比,突变体都发生了移码突变,产生了提前终止的密码子,形成了截短的蛋白,如图4 所示.由图4 可以看出,由于osmt1-1 突变体在2 个靶点处各插入了1 个A 碱基,导致移码突变,从第41 个氨基酸开始表现出与野生型的差异,并且在第174 个氨基酸处产生终止密码子. osmt1-3 突变体在第1 个靶点处缺失了9 个碱基,导致在第38 个氨基酸后缺失了3 个氨基酸,未发生移码,但由于在第2 个靶点处插入了1 个A 碱基,导致后面的氨基酸发生移码,在第158 个氨基酸处产生终止密码子. osmt1-4 突变体在第1 个靶点处插入了1 个A 碱基,并且在第2 个靶点处缺失了3个碱基,所以在第40 个氨基酸后所翻译出的氨基酸序列与野生型不同,发生了移码突变,并在第170 个氨基酸处产生终止密码子. 这些编辑类型使OsMT1 基因成功发生了突变,产生截短产物.后续将利用这些纯合编辑的突变体对OsMT1 基因的功能进行分析.

图4 3 个纯合编辑突变体的氨基酸序列分析Fig.4 Analysis of amino acid sequences in three homozygous mutants
2.4 敲除OsMT1 基因降低水稻对盐胁迫的敏感性
SABATH 家族参与了植物的多个胁迫响应过程.为了研究OsMT1 的功能,对OsMT1 突变体和野生型中花11 进行了盐胁迫处理实验,结果如图5 所示.
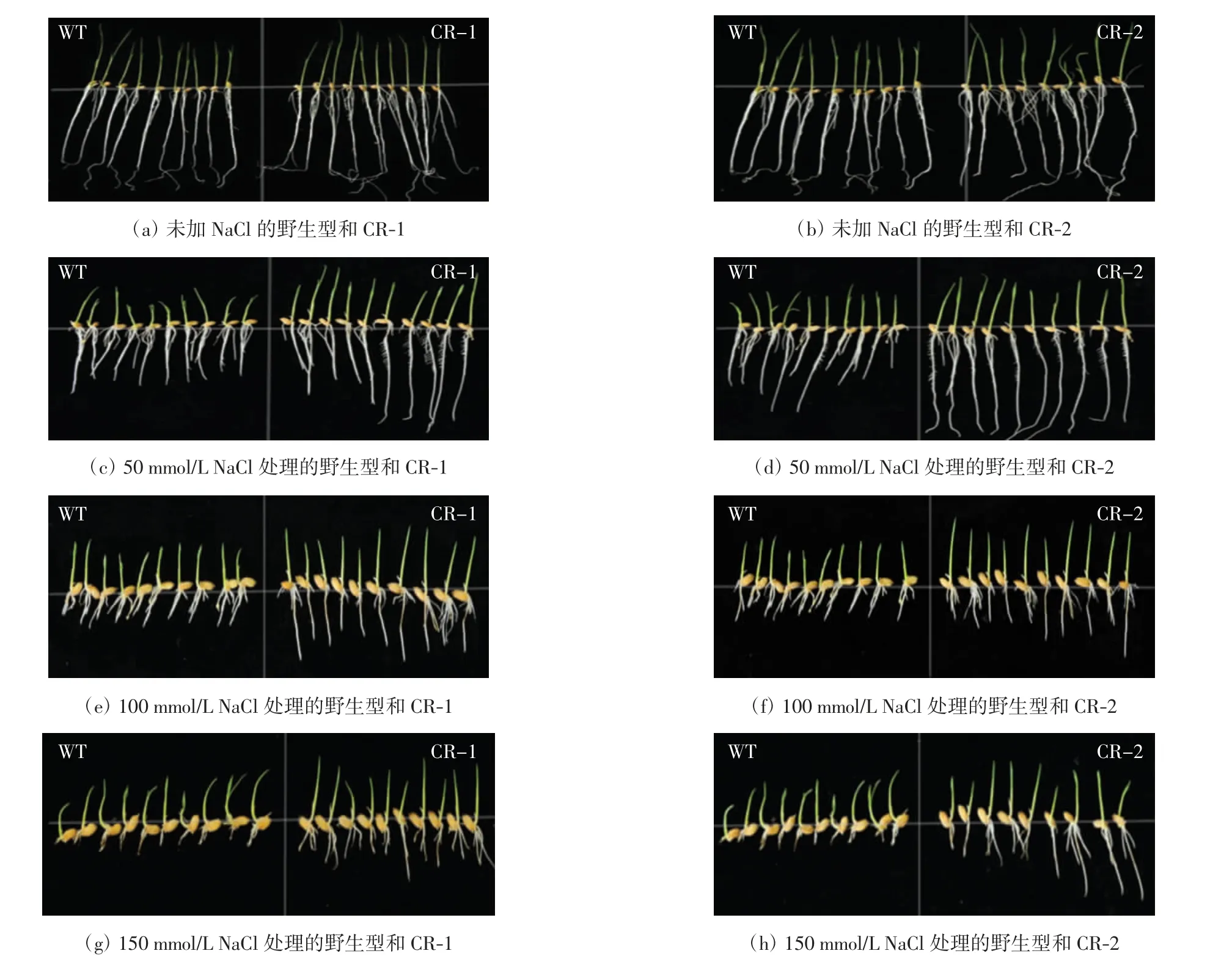
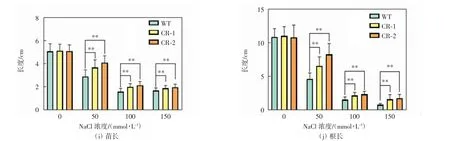
图5 不同浓度盐处理下野生型和突变型的表型Fig.5 Phenotypic analysis of wild type and mutant in different concentrations of salt
由图5 可知,当没有施加盐胁迫时,突变体的生长状态和野生型的没有明显差异. 在外源施加不同浓度的NaCl 后,与野生型相比,OsMT1 突变体对盐胁迫的敏感性降低. 当NaCl 浓度为50 mmol/L 和100 mmol/L 时,突变体和野生型的生长均受到抑制,表现为苗长和根长缩短,但野生型受到抑制的程度更大,根长及苗长都明显小于突变型的数值.当NaCl 浓度增加到150 mmol/L 时,野生型的根基本不能伸长,其生长点坏死,而突变体还可以伸长生长. 这些结果表明,OsMT1 突变降低了水稻对盐胁迫的敏感性,增强了植株对盐胁迫的抗性.
3 讨论与结论
本研究利用CRISPR-Cas9 基因编辑技术对水稻SABATH 家族成员OsMT1 进行定点编辑,得到了5 种类型的编辑突变体,其中3 种为纯合突变体,均由于碱基的插入或缺失造成移码突变,最终使翻译提前终止. 对获得的OsMT1 基因的纯合突变体进行不同浓度盐胁迫处理,发现在50、100和150 mmol/L 的盐浓度下,突变体的根长和苗长均明显长于野生型的长度,即OsMT1 基因突变降低了水稻对盐胁迫的敏感性,表明OsMT1 基因在水稻对抗盐胁迫中发挥了重要作用. 这一生物学功能可能与其生化功能相适应,因为植物SABATH 甲基转移酶家族是一类以植物激素为底物发生甲基化反应的基因家族,它可以使植物激素如JA、SA 及GA 等甲基化产生MeJA、MeSA、MeGA,这些甲基化的产物有助于植物对抗非生物胁迫[12-13].另外,植物SABATH 甲基转移酶家族成员在植物对抗生物胁迫中也发挥了一定的作用,已有研究表明该家族成员在植物花器官中参与了挥发性物质的合成,从而对抗植物所遇到的生物胁迫. 如金鱼草(Antirrhinum majus)中分离得到的苯甲酸羧甲基转移酶(BAMT),可将SAM 的甲基转移到苯甲酸(BA)的羧基上,得到挥发性的苯甲酸甲酯(MeBA),使金鱼草具有特殊香味[4];拟南芥中鉴定的AtBSMT 能同时催化MeSA 和MeBA 的合成,产生具有挥发性气味的物质,在植物对病虫的防御中发挥了重要作用[14];SA 和MeSA 作为一种信号分子,也可能参与了局部和系统性的防御,在植物未受到感染的部位触发防御反应[15].本研究创建的水稻SABATH 家族成员OsMT1 基因的突变体材料为详细揭示该基因的功能奠定了实验基础,后续将进一步探究该基因在生物胁迫及非生物胁迫中的调控通路.

