广西某高校细胞培养实验室污染状况的调查研究*
钟伟月,黄海燕,冯 燚,彭远军,廖艳研,3,王海龙,3,梁敏莉,林成琳,杨 扬,叶 力1,,3,潘沛江,3△,梁 浩1,,3△
(1.广西医科大学公共卫生学院 广西艾滋病防治研究重点实验室,南宁 530021;2.广西医科大学生命科学研究院生物安全三级实验室,南宁 530021;3.中国(广西)-东盟新发传染病联合实验室,南宁 530021)
细胞培养实验室污染仍是目前普遍存在的问题。在细胞培养等实验过程中,试剂容器表面、环境以及实验人员操作等因素会造成污染,如支原体污染、细菌污染等[1],可导致细胞功能和性质发生改变,从而影响实验研究的准确性和科学性[2]。支原体污染是最常见、不易察觉和干扰实验结果的污染原因[3],调查显示细胞系的支原体污染率在15%~50%[4],受支原体污染的细胞可能无明显变化,但可使研究结果的真实性和可靠性大大下降[1]。细胞培养实验在生物安全柜内操作,生物安全柜是一种由特殊气流组织结构与高效空气过滤器组成的具有箱型属性特点的净化功能负压装置[5],但其本身存在使用年限过长、过滤装置损坏等问题而达不到相应的保护效果。此外,客观条件如实验室清洁情况、人员无菌意识、实验操作是否恰当等,均可能对细胞造成污染[6]。因此,对于实验室环境的污染检测,在日常的细胞培养过程中是十分必要的。本研究通过结合细胞培养实验室的客观条件如人员流动情况、清洁制度等,并采集细胞培养实验室外环境样本与生物安全柜表面样本,检测支原体与细菌污染情况,为促进实验室的规范管理提供参考依据。
1 材料与方法
1.1 主要试剂 DMEM 培养液和胎牛血清(Gibco公司),15 mL和1.5 mL的EP管(Labselect公司),直径90 mm培养皿(Biosharp公司),营养琼脂粉剂(北京陆桥技术股份有限公司),PCR 扩增试剂(Takara公司)。
1.2 采样对象及方法 随机抽取8 个细胞培养实验室进行采样,每个实验室均有紫外灯、制冷及新风系统,其中6 个实验室设置缓冲间。每个实验室分布10 个采样点,其中包括生物安全柜下方落脚处、显微镜旁台面、培养箱内壁、培养箱外侧扶手、培养箱内用水、房间地面中央及4 处角落。对安全柜的采样分为紫外照射30 min、无人员操作运行30 min与人员操作30 min后不同时间点,在生物安全柜操作台面两侧及中间3个采样点进行采样。细菌采样以医用灭菌级棉签蘸取采样液(生理盐水4 mL)、支原体采样使用医用灭菌级棉签蘸取采样液(含2%FBS的DMEM培养液1 mL),生理盐水和DMEM培养液均进行灭菌处理。
将酒精灯点燃并置于采样点附近(≤15 cm),先将5 cm×5 cm 不锈钢采样板经火焰进行灭菌,冷却后采样板置于采样点保持不动,使用灭菌棉签在采样板中间5 cm×5 cm 范围内进行涂抹后,迅速将棉签置于相应的采样管中。
1.3 细菌与支原体检测方法 将采集的生理盐水标本短暂涡旋10 s,充分混匀后取1 mL混悬液至无菌培养皿中,置入高压后的营养琼脂培养基,于生化培养箱中培养48 h,观察平板上细菌生长情况并计数。DMEM 培养液标本置于37 ℃、5%CO2的培养箱中培养7 d,用PCR 扩增法以及琼脂糖凝胶电泳技术检测支原体污染情况。采用两对引物对支原体的不同片段进行扩增,引物1 上游:5’-GGGAGCAAACAGGATTAGATACCCT-3’,下游:5’-TGCACCATCTGTCACTCTGTTAACCTC-3’;引 物2上游:5’-GGCGAATGGGTGAGTAACACG-3’,下游:5’-CGGATAACGCTTGCGACCTATG-3’。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸45 s,共35 个循环;72 ℃,10 min。1.5%琼脂糖凝胶电泳(120 mA,30 min)后于凝胶检测仪中观察是否出现相应的扩增产物的条带以判断是否存在支原体感染。
1.4 统计学方法 采用SPSS 23.0统计软件进行统计分析。计量资料为开口资料,采用中位数(M)表示,行秩和检验;计数资料以百分率(%)表示,率的比较采用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 实验室不同采样点的污染情况 对每个实验室的10个不同采样点进行采样并检测细菌、支原体污染情况,细菌培养结果如表1所示,房间4个角落及地面中央、安全柜下方落脚处、培养箱外侧扶手以及内壁的样本均可检出细菌,样本阳性检出率为100.00%。仅在1 个实验室培养箱水样检出细菌。各个采样点均受到不同程度的支原体污染,其中支原体阳性检出率最高的位置是培养箱水样,为100.00%,房间地面中央的标本支原体阳性检出率最低,为50.00%,见表2。
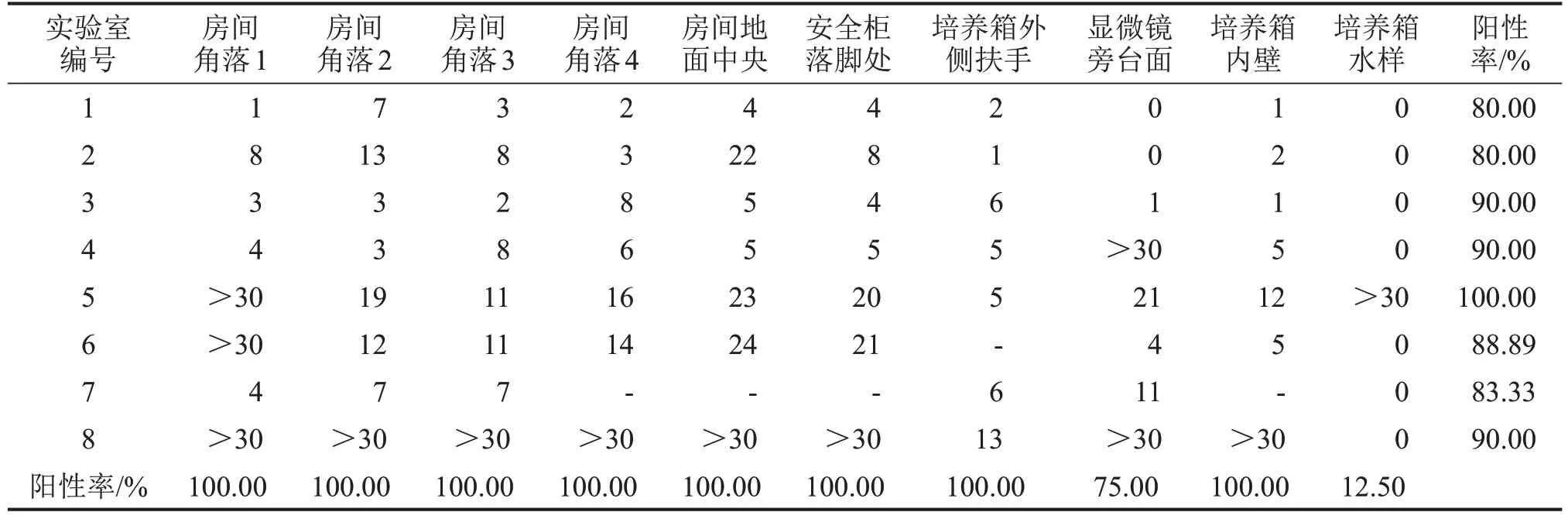
表1 实验室不同采样点的细菌污染情况CFU/皿
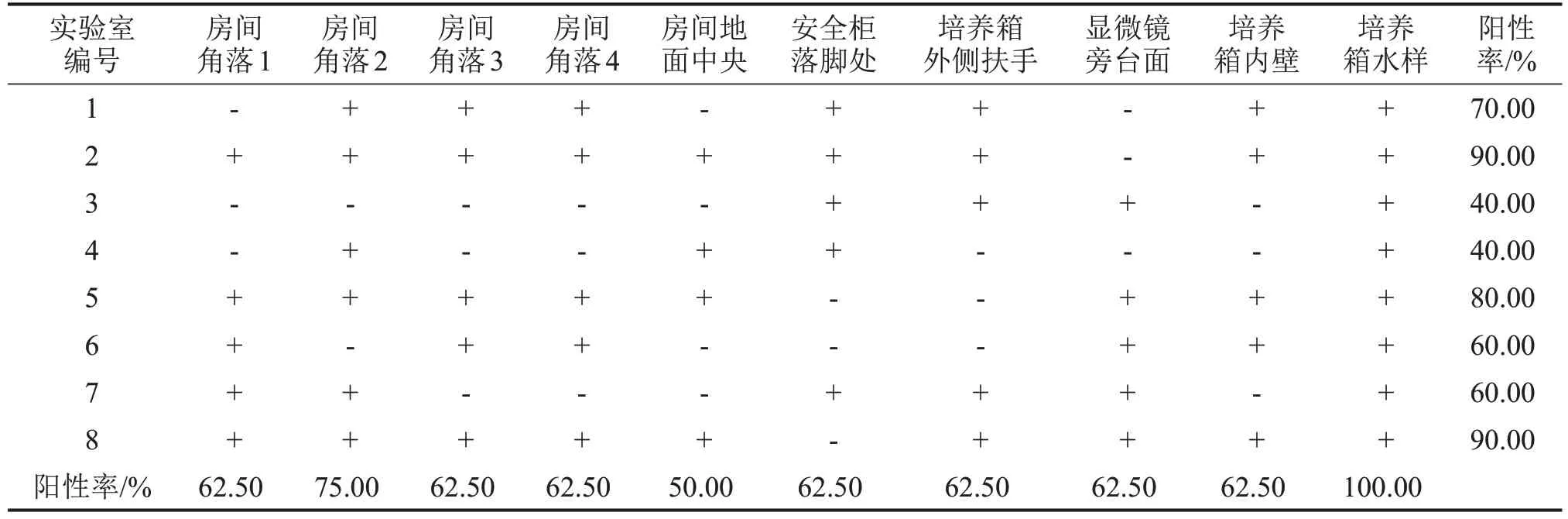
表2 实验室不同采样点的支原体污染情况
2.2 不同类型实验室的污染情况 将所采样的8 间实验室按照实验操作人员数大小分为A、B 两组,A组为实验人员数较少组,B组为实验人员数较多且流动频繁组,比较两组污染情况的差异。如表3 所示,B 组实验室的房间角落1、3、4 及地面中央,以及安全柜落脚处的细菌数目均多于A 组(P<0.05)。A 组实验室安全柜落脚处的支原体阳性检出率高于B组(P<0.05),见表4。
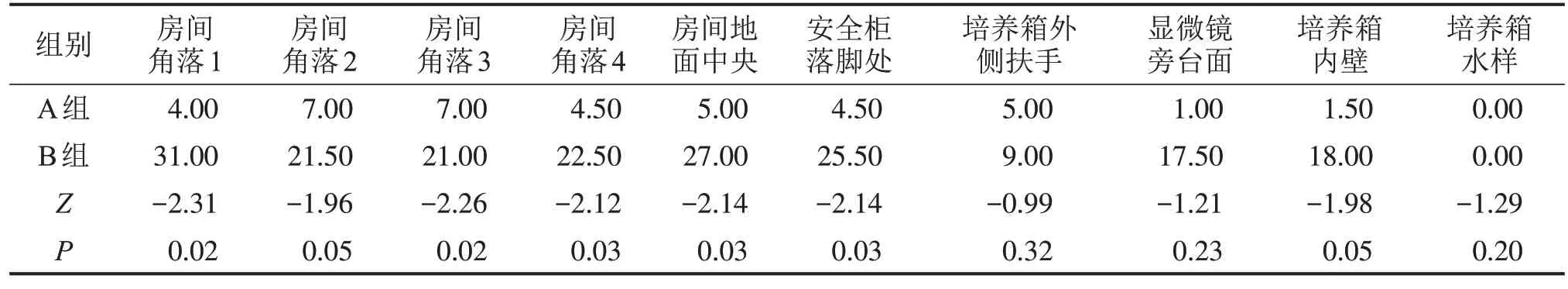
表3 不同类型实验室的细菌污染情况CFU/皿,M
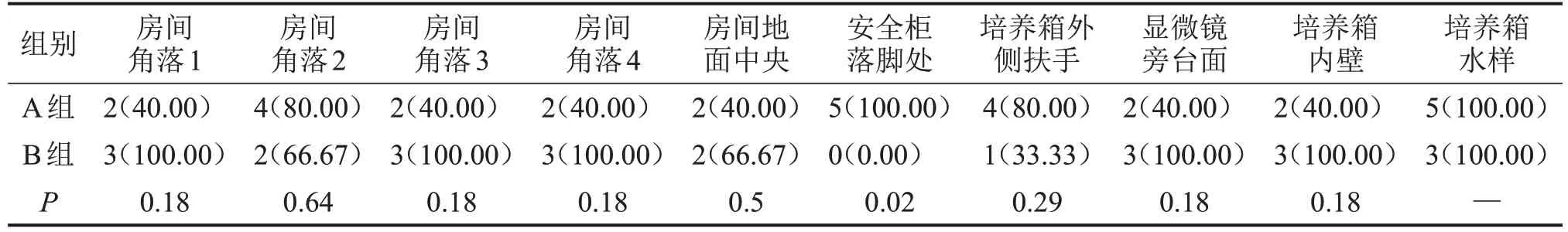
表4 不同类型实验室的支原体阳性检出情况n(%)
2.3 生物安全柜内污染情况 对采样的细胞培养平台中安全柜内台面上从左到右布置3个采样点进行采样,共采集了36份样本并予以细菌培养计数和支原体检测,检测结果如表5所示,所有样本均未培养出细菌。通过对支原体污染状况进行检测,发现采样点1在人员操作30 min后支原体阳性检出率为25.00%,采样点2 在风机运行30 min、人员操作30 min 后支原体阳性检出率分别为25.00%、25.00%,采样点3 在紫外照射30 min 后支原体阳性检出率仍有25.00%。可见,经过紫外照射30 min、风机空运行30 min、人员操作30 min 后生物安全柜内仍存在一定的支原体污染。
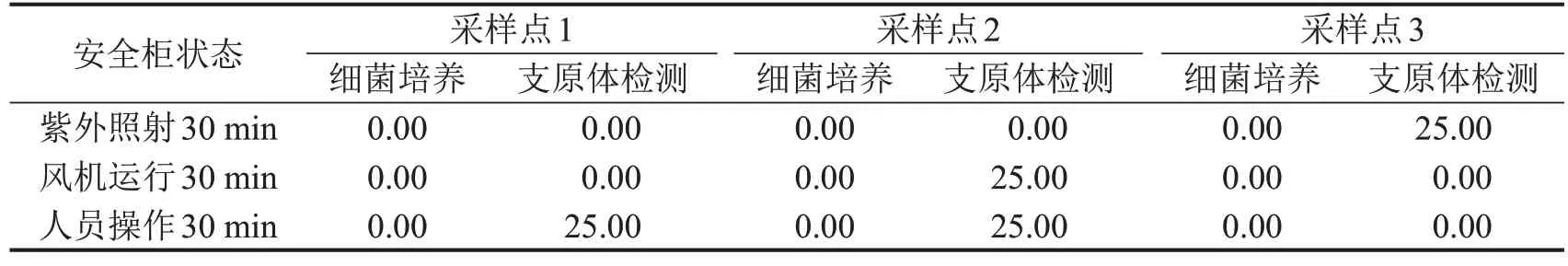
表5 生物安全柜内样本阳性检出率%
3 讨论
细胞培养实验室环境分为实验室外环境和生物安全柜内环境。实验室外环境因人员流动频繁,是空气污染的易感区和高发区,可通过消毒、杀菌与值日打扫来提高其清洁度[5]。本研究结果显示,实验人员流动频繁的公共实验室房间地面与安全柜落脚处细菌污染较严重。除房间地面中央以外的其余9 个采样点支原体阳性检出率均超过60.00%,这可能与实验室人员流动性较大以至于管理难度大,以及实验室未定期开展清洁消毒有关。高校微生物实验室由于学生流动性大,进出人员多,实验人员衣物表面的微生物会导致实验室环境污染[7]。减少实验人员的活动,对各种实验用品进行表面消毒可减少空气细菌污染[8]。因此,应合理安排实验室的使用,如尽量减少无关人员进出实验室,进入操作间前必须穿工作服,定期打扫卫生,定期使用紫外灯光照射进行灭菌处理等并加强督导,让学生能从自我防范和维护实验室安全灭菌环境的意识上来重视实验室的生物安全管理[2]。
本研究结果显示,细胞培养箱水样的支原体阳性检出率高达100.00%,这可能与实验室的日常清洁制度不力,清洁效果未达标有关。二氧化碳培养箱污染是导致细胞培养失败的一个主要因素[9],为减少和防止污染的发生,培养箱的消毒和维护尤为重要,日常细胞培养箱内所加入的水必须是蒸馏水或去离子水,除需经常检查箱内水是否足够外,还应定期更换培养箱用水,并对培养箱进行清洁消毒,防止箱内微生物滋生。
进入安全柜内的空气经过高效过滤装置(HEPA)过滤后达到百级洁净,可降低气溶胶扩散现象,减少实验室感染现象[10],然而一旦生物安全柜的有效性和安全性遭到破坏,将对实验室以及实验物品、实验结果造成严重污染。另外,有研究表明实验室内生物安全柜使用过久,滤板未定期更换或长久不更换,过滤装置受尘埃堵塞,污染空气进入操作区,从而导致柜内污染[11],因此日常定期监测生物安全柜内污染状况显得十分重要。本研究发现,经过紫外照射30 min、风机空运行30 min 后支原体阳性检出率仍为25.00%,可见抽检实验室的生物安全柜存在一定程度的污染,这可能与生物安全柜的日常维护不规范有关。在使用频率较高的场所,一般一至两年后HEPA的通透性会随着其表面积累的灰尘、细菌而下降,进而影响生物安全柜的垂直风速和窗口平均风速,使安全柜内的洁净、无菌环境以及实验人员的安全无法得到正常保障[6]。因此,实验管理人员应做好生物安全柜的维修保养,每年对其有效性和安全性进行检测,如及时更换高效空气过滤器,准确测量流经HEPA的气流速度及负压等。
有研究报道,在生物安全柜动态条件下,如操作不当,人员的实验活动会造成操作面板及格栅部位的空气乱流,实验室外环境中的部分非洁净空气就会随空气乱流进入实验区域造成实验样本污染[10]。本研究结果显示,在人员操作30 min 后采样点1 和采样点2 的支原体阳性检出率均为25.00%,这可能与实验人员的操作不当有关。雷亚克等[12]研究表明,在实验人员手接触最为频繁的地方污染最为严重,实验室内环境污染可能多由手部卫生措施不到位和常态化的清洁消毒不彻底所造成的。因此,为避免柜内空气乱流和实验样本交叉污染,实验人员应养成良好的操作习惯,如佩戴口罩、头套、灭菌手套,以及穿好灭菌实验服等。
综上所述,不论是实验室外环境还是生物安全柜内环境均有不同程度的污染,应加强完善实验室管理制度,定期检修生物安全柜,实验人员注意无菌操作,做好实验物品表面消毒和规范操作,有助于降低细胞培养实验室的污染。

