基于3D T1WI序列的影像组学模型对儿童FCD/MCD的预测
杜尚凇, 王可欣, 闻聃, 李昌欣, 张晓东, 王霄英
癫痫是反复发作的神经元异常放电所致的暂时性中枢神经系统功能失常。我国癫痫患病率为1.7‰~8.5‰,其中50%在9岁前起病[1]。多数癫痫患者经过正规的抗癫痫药治疗(antiepileptic drugs ,AEDs)后发作可得到控制,经过2种以上种抗癫痫药治疗后仍难以控制发作的称为药物难治性癫痫(drug resistance epilepsy,DRE)[2],我国约20%~30%的癫痫患者[3]为药物难治性癫痫。约有50%的药物难治性癫痫患者通过外科手术切除致痫灶或术后联合抗癫痫药物治疗,可以很好地控制癫痫发作[3,4]。
MRI是药物难治性癫痫术前评估的重要方法之一[5]。在MRI图像上如能发现异常信号并提示致痫病灶的范围,有利于完整切除致痫灶,是影响患儿预后的重要因素之一[6,7]。儿童难治性癫痫中最常见的病因为局灶性皮质发育不良(focal cortical dysplasia,FCD),其次为轻微的皮质发育畸形(mild malformations of cortical development,mMCD)[8,9],FCD为MCD中最常见的类型[10]。 FCD/MCD在MRI图像上的特征性表现主要包括局部皮质增厚、灰白质分界不清、脑回异常、脑沟裂增宽、皮层下异常信号等[11,12]。由于FCD/MCD的影像学诊断受场强、成像质量、诊断者水平等多种因素影响,影像诊断FCD/MCD的准确性较差,据统计约40%的病例术前影像诊断有误[13],迫切需要通过技术手段提高FCD/MCD的影像定位能力。
近年来大量影像组学研究探索了不同成像方式下的应用价值,涉及X线、超声、CT、MRI和PET研究等。研究结果表明影像组学技术可用于疾病诊断[14-17]、疾病风险分层[18-20]、预后评估[21]和治疗反应预测[22]等。大多数研究针对肿瘤性疾病,也有不少关注非肿瘤性疾病。本研究的目的是探索基于3D T1WI序列的影像组学模型对儿童局灶性皮质发育不良(focal nodular dysplasia,FCD)及皮质发育畸形(malformations of cortical development,MCD)病灶的预测效能。
材料与方法
1.数据入组
本回顾性研究获得了医院伦理委员会的批准[批件号:2019(170)]。从PACS 系统搜集2015年3月至2020年8月因药物难治性癫痫行手术切除病灶的患者。入组标准:①年龄1~18岁;②患儿行癫痫灶切除术,据国际抗癫痫联盟(International League Against Epilepsy,ILAE) 研究制定的分类标准[23]诊断为FCD/MCD的患儿;③患儿术前在本院行颅脑3D T1WI检查。排除标准:①图像伪影重;②病灶体积过小无法勾画轮廓;③既往患有其他可导致癫痫并表现为大脑实质信号异常的疾病,如缺血缺氧性脑病、结节性硬化、脑炎等;④既往颅脑外伤、手术史。最终46例数据纳入研究。其中男28例,女18例,平均年龄7.2岁。病灶位于左侧大脑半球者24例,位于右侧大脑半球者22例;位于额叶23例,颞叶及海马9例,中央区4例,顶叶1例,枕叶1例,额顶叶4例,额顶颞叶、顶枕颞叶、顶颞叶、额顶岛叶、颞岛叶各1例。病理结果为FCD的39例(39/46),MCD 7例(7/46);其中FCD Ⅰa 2(2/46),FCD Ⅰb 4(4/46),FCD Ⅱa 11(11/46),FCD Ⅱb 13(13/46),FCD Ⅲa 1(1/46),未分型的FCD 8例(8/46)。使用3.0T MR扫描仪(Philips Medical Systems,Achieva)采集头颅3D T1WI图像。使用8通道头线圈,扫描序列为MPRageAX SENSE,TR 8.1 ms,TE 3.72 ms,ETL 205,TA 8度,FOV 22 cm,矩阵256×256,层厚1 mm,层面内分辨率0.85×0.85 mm。
2.数据标注和测量
使用ITK-SNAP 3.8.0软件(http://www.itksnap.org)标注FCD/MCD病灶。由一位医生(影像工作3年)首先标注,再由一位高年资医生(影像工作>20年)检查并修改标注。结合术后病理结果在图像上标注FCD/MCD病灶区域作为正样本,在对侧大脑半球相同水平标注大小、位置接近的对照区域作为负样本。
3.影像组学模型训练
所有程序均在python3.2版本上运行。使用pyradiomics软件包(https://pyradiomics.readthedocs.io/en/latest/)提取特征,将所提取出的特征用于建立组学模型。建模过程包括:图像处理、数据归一化、特征降维、特征选择、训练分类器等步骤[24](表1)。按照7:3的比例将数据随机分为训练集(train set)和测试集(test set),进行影像组学建模和测试。根据测试集的预测性能来选择最佳的模型参数。

表1 训练影像组学模型的参数
4.分类模型评价
计算分类模型中每个样本的组学得分(rad-score),应用sigmoidal函数将组学得分转换为FCD的概率P(P介于0~1之间)。使用受试者工作特征曲线(receiver operating characteristic,ROC)来评估模型预测的性能。
5.统计描述
采用R1.1.456、Medcalc15.8软件进行统计分析。采用Shapiro-Wilk正态性检验,符合正态分布的计量资料采用独立样本t检验,以均值±标准差表示,不符合正态分布的连续变量采用Wilcoxon秩和检验,表示为中位数(四分位间距)。P<0.05认为差异有统计学意义。
结 果
1.样本特征(图1)
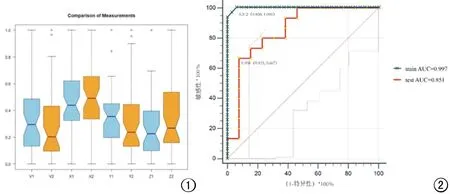
图1 槽口箱形图。规一化之后的FCD病灶和对照区域的比较。V1:FCD/MCD病灶体积;V2:对照区域体积;X1:FCD/MCD病灶最小径;X2:对照区域最小径;Y1:FCD/MCD病灶中间径;Y2:对照区域中间径;Z1:FCD/MCD病灶最大径;Z2:对照区域最大径。同一变量比较的箱形图,槽口区域如有交叉则代表该变量在两组间差异无统计学意义(P>0.05)。从图中可以看出FCD/MCD病灶与对区域比较,其体积和三维径线的差异均无统计学意义。 图2 影像组学模型的ROC曲线 训练集的AUC为0.997,最佳截断点0.312。测试集的AUC为0.851,最佳截断点0.958。
46个FCD/MCD病灶的三维径线分别为3.2 cm(95%CI:2.9~3.4)、4.1 cm(95%CI:3.8~4.4)和5.9 cm(95%CI:5.3~6.5),46个对照病灶的三维径线分别为4.2 cm(95%CI:3.5~4.7)、4.9 cm(95%CI:4.2~5.5)和6.6 cm(95%CI:5.8~7.3),两两比较差异均无统计学意义(P>0.05)。46个FCD/MCD病灶的体积为17.9 cm3(95%CI:14.4~21.3),46个对照病灶的体积为18.8 cm3(95%CI:14.5~23.2),差异无统计学意义(统计量=46,P=0.904)。
2.影像组学模型结果
特征提取:从3D T1WI图像中共提取1070个特征,包括14个形状(shape)特征,216个一阶(first order)特征,以及840个纹理(texture)特征,包括灰度共生矩阵(gray-level co-occurrence matrix,glcm)、灰度依赖矩阵(gray-level dependent matrix,gldm)、灰度游程矩阵(gray-level run length matrix,glrlm)、灰度大小区域矩阵(gray-level size zone matrix,glszm)等。
模型训练:使用全部可选参数训练模型后,据测试集最佳结果筛选出最终模型参数:使用MinMax方法进行特征值的规一化,以PCC对特征排序,以RFE方法选择最重要的20个特征,输入XGBoost分类器。
预测结果:训练集的AUC为0.997,最佳截断点为0.312。测试集的AUC为0.851,最佳截断点为0.958(图2~4)。
讨 论
FCD/MCD是儿童药物难治性癫痫最常见的病因之一,术前病灶的准确定位是影响手术效果的重要原因。目前临床常用的定位方法除了症状学定位,主要有视频脑电图(video-electroencephalography,vEEG)、立体三维脑电图(stereo-encephalography,sEEG)、脑磁图(magnetoencephalography,MEG)、MRI、SPECT、PET等,其中vEEG和MRI是癫痫患者的常规检查[25]。其中MRI可辅助定位病灶并确定病灶范围,但受多种因素影响,准确率较低。本研究尝试实现疑似病灶的自动识别,从而提高FCD/MCD病灶的检出率,及早发现病灶并手术切除,从而改善患儿的预后。
在影像上对致痫灶的定位对读片者的经验要求较高,因此既往不少研究尝试使用图像分析的方法识别致痫灶。算法主要包括基于体素的形态测量算法(voxel-based morphometry algorithm,VBM)、基于表面的形态测量算法(surface-based morphometry algorithm,SBM)以及基于体素特征提取的后处理工具[26]。SEOK-JUN等[13]结合表面分析运用线性判定模型对手术病理证实为FCDⅡ型的MRI图像进行机器识别,敏感度达74%。本研究尝试以影像组学模型来预测FCD/MCD病灶,测试集中AUC达到0.851,提示影像组学方法对本病的预测可能效果更好,有必要进一步研究。
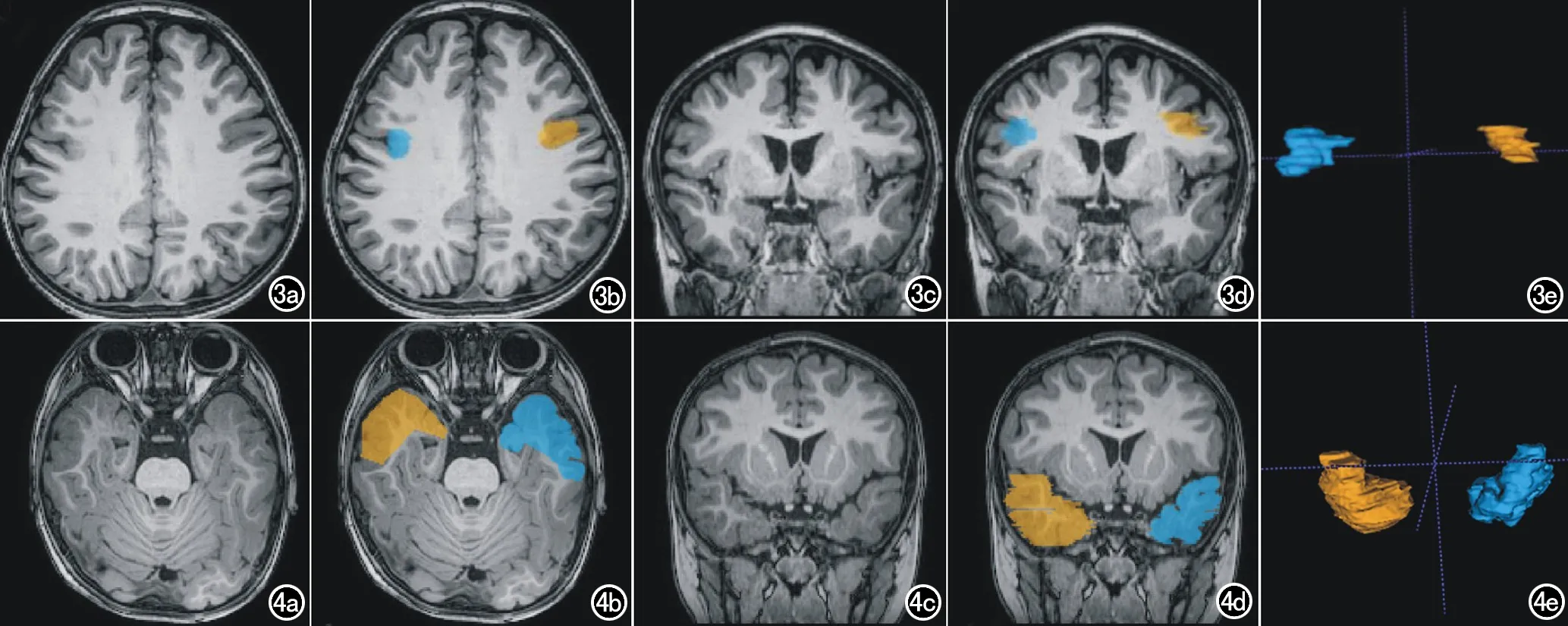
图3 测试集病例1。男,3岁,间断局灶性癫痫发作1年余,多种抗癫痫药物均控制不佳,脑电图示清醒期右侧Ro1andic区及中线区棘波、棘慢波、多棘波、慢波发放,监测到4次右侧起始的局灶性发作。PET-CT:右侧额叶深部皮层局部密度增高,葡萄糖代谢减低;右侧额叶(中央前回下部)葡萄糖代谢明显减低。MRI:右侧额下回局灶性皮质发育不良。于本院行右额叶病灶切除术,术后病理:(额下回后部、额中回后部、中央前沟沟底病灶)送检脑组织,考虑为局灶皮质发育不良ⅡB(FCDⅡB)。R为右侧。a)轴面3D T1WI图像; b) 轴面图像标注的FCD病灶(蓝色)和对照区域(黄色); c) 冠状面3D T1WI图像; d) 冠状面3D T1WI图像示的FCD病灶区域(蓝色)和对照区域(黄色); e) 标注区域的3D显示。该病例中影像组学模型对蓝色区域预测为FCD的概率是0.807,对黄色区域预测为FCD的概率是0.019。 图4 测试集病例2。男,3岁,间断局灶性癫痫发作2年余,抗癫痫药控制不佳, 脑电图:左侧前颞、前中颞异常放电;MRI:左侧海马异常信号。PET-CT:左侧海马葡糖代谢明显减低,于本院行左侧颞叶、海马病灶切除术,术后病理:局灶皮质发育不良IIa型(Type Ⅱa)。R为右侧。a)轴面3D T1WI图像;b)轴面图像标注的FCD病灶(蓝色)和对照区域(黄色);c)冠状面3D T1WI图像;d)冠状面3D T1WI图像上示的FCD病灶区域(蓝色)和对照区域(黄色);e)标注区域的3D显示。该病例中影像组学模型对蓝色区域预测为FCD的概率是0.938,对黄色区域预测为FCD的概率是0.017。
3D T1WI是检出FCD/MCD病灶的最佳序列之一[27],在实际临床工作中影像医生主观评估也是以3D T1WI结合其他序列来检测FCD/MCD,这是本研究采用该序列的原因。未来模型应用的场景是针对难治性癫痫、影像检查目的是除外FCD/MCD的患者,扫描完成后由影像医生读片。影像医生读片过程中如发现疑似病灶,或读片未见疑似病灶但临床检查结果(如脑电图、PET等)怀疑某处有疑似病灶,则医生在该区域手工标注,标注后的图像用本研究提出的影像组学模型预测,返回该区域为FCD/MCD的概率。影像医生综合临床检查结果、本人读片、影像组学概率做出综合判断,将结果发布给临床医生用于后续诊治。
影像组学研究过程中强调方法的标准化。本研究使用了显示FCD/MCD公认的3D T1WI图像,图像获取方法参考了本领域的相关规范[28,29]。特征提取采用了主流的Pyradiomics程序包,所提取的图像特征符合图像生物标志物标准化(image biomarker standardization initiative,IBSI)的基本要求[30]。入组病例全部选择了有手术病理证实的数据,根据手术区域标注病灶定位可靠。影像组学感兴趣区(region of interest,ROI)的选择有多种可能性如整个目标脏器、在图像范围内随机生成、病灶周边区域等[16,18],本研究以大脑半球对称区域为对照组的ROI,是考虑到双侧大脑半球的结构是对称的,可规避解剖结构不一致而导致的偏倚。结果显示病灶组与对照组的大小无明显差异,说明手工标注的对照组是匹配的,因此所提取的影像组学特征主要是反映了病灶本身的性质,未受到解剖差异的影响。本研究Dice系数均较高,可能存在拟合(overfitting)问题。机器学习中过拟合现象通常由训练集的数量级小于模型的复杂程度导致[31],造成模型的泛化能力下降。最常用的避免过拟合的方法是增强数据,包括增加数据量、及人为增加噪声等[32];由于本研究为初步研究,可获得的数据量少,且未能加入外部验证数据,有待后续增加数据量评估并提高模型的泛化能力。在影像组学模型筛选中,由于Lasso分类器的特性,可避免对样本的过度解释[33],降低过拟合,由于本研究中采用Lasso分类器的模型中,测试集AUC最高为0.82,与本研究最终采用的模型效能有一定差距,故未选用。
本研究的局限性:①样本数较少,需要继续获取本院或来自多中心的较大样本量来验证和完善模型;②癫痫患儿的反复发作可对大脑发育造成影响如造成局部脑实质的萎缩,本研究没有考虑病程长短、治疗过程等对研究结果可能产生的影响,应在获取足够样本后对病例进行分类,从而完善模型;③部分颞叶病灶的检出可能受到颅底伪影的干扰,尽管在筛选病例时已经注意排除质量较差的图像,但仍不能完全避免,同样需在获取足够病例后根据病灶位置进行分类学习;④FCD/MCD的不同分型影像学表现略有差异,有待进一步根据病理类型进行分类学习。
总之,本研究初步证明了基于机器学习的3D T1WI影像组学标签可较准确地识别标注范围内的可能的灰白质异常,并可用于难治性癫痫患儿的辅助影像学诊断。

