基于CT靶扫描构建多模态联合模型Nomogram评估孤立性肺结节
赵帅, 孟令思, 郭君武
孤立性肺结节(solitary pulmonary nodule,SPN)指单一、边界清晰、影像不透明、直径≤30 mm,周围含气肺组织所包绕的病灶[1]。目前,临床上SPN的诊断鉴别涉及多种良恶性病变,包括原发性肺癌以及错构瘤[2]。快速识别并切除恶性SPN可提升非小细胞肺癌患者5年生存率至60%~80%[3],同时术前对于患者SPN良恶性的诊断有助于临床治疗决策的快速评估,优化医疗资源的配置。目前,SPN良恶性的诊断金标准仍为病理活检,病理活检仍存在并发感染、侵袭性且滞后性等问题[4]。 CT目前广泛用于临床上无侵袭性定性评估SPN[5],CT可通过直观的视觉分辨肿瘤大小、肿瘤密度以及肿瘤边缘[6]。然而相比较常规的CT扫描,CT靶扫描确保CT征象明显丰富,不仅可在形态学上提供高清CT特征,同时其CT密度值更为精确,可用于CT图像的进一步科学研究[7]。
CT对于SPN的良恶性的误诊率接近60%[8]。然而由于肿瘤异质性,肿瘤纹理的变化与肿瘤基因组学的变化具有直接相关性[9]。2012年Lambin提出影像组学(Radiomics)至今[10],Radiomics类似于图像的“基因组学”,联合患者多模态临床信息构建模型无侵袭性定量评估患者疾病[11]。因此,本研究的目的在于基于CT靶扫描图像进行影像组学特征提取联合CT征象构建联合模型评估SPN的良恶性。
材料与方法
1.研究对象
纳入2018年1月-2020年7月在郑州大学第二附属医院行胸部CT检查诊断为肺结节患者。患者入组标准: ①肺内孤立性结节;②患者需经过穿刺或手术切除后明确病理类型,是否良恶性; ③CT成像确诊病灶位于肺部;④结节横向最大直径≤30 mm;⑤CT上无明显淋巴增大,胸腔积液征象,无肺不张;患者筛除标准:①患者于CT成像前行穿刺活检术;②CT成像前患者已经接受化疗、放疗或药物治疗等肿瘤相关治疗方案;③患者CT图像质量不满足感兴趣区域分割。回顾性纳入患者资料时,需跟患者沟通本组研究内容,并确保患者签署授权书。
2.胸部CT检查方法
采用Siemens Somatom Definition Flash螺旋CT扫描仪进行常规胸部扫描(管电压100 kV,电流260 mAs,扫描层厚5 mm,矩阵512×512)。发现病灶后缩小扫描视野(FOV),以病灶为中心行薄层靶扫描(管电压140 kV,电流576 mAs,扫描层厚0.6 mm,矩阵512×512,FOV为20 cm)。将扫描获得的影像资料传入后处理工作站(Syngo MMWP VE40A,Siemens)行多平面重建(MPR)、容积再现(VR)、表面投影显示(SSD)、最大密度投影(MIP)和最小密度投影(MinIP)等各种重建技术。
3.图像评价方法
每例患者由本科室从事CT影像诊断10年经验的医师遵循单盲原则(无临床资料、无病理结果对照)独立评估患者CT征象。①结节病发部位:右肺上叶、右肺下叶、左肺上叶、左肺下叶;②结节横断面最大直径;③病变边缘:是否出现分叶征;④病变内部征象:是否出现空泡征、空气支气管征、钙化;⑤病变周边:胸膜凹陷征、血管聚集征、直边征。分叶征即结节的轮廓非圆形或椭圆形态,其表面由多个凹凸不平的弧形组成;空泡征即结节内出现直径约为1~2 mm的点状低HU值的透亮影,形似空泡;空气支气管征即病变周围的肺组织出现透亮的支气管影;胸膜凹陷征即患者胸膜凹向结节;血管聚集征即血管向结节聚集。
4.影像组学特征提取
由本科室具有5~10年CT诊断经验的医师利用ITK-SNAP 3.6.0进行感兴趣区域分割(region of intest,ROI)。具体分割:首先将薄层靶扫描肺部CT图像导入ITK-SNAP软件中,在含有结节的每一个层面沿结节病灶边缘勾画ROI(避开血管、坏死以及钙化区域),并最终合成3D ROI。其次,按照图像标志物标准协会对影像组学特征要求标准,利用Anaconda prompt 3导入Pyradiomics包按照exmaple CT特征表提取影像组学参数共计987个影像组学特征[12,13]。
5.病理诊断
根据肺癌组织学分类标准2015版,由病理医师进行结节良恶性评估,并诊断患者具体病理类型。
6.统计分析
采用R 4.0.3和R studio进行统计分析,采用tidyverse、caret、pROC、rms、Publish、glmnet、ModelGood、ggpubr、rmda、DescTools、mRMR程辑包。首先,按照随机分层原则,以7:3比例将良恶性患者分为训练组和测试组,以训练组患者SPN良恶性为研究标签,对影像组学特征进行取冗除杂,先采用最小冗余最大相关(min redundancymax relevance,mRMR)进行特征降维,保留30个特征;继而采用套索模型(least absolute shrinkage and selection operator,LASSO)构建影像组学标签(radiomics signature,Rad-score),并采用受试者曲线(receiver operating characteristic curve,ROC)评估训练组和测试组中影像组学标签Rad-score鉴别良恶性SPN的诊断效能。最后以训练组患者信息纳入CT征象特征与影像组学标签Rad-score构建多元逻辑回归模型评估患者SPN的良恶性,采用Nomogram可视化该多元逻辑回归模型,并采用ROC评估Nomogram在训练组和测试组鉴别患者SPN良恶性的效能,利用C-index、Hosmer-Lemeshow、DCA评估模型。P<0.05差异具有统计学意义。
结 果
1.临床资料
本组研究共计纳入82名SPN患者,其中38名患者接受手术,44名患者接受穿刺活检。所有SPN均经病理验证,其中恶性结节共计43例患者,良性结节39名患者。恶性结节患者中男28人,女15人;良性结节患者中男23人,女16人,恶性结节患者与良性结节患者性别无统计学差异(P=0.651,表1)。
恶性结节患者与良性结节患者年龄无统计学差异(P=0.202,表1)。然而恶性结节患者的结节病发部位与良性结节患者的结节病发部位具有统计学差异(P=0.026,表1)。CT征象结果显示恶性结节患者的结节直径显著大于良性结节(P=0.031,表1);同时恶性结节患者22名出现分叶,显著高于良性结节患者(P<0.001,表1);恶性结节22名患者结节出现毛刺,36名患者出现血管聚集,22名出现胸膜凹陷,20名出现空气支气管均显著高于良性结节患者(表1),然而恶性结节患者仅3例出现钙化现象,显著低于良性结节患者(P=0.009,表1);两组患者CT征象中出现空泡、以及直边无显著差异(P=0.172,1.000,表1)。
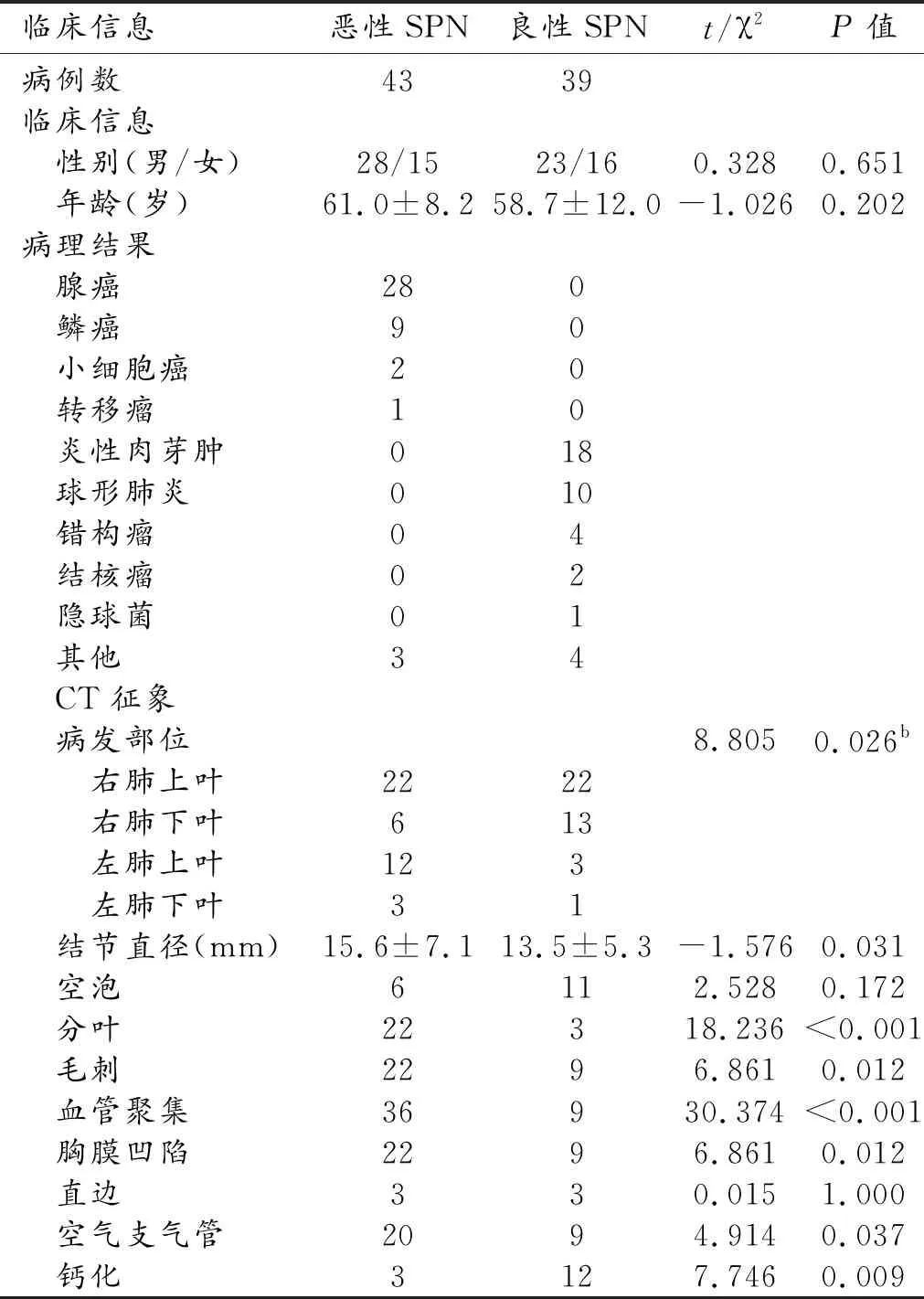
表1 良恶性孤立性结节患者的临床资料以及CT征象
2.影像组学标签构建
按照7:3的比例将恶性SPN患者和良性SPN患者分为训练组和测试组,训练组中59例患者,其中31例恶性,28例良性;测试组中23例患者,其中12例恶性,11例良性。以训练组患者SPN是否恶性作为研究标签,采用mRMR进行去冗除杂后,保留30个特征,继而采用LASSO,取最小惩罚系数时构建的影像组学标签Rad-score其二项式偏差最小(图1a),此时log(λ)=0.048 (图1b),构建Rad-score影像组学特征的权重系数如图1c。Rad-score公式如下:Rad-score=-0.447×log_sigma_4_0_mm_3D_gldm_LowGrayLevelEmphasis-0.211×wavelet_HHH_firstorder_Mean-0.238×original_firstorder_Mean+0.219×wavelet_LHL_glszm_LargAraHighGrayLev-elEmphasis+0.334×log_sigma_2_0_mm_3D_firstorder_Kurtosis+0.367×wavelet_HHL_firstorder_Mean+0.063×wavelet_HLH_firstorder_Kurtosis-0.08×wavelet_HHH_firstorder_Median+0.018×log_sigma_2_0_mm_3D_glszm_SizeZoneNonUniformity+0.266×wavelet_HHL_glcm_Correlation+0.091

图1 良恶性SPN鉴别影像组学标签构建。a) 采用LASSO进行特征降维,横坐标表示惩罚系数值,纵坐标表示随着惩罚系数值 的改变,二项式偏差大小的改变; b) 采用LASSO进行特征降维,下方横坐标表示log(λ)值,上方横坐标表示log(λ)对应的特征个数,纵坐标表示每个特征的权重系数; c) 采用LASSO进行特征降维后构建Rad-score时,不同的影像组学参数的系数值。
3.影像组学标签诊断良恶性SPN效能
基于Rad-score公式计算训练组和测试组患者的Rad-score值,训练组中恶性SPN患者与良性SPN患者Rad-score具有显著性差异(P<0.000),然而测试组中恶性SPN患者与良性SPN患者Rad-score差异不显著(P=0.079)。训练组中Rad-score诊断效能AUC=0.89 (图2a),95%置信区间:0.81~0.97,阳性预测率PPV为0.774,阴性预测率为0.857;测试组中Rad-score诊断效能AUC=0.72 (图2b),95%置信区间为0.49~0.95,阳性预测率0.857,阴性预测率0.687(表2)。

表2 Rad-score、CT征象和Nomogram鉴别SPN良恶性的良恶性的诊断效能
4.CT征像联合影像组学标签构建联合模型评估良恶性SPN
基于训练组中患者CT征像进行Mann-WhitneyU检验筛选在良恶性SPN患者中有统计学差异的参数后, 对参数之间进行Spearman相关性分析,剔除CT征像之间相关性>0.6的参数。最终保留血管聚集、毛刺和分叶3个CT征像参数并联合Rad-score构建鉴别良恶性SPN的多元逻辑回归模型, 公式如下:
同时采用Nomogram可视化该模型 (图3a)。Nomogram使用方式为通过计算患者的Rad-score代入图中找到对应值并以Points做垂直线获取对应Points线上的得分,并同时将患者的是否出现血管聚集,是否出现毛刺,是否出现分叶定义为0和1,0为否、1为是。代入患者以上CT征像值后均按照相同方法以Points做垂直线获取对应Points线上的得分;最终将4个参数的Points得分相加获得Total points上的总分,并向Risk上做垂直线获取Risk值,即为患者是否恶性的风险值。通过比较CT征象、Rad-score和Nomogram的诊断效能,训练组中Nomogram的AUC值高于CT征象高于Rad-score (0.96 vs 0.90 vs 0.89,表2,图3b)。测试组中Nomogram的AUC值高于CT征象高于Rad-score (0.88 vs 0.87 vs 0.72,表2,图3c)。
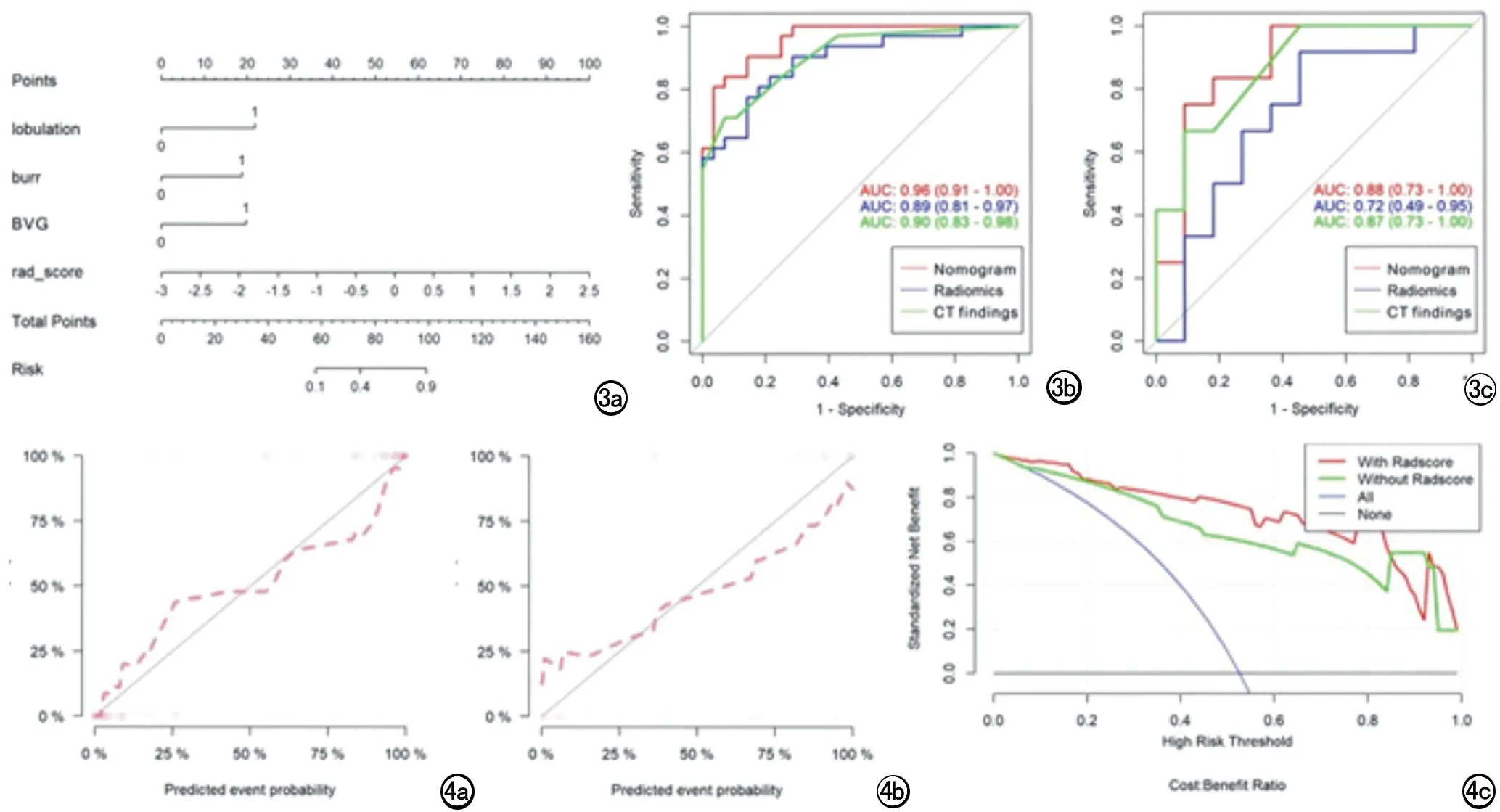
图3 CT征象联合Rad-score构建Nomogram以及诊断效能比较。a) 征象联合Rad-score构建多元逻辑回归模型,并采用Nomogram进行可视化;b) Nomogram、CT征象(CT findings)以及Radiomics在训练组中评估SPN良恶性的诊断效能; c) Nomogram、CT征象(CT findings)以及Radiomics在验证组中评估SPN良恶性的诊断效能。 图4 Nomogram术前鉴别SPN良恶性的模型评估。a、b) 训练组以及测试组Nomogram鉴别SPN良恶性的C-index图; c) Nomogram鉴别SPN良恶性的临床决策线分析。横坐标示患者是恶性结节的风险值; 纵坐标代表从不同鉴别方法中评估患者是否为恶性结节的临床收益;蓝色线 (ALL) 即代表采用随机的方案进行恶性结节评估时的临床收益;黑色线 (None) 即代表不采用任何方案进行恶性结节评估时的临床收益始终为0;红线代表采用Nomogram (with Radscore)进行良恶性评估时的临床收益; 绿线代表采用CT findings (without Radscore)时评估SPN恶性患者的临床收益。
5.Nomogram模型拟合评估
Nomogram在训练组和测试组中与患者实际情况拟合程度由C-index曲线表达(图4a、b),训练组以及测试组中Hosmer-Lemeshow分析结果为P=0.6006 vs 0.4092,即Nomogram在训练组和测试组中评估患者是恶性SPN的模型结果与实际病理检测标准结果无显著差异。临床决策线结果显示当患者为恶性SPN的风险<0.83时,患者从Nomogram上获取的临床收益>CT征象。
讨 论
本组研究通过对SPN患者进行CT靶扫描,采用病灶3D分割后提取影像组学参数,构建影像组学标签Rad-score。继而联合Rad-score以及CT征象构建联合模型定量评估患者是否恶性SPN的风险几率。研究结果发现联合CT征象以及Radiomics构建Nomogram进行SPN良恶性鉴别时具有较好的鉴别能力。此外,我们首次基于CT靶扫描图像进行肺结节相关的影像组学研究。
患者原始图像是基于radiomics研究的重要原始数据,影像组学创始人Lambin提出非标准化的医学图像本身会对影像组学的研究造成不可避免的系统误差[11]。相比较传统CT扫描成像CT靶扫描具有薄层扫描(≤0.635 mm)、FOV显著缩小(200~230 mm)、肺结节边缘更清晰等优点[14]。国内外关于SPN良恶性的影像组学研究大多基于常规CT扫描[15,16]。本组研究中则是尝试在SPN的影像组学研究中引入CT靶扫描图像进行Radiomics的相关研究。
我们利用CT靶扫描图像提取海量影像组学后进行特征去冗除杂构建影像组学标签,Rad-score用以评估SPN良恶性,通过LASSO进行特征降维构建Rad-score的计算公式获得该公式后可对新收入的患者在未获取病理结果前通过CT靶图像提取该公式中的10个Radiomics特征,从而计算出Rad-score的值。研究发现基于Rad-score进行SPN良恶性评估时AUC值在训练组中可达到0.89,测试组中可达到0.72。晏睿滢等[15]研究中则基于CT特征构建模型纳入年龄、空泡、血管聚集、空气支气管、胸膜牵拉、GCO成分,CT特征模型在训练组AUC为0.860,验证集为0.864,高于Rad-score。继而我们纳入CT特征联合Rad-score构建联合模型,联合模型在训练组AUC为0.96,测试组中AUC为0.88。同时,我们的联合模型中也纳入了血管聚集该项指标,与晏睿滢研究结果相似。然而我们的联合模型中同时纳入了毛刺、分叶,单文莉[17]研究提出恶性征象的CT特征风险因素可能与是否分叶、是否毛刺高度相关,跟我们的研究结果相符。因此,CT征象联合影像组学可用于尝试提高CT评估的SPN良恶性的效能。
目前影像组学乃至人工智能的发展始终存在一个问题,即如何让复杂的数学模型高效的应用与临床实际工作中,因此,我们根据已有Radiomics的成熟研究选择Nomogram对最终的联合模型进行可视化[18]。Nomogram可在获取患者是否血管聚集、是否毛刺、是否分叶、以及Rad-score值代入公式中获取患者为恶性的风险值,从而协助临床非侵袭性的评估患者SPN为恶性的可能性。
本研究尚存在许多不足之处:采用多元逻辑回归模型,而未比较如随机森林、SVM等分类器模型;缺乏多中心病例,目前影像组学研究中大多采用本医院的病例,而缺乏多中心的数据,从而导致模型的推广性无法保证。
综上所述,本组研究基于CT靶扫描提取影像组学特征并联合CT征象构建多元逻辑回归模型,该模型可在获取患者病理检测信息前尝试用于协助临床无侵袭性的评估SPN的良恶性,该模型具有一定程度的参考价值,然而,如果需要在临床上实际推广应用起来,仍需要不断的扩大样本进行深入研究。

