基于肝细胞特异性MRI对比剂的肝硬化背景良恶性的鉴别诊断价值
黄海华,何琛波
(郴州市第一人民医院影像医学中心,湖南 郴州 423000)
肝硬化是消化系统常见疾病,为不同原因引起的进行性肝损害所致肝细胞广泛性坏死及结缔组织纤维型增生进展引起。数据显示,多数肝细胞癌(hepatocellular carcinoma,HCC)是在肝硬化结节基础上发展而来[1]。肝硬化发展过程中的不典型增生结节(dysplastic nodule,DN)为HCC的癌前病变,是再生结节(regenerative nodule,RN)进展为HCC的重要阶段[2]。我国是HCC发病率较高的国家,早期准确诊断并积极治疗可在一定程度上改善预后[3]。准确识别肝硬化结节病灶的性质,鉴别结节良、恶性病变,对于提高HCC的早期诊断率,提高生存率,改善患者预后具有重要意义[4]。MRI是一种安全、无创的检查手段,是检测肝脏病变常用的影像学方法,但目前DN与HCC的临床鉴别仍然较为困难[5]。钆塞酸二钠(Gd-EOB-DTPA)是一种新型肝脏特异性对比剂,具有普通细胞外造影剂三期增强的特点,又可被正常肝胆细胞摄取而呈现高、等信号,HCC细胞不吸收而呈低信号,已被证实可提高HCC诊断效率[6]。本研究旨在探讨基于Gd-EOB-DTPA的MRI检查对肝硬化背景下良恶性病变的鉴别效能。
1 资料与方法
1.1 一般资料
选取2020年3月至2022年3月郴州市第一人民医院收治的96例肝硬化患者为研究对象。其中,男性72例,女性24例;年龄27~76岁,平均(52.07±7.95)岁。纳入标准:(1)明确诊断为肝硬化[7];(2)造影、彩超或增强CT检查发现无法明确性质的肝脏结节;(3)均行MRI平扫描及Gd-EOB-DTPA增强扫描;(4)临床资料、影像学资料、随访资料完整清晰;(5)对本研究知情同意且自愿配合。排除标准:(1)典型肝癌、肝囊肿、血管瘤、FNH等明确性结节;(2)存在MRI检查禁忌证、对造影剂过敏、无法配合检查者。
1.2 方法
1.2.1 MRI扫描 采用美国GE HDXT3.0T 磁共振扫描仪,8通道相控阵线圈。患者取仰卧位,头先进,身体纵轴垂直于扫描线。经肘前静脉注射Gd-EOB-DTPA对比剂,注射剂量0.1 mL/kg,注射速率2 mL/s。扫描序列及参数设置:冠状面T2WI(TR 1 800 ms,TE 95 ms);半傅里叶单次激发快速自旋回波面T2WI(TR 2 930 ms,TE 89 ms);脂肪抑制序列T2WI(TR 2 930 ms,TE 89 ms),133 °翻转角;二维反转恢复快速梯度回波T1WI(TR 171 ms,TE 2.31 ms)。视野(field of view,FOV)350 mm×350 mm,矩阵224×320,层间距1.2 mm,层厚6 mm。DWI(TR 9 200 ms,TE 66 ms),FOV 420 mm×420 mm,矩阵118×148,层厚6 mm。分别于注射对比剂后30 s、60 s及120 s进行扫描。
1.2.2 图像分析 由两名具有10年以上经验的影像医师进行盲法独立阅片诊断。将扫描得到的T1 mapping图像传送至工作站,在T1 mapping伪彩图中,绘制ROI面积0.5~1.2 cm3,测量T1弛豫时间,参照增强前后动脉期、门静脉期、肝胆期肿瘤及周围肝实质对应的解剖位置进行测量。测量病灶T1时,ROI置于病灶最大切面的三个不同位置处,同时尽可能每次ROI大小一致。测量肝实质T1时,在病灶对应T1 mapping图像相应层面距离肿瘤边缘超过2 cm处的正常肝实质进行测量。分别在病灶及周围肝实质ROI区域计算ADC值,测量时避开出血处、脂肪、囊变、坏死区域、胆管、血管伪影,各测量3次,取平均值。
1.3 观察指标
(1)病灶检出情况:包括影像检查和病理检查;(2)不同类型结节Gd-EOB-DTPA增强MRI扫描参数;(3)Gd-EOB-DTPA增强MRI对HCC的诊断效能:敏感度=真阳性例数/(真阳性+假阴性)例数×100%;特异度=真阴性例数/(真阴性+假阳性)例数×100%;准确度=(真阳性+真阴性)例数/(真阳性+假阳性+假阴性+真阴性)例数×100%;阳性预测值=真阳性例数/(真阳性+假阳性)例数×100%;阴性预测值=真阴性例数/(假阴性+真阴性)例数×100%。
1.4 统计学分析

2 结果
2.1 病灶检出情况
96例肝硬化患者经影像学检查共发现110个病灶,病理诊断RN 21个,DN 40个,HCC 49个,分别纳入RN组、DN组及HCC组。
2.2 不同类型结节Gd-EOB-DTPA增强MRI扫描参数比较
HCC组、DN组、RN组ADC值依次升高,组间差异有统计学意义(P<0.05);HCC组T1值、T1值增加率高于DN组和RN组,差异有统计学意义(P<0.05)。见表1。
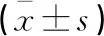
表1 不同类型结节Gd-EOB-DTPA增强MRI扫描参数比较
2.3 Gd-EOB-DTPA增强MRI对HCC的诊断效能
以病理诊断为“金标准”,Gd-EOB-DTPA增强MRI诊断HCC敏感度、特异度、准确度、阳性预测值、阴性预测值、Kappa值分别为90.48%、94.38%、93.64%、79.17%、97.67%、0.80。见表2及表3。
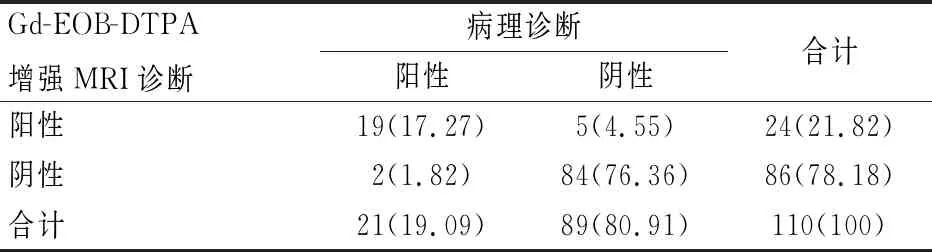
表2 Gd-EOB-DTPA增强MRI与病理诊断结果[n(%)]

表3 Gd-EOB-DTPA增强MRI对HCC的诊断效能
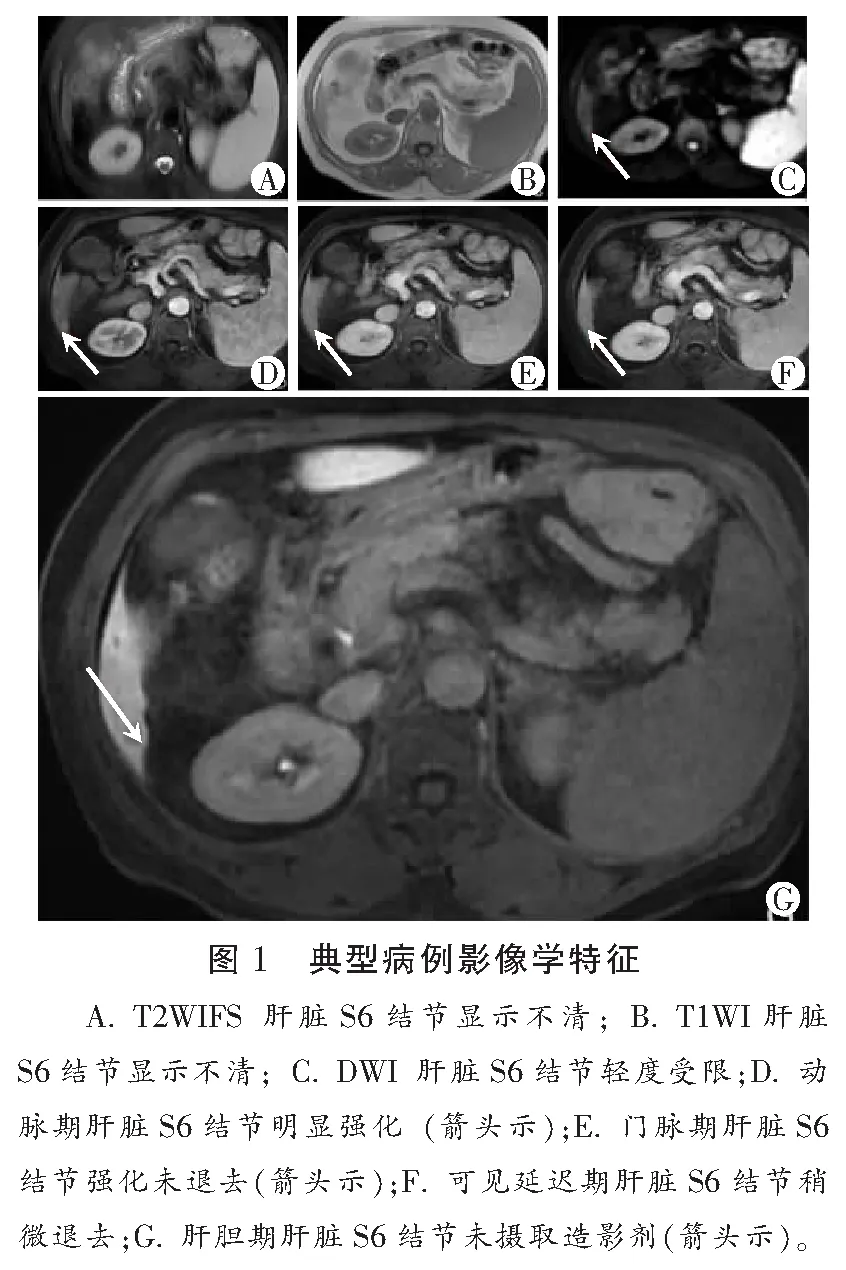
2.4 典型病例影像学特征
患者,女性,57岁,有乙肝病史,发现肝硬化异常结节1年余,Gd-EOB-DTPA MRI增强扫描检查肝脏S6结节。见图1。
3 讨论
肝硬化患者肝脏密度和形态发生显著改变,给肝脏内部结节样病变的鉴别诊断增加了难度[8]。HCC多为肝硬化发展而来,其癌变过程是由RN至DN,再发展到HCC的病理过程[9]。HCC早期介入治疗预后良好,故准确判断肝硬化背景下结节性质,可提高早期诊断率,有助于临床治疗方案的制定,进而降低病死率,改善预后[10]。
MRI检查无创伤,无辐射,且具有较高的软组织分辨率,在腹部病变的诊断中具有一定优势[11]。因RN与HCC结节的供血情况不同,导致二者表现出相反的信号相位,当供血量减少时,门静脉血流量增加,MRI信号减弱,反之供血量增加时,门静脉血流量减少,MRI信号增强[12]。HCC以肝动脉为主要供血动脉,故动脉期可见明显强化[13]。Gd-EOB-DTPA为肝细胞特异性对比剂,是脂溶性EOB与Gd-DTPA结合而成,注射后可与机体血浆蛋白结合,部分经肾脏代谢排出,其余转运至肝脏,被肝脏选择性吸收,使组织粘滞度改变,使T1WI产生高信号,再经胆管排出[14]。HCC不吸收Gd-EOB-DTPA,故呈现低信号,与肝组织信号形成对比,呈现出明显清晰的边界[15]。本研究结果显示,DN与HCC组患者ADC值低于RN组(P<0.05),原因可能是HCC结节增生较为活跃,内部血管与细胞密度增加,ADC值随之降低,同时,良恶性结节内部水分子扩散情况不同,RN内部水分子扩散运动不受影响,而HCC及DN结节内部水分子扩散受限。注射Gd-EOB-DTPA后,HCC组织对比剂浓度在短时间内高于正常肝组织,信号增强,表现为动脉期充填,待肝组织经门静脉摄取对比剂后,HCC组织内部的对比剂浓度开始下降,信号开始减低,整体表现为快进快退[16]。随着b值升高,RN、DN结节由高信号变为低信号,而后逐渐消失,而HCC仍表现为高信号,故可区分出RN与DN结节。
组织的T1弛豫时间与Gd-EOB-DTPA对比剂浓度有关,随着肝细胞分化程度降低,有机阴离子转运肽(OATP)表达减少,导致Gd-EOB-DTPA摄取情况不同,故T1弛豫时间有所差异,肝细胞分化较好的DN对Gd-EOB-DTPA的摄取与正常肝细胞接近[17-18]。DN的T1弛豫时间明显短于HCC,故可鉴别区分HCC与DN结节。肝硬化下,T1值受到肝纤维化程度的影响,采用Gd-EOB-DTPA增强T1 mapping参数T1值增加率,可消除肝脏实质对检查结果的影响,客观反映结节性质[19]。本研究中,DN的T1值增加率低于HCC(P<0.05),原因是DN病灶T1值与周围肝实质无明显差异,而HCC病灶与周围肝实质差异较大。以病理诊断为“金标准”,Gd-EOB-DTPA增强MRI诊断HCC敏感度、特异度、准确度、阳性预测值、阴性预测值、Kappa值分别为90.48%、94.38%、93.64%、79.17%、97.67%、0.80,证实Gd-EOB-DTPA增强MRI鉴别结节肝硬化背景下良恶性结节与病理诊断一致性良好。
综上,肝硬化背景下性质难辨的结节可采用基于肝细胞特异性对比剂Gd-EOB-DTPA的MRI增强扫描进行鉴别诊断,准确鉴别良恶性结节,对于HCC有较高的诊断效能。

