内源抑制物对加拿大紫荆种子萌发的影响
王浩宇,高云鹏,朱铭玮,吴 洋,徐林桥,李淑娴*
(1.南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2.盐城林场,江苏 盐城 224136)
加拿大紫荆(Cerciscanadensis)为豆科(Leguminosae)紫荆属(Cercis)落叶灌木或小乔木,原产于美国东部和中西部地区,是集观赏、药用和生态价值于一身的优良树种,现已在我国很多地区引种栽培。加拿大紫荆花色多样,是春季优良的观花植物,观赏价值较高[1];其树皮、树干、花及果实具有活血通经和祛风解毒等医药功能,是重要的药用植物[2];它还有较强的抗逆性及生态适应性,可用于保持水土及防治沙漠化,具有较高的生态效益。
生产上加拿大紫荆以播种繁殖为主,然而成熟种子的种皮透性差,育苗前需采用热水处理,然后在25℃恒温箱中浸种24 h才能解除其硬实性[3]。与很多豆目植物的种子不同,解除硬实性的加拿大紫荆种子还需要进行一段时间的低温层积处理才能萌发[4],因此加拿大紫荆种子具有物理和生理双重休眠特性[4-5]。种子休眠是植物进化过程中形成的一个重要适应性状[6-7],植物种类不同,造成种子休眠的原因也有差异,其中由内源抑制物引起的生理休眠是很多植物种子休眠的重要原因[7-8]。内源抑制物质是存在于植物种子不同部位(果皮、种皮、胚乳和胚)的化学物质,这些物质即使极微量存在于种子中,也能影响种子的生理活动,如阻碍细胞的分裂、分化、伸长和发育,最终阻碍种子萌发[9-10]。内源抑制物一直是种子休眠的研究热点,杨晓玲等[11]研究发现酚类物质是造成山楂(Crataeguspinnatifida)种子休眠的重要原因,而青钱柳(Cyclocaryapaliurus)果皮中的香草酸对种子萌发有较强的抑制作用[12],也有学者发现脱落酸、茉莉酸和茉莉酸甲酯等对欧洲白蜡(Fraxinusexcelsior)种子的休眠和萌发有重要的调控作用[13]。以往对加拿大紫荆种子休眠原因的探究主要集中在种子吸水机制即物理休眠方面[3,14],对造成其生理休眠的内源抑制物的研究较少。本研究采用系统溶剂法对加拿大紫荆种子种皮及胚乳提取液进行萃取,结合气质联用(GC-MS)与高效液相色谱(HPLC)技术,进行加拿大紫荆种子休眠解除过程中内源抑制物含量动态监测,探究内源抑制物质与加拿大紫荆种子休眠之间的关系,以期为加拿大紫荆种子生理休眠特性研究提供理论依据。
1 材料与方法
1.1 供试材料
试验所用的加拿大紫荆种子采集自美国Elsberry Missouri (90°47′17″W,39°10′9″N)(2018年10月下旬),2019年2月通过上海瑶琪园林科技有限公司进口,种子生活力为98.0%,储存于4 ℃冰箱中待用;发芽试验用的市售白菜(Brassicarapa)种子为矮脚黄,纯度≥95.0%,发芽率≥85.0%。
1.2 种子发芽试验
选取籽粒饱满的加拿大紫荆种子,参照张琪等[3]的方法,采用始温90 ℃的热水处理5 min,再将种子与湿润细沙按体积比1∶3混匀后放入发芽盒中,置于4 ℃冷库中低温层积,定期翻动种子使其保持良好的通气条件,并注意浇水以保持适宜的湿度。分别于层积第0、15、30、45、60天取出一定数量的种子,洗净备用。
随机取上述不同层积阶段的加拿大紫荆种子50粒,重复3次,置于装有湿沙的发芽盒中,在25 ℃、3 000 lx光照培养箱中进行发芽试验,按ISTA(2021)的标准[15]统计种子的发芽率,参考Riis等[16]的方法计算发芽指数。
发芽率=发芽种子总数/试验所用的种子总数×100%;发芽指数=∑Gt/Dt。其中,Dt为发芽天数,Gt为与相对应时间点正常发芽的种子数。
1.3 种子浸提液生物活性测定
加拿大紫荆种子的离体胚不具有休眠特性[5],故仅取热水处理后种子的种皮和胚乳用于相关试验。
1.3.1 种子浸提液制备
在各层积时间段随机数取种子50粒,重复3次(共计18份种子单品),将种皮和胚乳冻干、粉碎后直接称取1 g粉末,加入50 mL 100%甲醇溶液,超声波提取(40 kHz、40 ℃)1 h,静置过夜后过滤浸提液,剩余物中再次加入50 mL 100%甲醇溶液继续浸提,共重复浸提3次,合并所有浸提液[10-11]。将获得的浸提液在40 ℃下旋转蒸发,直至有机提取剂(甲醇)完全去除,最后将获得的固体物质用10 mL 100%(体积分数)甲醇溶液(色谱级)充分溶解[10-11],经0.45 μm微孔滤膜过滤,所得滤液即为种子浸提液(种皮和胚乳浸提液)。
1.3.2 种子浸提液处理下白菜籽发芽试验
取18个培养皿,在其底部各铺一层滤纸,分别加入不同制备阶段的浸提液0.5 mL(对照处理中加0.5 mL蒸馏水),重复3次,置于通风橱中,待有机溶剂甲醇完全挥发(滤纸干燥),再向各培养皿中分别加入5 mL蒸馏水。随机抽取供试白菜种子100粒均匀铺在上述培养皿中,置于25 ℃、3 000 lx光照培养箱中进行发芽试验,3次重复。每8 h统计各处理白菜籽的萌发粒数、发芽时间,直至连续3 d每天的发芽率不超过重复粒数的1%时即认为发芽结束[8,12,16]。计算各处理白菜籽的发芽率和发芽指数[16]。
1.4 种子内源抑制物含量测定
1.4.1 种子不同分离相提取液生物活性的测定
将加拿大紫荆种皮和胚乳浸提液在40 ℃下旋转蒸发,蒸除甲醇后加入蒸馏水定容至10 mL。参照系统溶剂法[10,17],对种皮和胚乳的甲醇提取液进行分离,分别得到石油醚相、乙醚相、乙酸乙酯相、甲醇相和水相提取液;再将种皮和胚乳的4个有机分离相提取液蒸馏浓缩,并用相应有机溶剂定容至10 mL,置于4 ℃冰箱中备用。分别取种皮和胚乳各有机相的提取溶液,以白菜籽为材料(100粒×3个重复)进行生物活性测定。
1.4.2 种子各分离相中提取液有效物质的GC-MS法鉴定
取上述4个有机相的提取液样品送至清华大学分析测试中心,使用GC-MS(Agelient 6890N/5973N,USA)进行内源抑制物分离鉴定。其中,气相色谱条件为:1NNOWAX毛细管柱(30 m×250 μm×0.25 μm);50 ℃保持2 min,再以5 ℃/min升温至280 ℃并维持20 min;载体为高纯氮气,气化室温度为325 ℃。质谱条件为:离子源为EI,离子源温度为200 ℃,电离电压为70 eV,收集电流为300 μA,发射电流为1 mA,仪器分离率为600;扫描范围(m/z)为10~500。
使用GC-MS对各分离相萃取液进行分析,得到各有机相的总离子流色谱图,将总离子进行积分,采用峰面积归一化法,获得各有机物的相对含量。
1.4.3 发芽抑制物半抑制浓度(IC50)的测算
根据GC-MS鉴定结果,筛选出可能对加拿大紫荆种子发芽有影响的物质,购买标准品。参考Zhao 等[17]的方法,将各标准品分别配制成质量浓度为1、10、100、1 000 mg/L的溶液,以蒸馏水为对照进行白菜籽发芽试验,确定各抑制物的生物活性,计算各种标准品对白菜籽的抑制率:抑制率=(A0-A1)/A0×100%。式中:A0为对照组48 h后白菜籽平均胚根长度,mm;A1为处理组48 h后白菜籽平均胚根长度,mm。
以处理组抑制物浓度对数值为X轴,以抑制物的抑制率为Y轴,将所得数据进行线性拟合,根据拟合的回归方程求出lg(IC50),反向求解后可得发芽抑制半抑制浓度(IC50,胚根伸长抑制率达到50%时该抑制物的浓度)。
1.4.4 发芽抑制物标准品标准曲线制备
根据加拿大紫荆种子成分的GC-MS分析结果,参照几种发芽抑制物的半抑制浓度,将油酸、亚油酸、硬脂酸和棕榈酸标准品质量浓度分别稀释为5、10、50、100 mg/L;将2,6-二叔丁基对甲酚(BHT)和邻苯三酚标准品质量浓度稀释为10、50、100 mg/L,以不同的浓度梯度为横坐标,对应的峰面积为纵坐标,确定标准品标准曲线,计算得到5种物质的线性回归方程。
1.4.5 种子浸提液内发芽抑制物含量的测定
将低温层积不同阶段的加拿大紫荆种子浸提液送清华大学化学分析测试中心,采用GC-MS(美国 Agelient 6890N/5973N)定量分析加拿大紫荆种子中脂肪酸(油酸、亚油酸、棕榈酸)含量的变化。气相色谱条件为:TR-WAXMS (Thermo Scientific,30 m×250 μm×0.25 μm) 石英毛细管柱;进样口 250℃,载体为高纯氮气,流量为 1 mL/min,分流比10。升温程序:80 ℃保持2.5 min,以15 ℃/min 升温至210 ℃,然后以2 ℃/min 升至230 ℃保持10 min。质谱条件:离子源为EI;源温为230 ℃;电离电压为70 eV;收集电流为300 μA;发射电流为1 mA;仪器分离率为600;扫描范围 (m/z)为45~500。
采用HPLC(美国 Agelient HP1100)进行加拿大紫荆种子中酚类物质(BHT、邻苯三酚)含量的定量分析。BHT含量测定的HPLC色谱条件:色谱柱为Discovery C18柱(4.6 mm×250 mm,5 μm),柱温35 ℃。流动相为甲醇-水(梯度洗脱),甲醇(体积分数)65%,0~7 min;65%~100%,7~13 min;65%,13~25 min;流速为1.0 mL/min,检测波长280 nm,进样量为10 μL。邻苯三酚含量测定HPLC色谱条件:色谱柱为Discovery C18柱(4.6 mm×250 mm,5 μm),柱温35 ℃;流动相为40%甲醇-60%水(等度洗脱),流速为1.0 mL/min,检测波长280 nm,进样量为10 μL。
1.5 数据分析
采用Excel 2010进行数据整理和制图,以SPSS 23.0对各测定指标进行数据处理、LSD法多重比较和皮尔逊相关性分析。
2 结果与分析
2.1 层积催芽过程中加拿大紫荆种子发芽能力的变化
研究发现,层积0 d时即热水处理后加拿大紫荆种子的发芽率和发芽指数均为0,表明该种子具有明显的休眠特性(表1);随着低温层积时间的延长,发芽率和发芽指数不断上升;层积15 d时,已经有46.0%的种子能够发芽,但种子发芽极不整齐,发芽指数仅为5.6;层积45 d 时,种子发芽率为95.3%,与层积60 d 时的发芽率(97.3%)差异不显著,但二者发芽指数差异显著。表明层积45 d 时,加拿大紫荆种子的休眠已基本解除,但层积60 d 时种子萌发更快、更整齐。
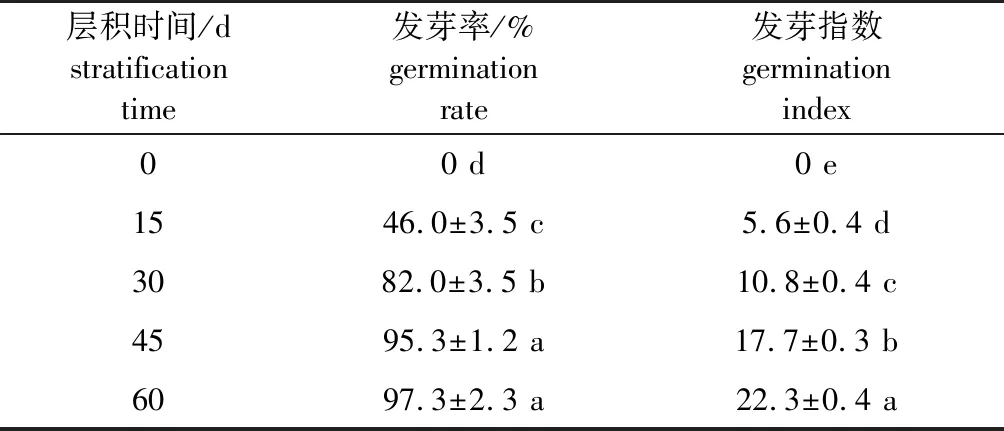
表1 不同层积时间加拿大紫荆种子发芽能力的变化
2.2 层积过程中加拿大紫荆种子浸提液抑制物活性变化
休眠解除过程中加拿大紫荆种子的浸提液对白菜籽发芽能力的影响见表2。采用低温层积0、15、30、45 d种子浸提液处理白菜籽,其发芽率和发芽指数显著低于对照组。层积0 d种子的浸提液处理后,白菜籽的发芽率和发芽指数分别为20.3%和6.8,分别较对照下降了75.8%、80.0%;层积45 d的浸提液处理后,白菜籽的发芽率和发芽指数提高到55.7%和21.0,但较对照仍然下降了33.7%和38.2%;层积60 d时,白菜籽的发芽率进一步提高至82.3%,略低于对照组的发芽率,但差异不显著,发芽指数提高到32.0,与对照组相比差异也不显著。总体来看,低温层积过程中,加拿大紫荆浸提液对白菜籽发芽的抑制作用呈逐渐降低的趋势,说明层积过程中加拿大紫荆种子的休眠在逐渐变浅。
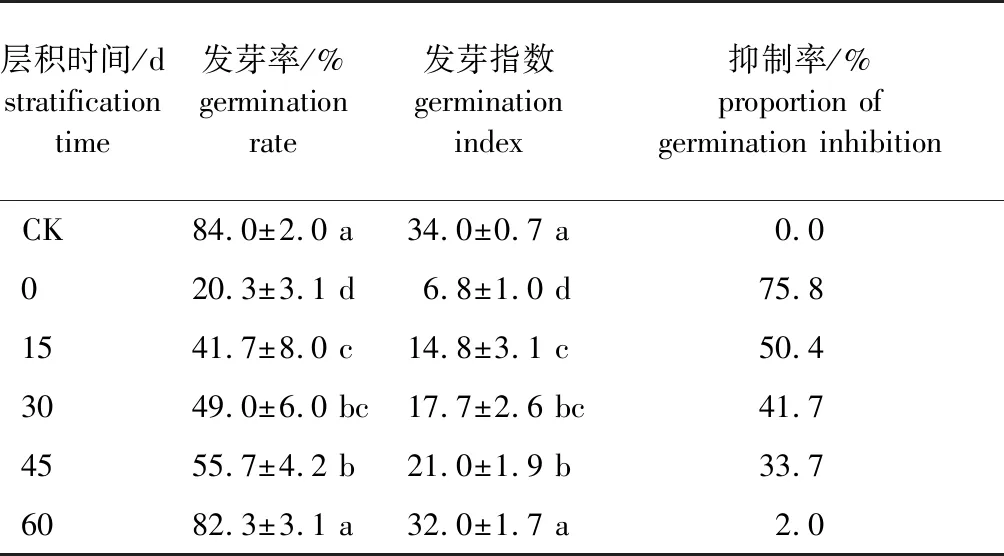
表2 层积不同时间加拿大紫荆种子浸提液对白菜籽发芽能力的影响
2.3 加拿大紫荆种子内源抑制物的抑制活性分析
2.3.1 种皮与胚乳各分离相提取液的生物活性
加拿大紫荆种子种皮和胚乳的各分离相提取液对白菜籽发芽率和发芽指数的影响见表3。由表3可知,种皮和胚乳的各分离相提取液对白菜籽发芽的影响不尽相同。其中乙醚相和甲醇相的提取液使白菜籽的发芽率显著下降,并且乙醚相提取液的抑制作用最强,处理后白菜籽发芽率由对照的91.0%下降到54.7%,下降了39.9%;甲醇相提取液处理后白菜籽发芽率为65.0%,较对照下降了28.6%。而石油醚相、乙酸乙酯相和水相提取液处理后的白菜籽发芽率与对照相比无显著差异。
种皮和胚乳各分离相提取液对白菜籽发芽指数均有一定的抑制作用,且除石油醚相提取液外,其余各相提取液均使得白菜籽发芽指数显著下降。各分离相提取液中,乙醚相的抑制作用最强,处理后发芽指数由对照的15.4下降到6.2;其次是甲醇相,发芽指数下降到7.0,下降了54.5%;乙酸乙酯相和水相,白菜籽的发芽指数分别为8.5和7.8,较对照显著下降了44.8%和49.4%。由于发芽指数能够更好地反映种子质量的变化[15-16],根据发芽指数,本研究上述5个分离相提取液对白菜籽发芽抑制作用由大到小依次为:乙醚相>甲醇相>水相≈乙酸乙酯相>石油醚相。
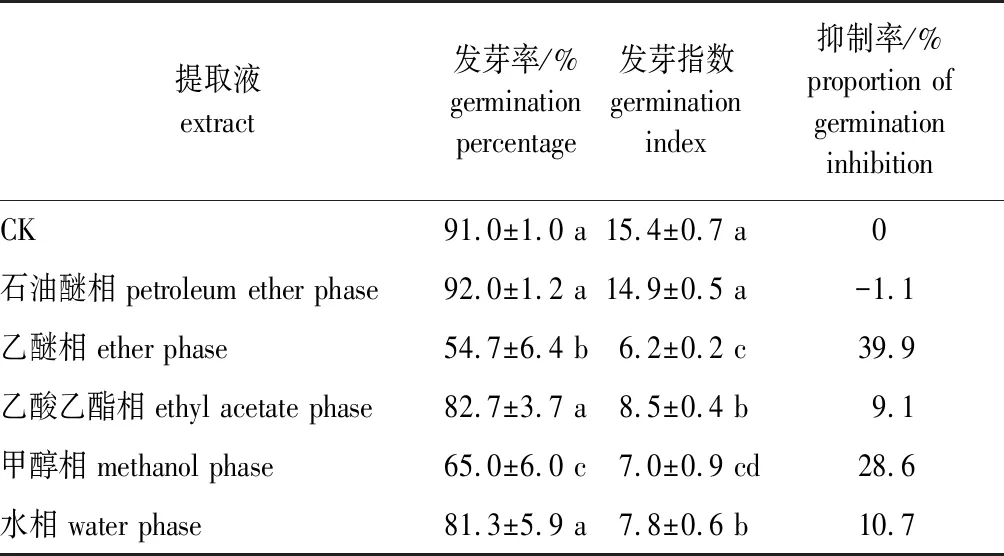
表3 加拿大紫荆种子种皮与胚乳的各相提取液对白菜籽发芽的影响
2.3.2 种皮和胚乳各分离相提取液的GC-MS鉴定结果
采用GC-MS分析得到种皮和胚乳各有机相提取液的总离子流色谱图,通过质谱系统检索并与标准图谱进行核对,选择总离子流色谱图中峰面积较大、相似度较高(高于80%)的波峰,将得到的吻合性较好的物质列于表4。由表4可知,种皮和胚乳石油醚相、乙醚相、乙酸乙酯相、甲醇相提取物中分别鉴定出25、14、14、10种物质。由于甲醇相、乙醚相、乙酸乙酯相提取物对白菜籽发芽的抑制作用较强,因此认为造成加拿大紫荆种子难以萌发的内源抑制物质主要存在于上述3个有机相提取物中,并且推测其中相对含量较高的油酸、亚油酸、棕榈酸、硬脂酸、邻苯三酚可能对加拿大紫荆种子萌发具有较强的抑制作用。由于乙醚相对白菜籽发芽的抑制作用最强(表3),而采用GC-MS技术鉴定出的乙醚相的物质(表4)主要是有机酸类、醇类等物质,已有研究表明它们对白菜籽发芽的影响并不是特别大,故推测某种含量较低的物质可能对种子萌发有一定影响。进一步筛查发现,该相中存在2,6-二叔丁基对甲酚(BHT)(由于其相对含量较低,仅0.61%,故表4中没有列出)。Zhao等[17]和朱铭伟等[18]研究发现,BHT对很多种子的萌发有重要影响,因此推测BHT可能对加拿大紫荆种子萌发具有一定的抑制作用。综上,在加拿大紫荆种子抑制作用较强的3个有机相中筛选出油酸、亚油酸、棕榈酸、硬脂酸、BHT、邻苯三酚等6种可能对加拿大紫荆种子萌发具有抑制作用的有机物。
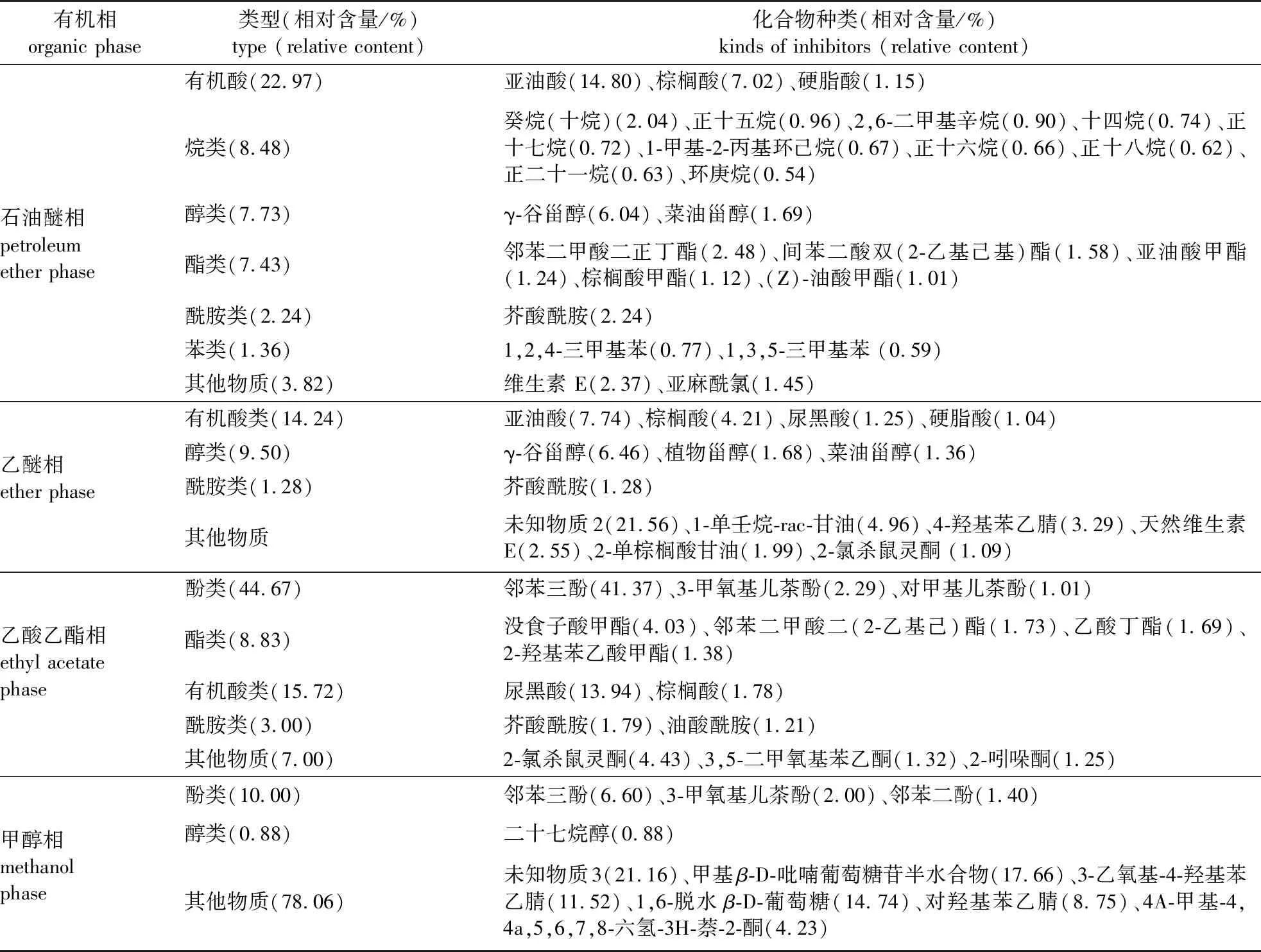
表4 种皮和胚乳各分离相化合物的种类及相对含量
2.3.3 几种化合物半抑制浓度(IC50)的确定
首先进行标准品BHT抑制中浓度的确定。种皮和胚乳提取物中BHT质谱图与计算机检索谱图的吻合性为96%。对BHT标准品不同浓度进行生物测定,得到拟合方程:y=-1.936 7x3+13.587 7x2-11.566 9x+39.205 0(R=0.937 9),经反对数求出IC50为54.83 mg/L,即白菜籽胚根生长抑制率达到50%时BHT的质量浓度为54.83 mg/L,说明较低含量的BHT即可对白菜籽胚根的伸长起到较强的抑制作用。
按照相同的方法确定其他化合物的拟合方程及半抑制浓度(IC50),结果见表5。由表5可知,较低浓度的邻苯三酚也会对白菜籽的发芽有较为显著的影响,棕榈酸、亚油酸和硬脂酸的IC50较BHT和邻苯三酚明显要高很多,而油酸对白菜籽发芽基本没有抑制作用,故后续试验只进行另外5种物质含量变化的研究。
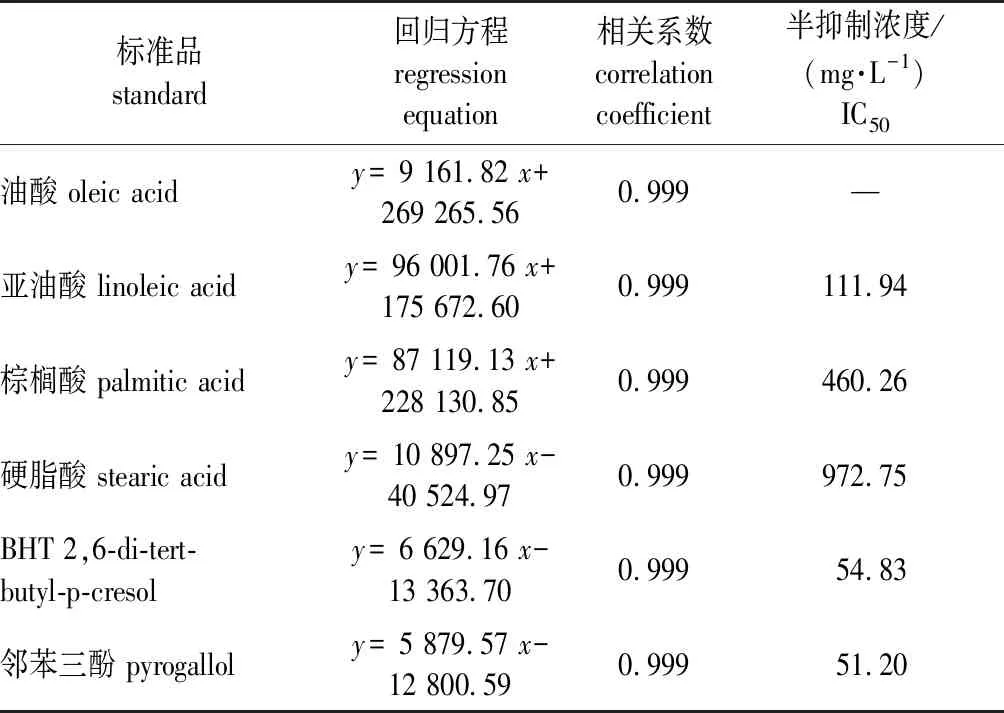
表5 抑制物质标准品的回归方程及IC50
2.3.4 层积过程中加拿大紫荆种子中内源抑制物质量浓度的动态变化
休眠解除过程中加拿大紫荆种子中内源抑制物质量浓度的变化如图1所示。随着层积时间的延长,种子中棕榈酸、硬脂酸、BHT和邻苯三酚4种物质的质量浓度均呈逐渐下降的趋势。4种物质中,邻苯三酚质量浓度的下降幅度最明显,0 d时其质量浓度为325.88 mg/L,比IC50(51.20 mg/L)高出5倍多;层积45 d(休眠基本解除)时,质量浓度迅速下降到18.72 mg/L,远低于IC50,比0 d时下降了94.26%;层积60 d时,质量浓度仅为12.57 mg/L,比0 d时下降了96.14%。层积过程中,棕榈酸质量浓度由15.25 mg/L(0 d)下降到8.78 mg/L(60 d),下降了42.43%;硬脂酸质量浓度由层积前的20.23 mg/L下降到9.71 mg/L(层积60 d),下降了52.00%;BHT的质量浓度在层积过程中变化不太大,仅由层积前的6.07 mg/L下降到5.72 mg/L,下降了5.77%。总的来说,层积过程中,加拿大紫荆种子中棕榈酸、硬脂酸、BHT的质量浓度虽然都呈下降的变化趋势,但下降幅度远低于邻苯三酚;棕榈酸、硬脂酸、BHT三者层积前的质量浓度均远低于IC50,因此它们在加拿大紫荆种子休眠中的抑制作用要弱于邻苯三酚。层积过程中亚油酸的质量浓度呈先下降(0~15 d)再上升(15~45 d)再下降(45~60 d)的变化趋势。
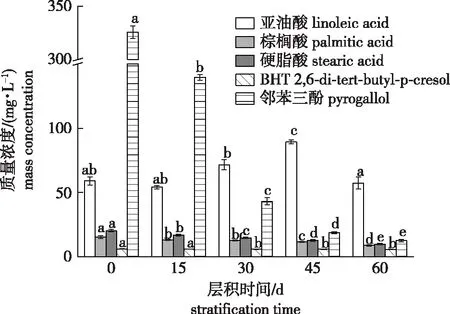
不同小写字母表示同一物质质量浓度在不同层积时间差异显著(P<0.05)。Different lowercase letters indicate significant difference among dormancy release stages of the same substance.图1 加拿大紫荆种子休眠解除不同阶段抑制物质含量的变化Fig.1 Changes of inhibitory substances in C. canadensis seeds at different stages of dormancy release
2.4 层积过程中加拿大紫荆种子各指标相关性分析
层积时间与种子发芽率和发芽指数以及层积过程中棕榈酸、硬脂酸、BHT、邻苯三酚质量浓度6项指标之间的相关系数呈一定的相关性(表6)。具体来看:层积时间与发芽率、发芽指数之间的相关系数分别为0.924(P<0.05)和0.999(P<0.01);层积时间与棕榈酸、硬脂酸、BHT和邻苯三酚质量浓度之间呈显著负相关关系(P<0.05),而层积时间与亚油酸质量浓度之间无显著相关。由表6还可以发现,硬脂酸、BHT和邻苯三酚质量浓度与发芽率和发芽指数之间有着显著负相关关系,棕榈酸质量浓度仅与发芽指数呈显著负相关关系,亚油酸质量浓度与发芽率和发芽指数间无相关关系。综上所述,层积过程中,加拿大紫荆种子中棕榈酸、硬脂酸、BHT、邻苯三酚4种物质质量浓度与层积时间、发芽能力有着显著的负相关关系,可能的原因是低温层积处理改变了种皮透性,促进了内源抑制物的外渗,或通过激活水解酶加速内源抑制物的代谢分解。
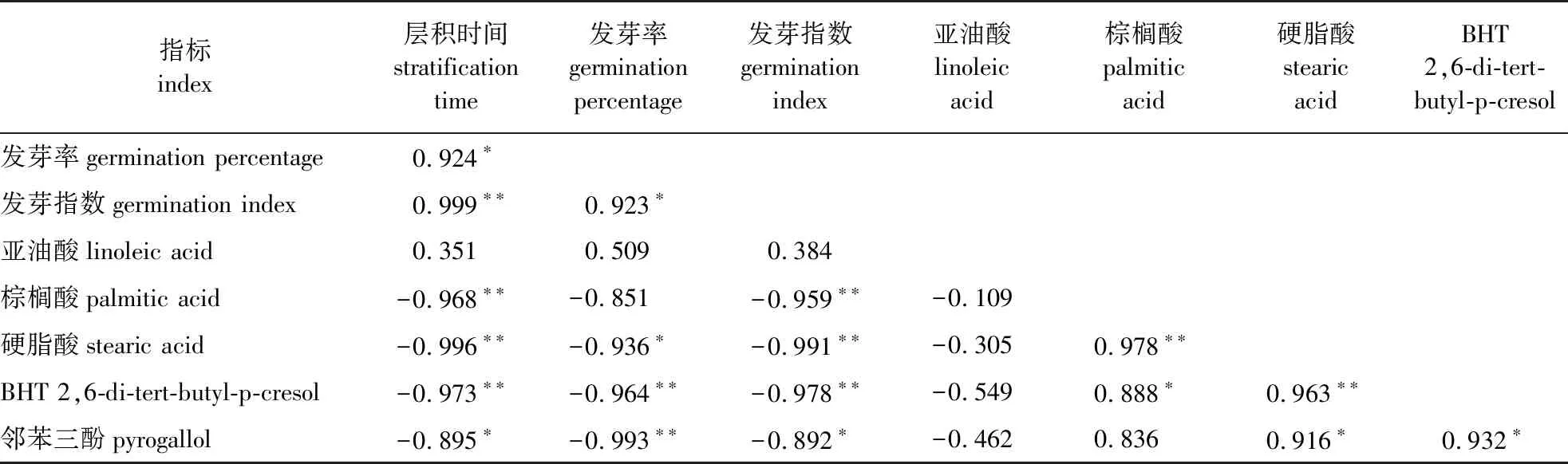
表6 休眠解除过程中加拿大紫荆种子各指标相关性分析
3 讨 论
3.1 加拿大紫荆种子内源抑制物的种类
内源抑制物是许多植物种子休眠的主要原因[19-20]。廖源林等[10]发现野鸦椿(Euscaphisjaponica)种壳和胚中的酚酸类、碱类抑制物是种子深度休眠的主要原因。史雷[21]在曼陀罗(Daturastramonium)种皮和种仁中发现了水溶性和脂溶性的萌发抑制物质。Gao等[22]在紫荆(C.chinensis)种子休眠的研究中发现,种皮和胚乳浸提液对白菜籽萌发具有较强的抑制作用,认为抑制物质是其生理休眠的主要原因。本研究中热水处理即解除物理休眠后的加拿大紫荆种子(层积0 d)仍不能顺利萌发,因此推测该种子同样具有生理休眠特性。层积0 d时种皮与胚乳浸提液处理白菜籽,其发芽率和发芽指数分别为20.3%和6.8,分别较对照下降了75.8%、80.0%,说明浸提液中存在抑制活性较强的物质。随着层积时间的延长,加拿大紫荆种子的发芽率在不断提高,此过程中浸提液对白菜籽发芽的影响在逐渐减弱,可能的原因是低温层积处理改变了种皮透性促进了内源抑制物外渗,或通过激活水解酶加速内源抑制物的代谢分解[22-23]。说明种皮与胚乳中的内源抑制物是造成加拿大紫荆种子生理休眠的主要原因之一。
对种子内源抑制物的研究通常采用系统溶剂法[10,12]。张艳杰等[24]采用该方法对南方红豆杉(Taxusmairei)种子各有机相提取液进行生物活性测定时发现,抑制物质主要存在于乙醚相和甲醇相提取液中;尚旭岚等[12]对青钱柳种子果皮的浸提液进行分离,发现抑制物质主要存在于果皮浸提液的乙醚相中;孙晓刚等[25]的研究认为,‘凤丹’牡丹(Paeoniaostii‘Fengdan’)种子胚乳乙醚相提取液中的化合物,可能是导致‘凤丹’种子萌发受抑制的主要原因。本研究对加拿大紫荆种子种皮和胚乳成分进行生物活性测定,结果表明,5个分离相提取液对白菜籽萌发的抑制作用从大到小依次为乙醚相>甲醇相>水相≈乙酸乙酯相>石油醚相,结合5个分离相对白菜籽发芽率及发芽指数影响的试验,认为发芽抑制物质主要存在于抑制作用较强的乙醚相、甲醇相和乙酸乙酯相提取液中,这与史锋厚等[26]、韩宝瑞等[27]的研究结果相似。
造成种子休眠的内源抑制物质种类不尽相同。有学者在研究中发现酚类、有机酸类、酯类和醛类物质可能是种子中影响发芽的内源抑制物质[23,28-29],它们通过抑制种子的呼吸[30-31]、酶活性[10,32-33]、胚的生长[34]对种子的萌发起到一定的抑制作用。Einhellig[33]的研究发现,酚酸类物质对种子萌发关键酶的活性具有较强的抑制作用,这可能是酚酸类物质抑制种子萌发的主要原因。李淑娴等[35]在乌桕(Sapiumsebiferum)种子休眠机理的研究中发现,BHT对乌桕种子萌发具有显著的抑制作用。王艳华[36]在大山樱(Prunussargentii)种子休眠研究中发现,硬脂酸、棕榈酸等有机酸类是种子内的重要抑制物质。本研究从加拿大紫荆种子抑制作用较强的乙醚相、甲醇相和乙酸乙酯相提取液中鉴定出了亚油酸、棕榈酸、硬脂酸、BHT、邻苯三酚共5种可能具有萌发抑制活性的化合物它们的半抑制浓度(IC50)显示对发芽的抑制作用由强到弱的顺序为邻苯三酚>BHT>亚油酸>棕榈酸>硬脂酸。
3.2 内源抑制物与加拿大紫荆种子休眠的关系
多数发芽抑制物的抑制作用与其在种子中的浓度显著相关,且通常表现为高浓度具抑制作用[11,37]。杨晓玲等[11]的研究发现,成熟的山楂种子中酚类物质含量较高,低温层积过程中种子中酚类物质的含量急剧下降,有利于种子休眠解除。胡晓辉等[38]在落花生(Arachishypogaea)种子休眠特性的分析中发现,种子休眠与油酸和烯酸含量呈显著正相关关系,与棕榈酸和亚油酸含量呈显著负相关关系。为了进一步探讨筛选出的5种内源抑制物对加拿大紫荆种子顺利萌发的影响,对其在种子层积过程中质量浓度的变化进行了测定,发现随着层积时间的延长,棕榈酸、硬脂酸、BHT、邻苯三酚的质量浓度均呈显著下降的趋势,且硬脂酸、BHT和邻苯三酚与种子发芽率和发芽指数均有显著的负相关关系,棕榈酸仅与发芽指数呈显著负相关关系。由于棕榈酸、硬脂酸、BHT这3种物质在层积前的质量浓度就比较低,远低于半抑制浓度,因此它们各自对加拿大紫荆种子休眠的影响可能不是特别大,特别是BHT,其层积前后仅相差5.77%。而邻苯三酚含量的变化则不同,层积前其体积质量为325.88 mg/L,比IC50(51.20 mg/L)高出5倍多,层积45 d时体积质量仅为18.72 mg/L,远低于其IC50,较0 d时下降了94.3%,此时,加拿大紫荆种子的发芽率由层积前的0提高到了95.3%,因此休眠解除过程中含量变化最大的邻苯三酚可能是导致其休眠的主要抑制物质,由此也可以推测,加拿大紫荆种子休眠过程中酚类化合物比酸类化合物有更强的抑制效果,这与杨晓玲等[11]、Gao等[23]的研究结果相似。此外,休眠解除过程中,亚油酸含量呈先下降后升高再下降的变化趋势,其与种子发芽率和发芽指数无相关关系,且0 d时亚油酸的含量远低于抑制中浓度。因此,亚油酸可能对加拿大紫荆种子休眠的影响不是特别大,更可能是作为营养物质为种子的萌发提供能量[39-40]。
总之,加拿大紫荆种子具有物理和生理双重休眠,且种皮与胚乳中的内源抑制物是其生理休眠的主要原因之一。对加拿大紫荆种子内源抑制物的抑制活性进行分析,在抑制作用较强的乙醚相、甲醇相和乙酸乙酯相提取液中,鉴定出了亚油酸、棕榈酸、硬脂酸、BHT、邻苯三酚共5种可能具有萌发抑制活性的化合物,对比5种发芽抑制物质在种子层积过程中含量的变化以及其抑制中浓度,笔者认为休眠解除过程中含量变化最大的邻苯三酚可能是其休眠的主要抑制物质。本研究仅从内源抑制物角度探讨了加拿大紫荆种子生理休眠的原因,但GC-MS技术不能鉴定出激素类物质,因此内源激素对加拿大紫荆种子萌发的影响还有待进一步研究。

