柔性碳基复合纳米纤维膜光催化降解PET纤维与析氢
朱永军, 宋立新, 熊 杰
(浙江理工大学 a.材料科学与工程学院; b.纺织科学与工程学院(国际丝绸学院),杭州 310018)
聚对苯二甲酸乙二醇酯(PET)被广泛用于纺织纤维、薄膜和包装瓶[1-2],也是目前塑料产业中消耗量和废弃率最高的塑料品种之一[3-4]。特别是废弃的PET纤维,由于其自身难以降解的致命弱点,给生态环境带来了巨大影响。近年来,随着环保意识不断增强,PET的回收再利用成为研究的热点[5-6]。目前,回收PET的方法有热机械回收、糖酵解、氨酵解、甲烷酵解和水解转酯化等[7]。上述化学回收法会形成难以分离的副产品,并且需要大量的溶剂和过量的降解剂。尽管如此,PET的回收效率仅50%,因此迫切需要开发更高效的回收技术。
随着全球经济的不断发展,能源问题日益严峻,目前传统的可再生能源(太阳能、风能、水能和生物能源)存在间歇性的问题。寻找新型绿色能源变得尤为重要,其中H2具有质量轻、可储存及绿色环保等优点,成为备受关注的新一代绿色能源[8]。近年来有研究将PET作为牺牲剂,通过催化剂的光反应还原水产生H2[9-10],同时将PET氧化成有价值的化学品。此前已有利用太阳光重整降解PET同时析氢的相关报道,如TiO2/Pt[11]光催化剂和CdS/CdOx[12]量子点,但它们却存在价格昂贵或有毒等问题。近年CNx/Ni2P[13]光催化剂因其绿色和廉价而受到关注,然而由于其在使用后不容易被分离出来,因此很难实现光催化剂的回收,并可能造成二次污染。
为了克服这些问题,本文提出利用静电纺丝技术和水热合成技术将二氧化钛负载在碳纳米纤维膜(TiO2/C纳米纤维膜)和多晶型磷化镍(Ni2P-NiP2)结合,形成一种柔性、可回收的光催化剂。作为昂贵金属的替代品,绿色和廉价的助催化剂多晶型磷化镍也表现出优异的性能。本文证明了该催化体系可以在碱性条件下使用,在室温下从PET中产生有机化学品并水解制氢。Ni2P-NiP2/TiO2/C纳米纤维膜的柔韧性不仅为催化剂提供了循环利用的优势,而且增强了其稳定性,10次循环的重复实验后仍表现出良好的析氢性能。这进一步拓展了静电纺丝法制备的光催化剂在废旧塑料回收中的应用。
1 实 验
1.1 材料与仪器
材料:Mw=1 300 000聚乙烯吡咯烷酮(PVP)、97%异丙醇钛(Tip)、分析纯N,N-二甲基甲酰胺(DMF)、分析纯硝酸镍(Ni(NO3)2·6H2O)、分析纯氟化铵(NH4F)、分析纯尿素(CH4N2O)、分析纯红磷(P)、聚对苯二甲酸乙二醇酯(PET纤维)、分析纯氢氧化钾(KOH)(上海阿拉丁生化科技股份有限公司),分析纯冰乙酸(CH3COOH)(杭州高精晶细化工有限公司),去离子水(实验室自制),分析纯无水乙醇(天津市富宇精细化工有限公司),37%浓盐酸(HCl)(上海凌峰化学试剂有限公司),分析纯丙酮(C3H8O)(上海市三鹰化学试剂有限公司)。
仪器:BSA123S电子天平(德国赛多利斯集团),08-2G恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司),静电纺丝装置(实验室自制),DZF-6020真空干燥箱(上海精宏实验设备有限公司),GSL-1700X管式炉(合肥科晶材料技术有限公司),1510E-DYH超声清洗剂(美国必能信超声有限公司),FESEM,ZEISS ULTRA 55场发射扫描电子显微镜(德国蔡司),D8 discoverX射线衍射(德国BrukerAXS),K-AplhaX射线光电子能谱(美国Thermo Fisher Scientific公司),UH4150紫外可见光漫反射光谱(日本日立公司),AVANCE AV400MHz核磁共振波谱仪(瑞士Bruker公司),YZ-GHX-A光学反应仪(岩征仪器有限公司),GC-TCD气相色谱仪(杭州捷岛科技有限公司)。
1.2 方 法
首先,柔性Ni2P-NiP2/TiO2/C纳米纤维膜是通过静电纺丝技术碳化、水热处理和磷化处理制备的,如图1(a)所示。具体过程如下:将0.96 g聚乙烯吡咯烷酮、0.3 mL冰乙酸、0.7 g异丙醇钛溶解在6 mL的N,N-二甲基甲酰胺,然后将它们不断搅拌12 h以形成静电纺丝溶液。随后,将溶液在接地的收集器上进行静电纺丝,流速0.8 mL/h,电压15 kV,收集距离15 cm,经过8 h纺丝获得前体纳米纤维膜。随后,将前体纳米纤维膜在管式炉240 ℃的空气中热稳定2 h,并在800 ℃的氮气下以2 ℃/min的加热速率碳化2 h,获得TiO2/C纳米纤维膜。

图1 纳米纤维膜合成路线示意和扫描电子显微镜照片Fig.1 Schematic diagram of nanofiber membrane synthesis route and SEM images
随后,在TiO2/C纳米纤维膜上水热合成氢氧化镍(Ni-OH),用丙酮和2M HCl预清洗,然后用去离子水和乙醇洗涤。在典型的水热合成中,2 mmol Ni(NO3)2·6H2O、8 mmol尿素和6 mmol NH4F完全溶解在20 mL去离子水中形成均匀溶液。将制备的透明溶液和TiO2/C纳米纤维膜(2 cm×2 cm)转移到100 mL聚四氟乙烯内衬的不锈钢高压釜中,并在150 ℃下保持12 h。反应结束后,高压釜自然冷却至室温,所得样品用乙醇和去离子水洗涤3次。然后,将样品在60 ℃的烘箱中干燥,获得柔性Ni-OH/TiO2/C纳米纤维膜。
最后对Ni-OH/TiO2/C纳米纤维薄膜进行磷化处理。即红磷和Ni-OH/TiO2/C纳米纤维膜分别放置在瓷船中,要求红磷被放置在管式炉的上游侧,Ni-OH/TiO2/C纳米纤维膜放置在下游侧。在N2气氛中以5 ℃/min的升温速率保持550 ℃ 2 h,冷却至室温后得到柔性Ni2P-NiP2/TiO2/C纳米纤维膜。
1.3 测试与表征
使用ZEISS ULTRA 55型场发射扫描电子显微镜和能谱仪对纳米纤维膜分别进行表面形貌观察及元素分析。使用D8 discover型X-射线粉末衍射仪测试材料的晶体结构。采用K-Aplha型X-射线光电子能谱测试材料表面原子价态。使用UH4150型UV-vis漫反射光谱测试材料对紫外可见光的吸光度。在AVANCE AV400MHz型核磁共振波谱仪上收集1H NMR和13C NMR光谱。所有NMR样品,包括光催化前后的聚合物,均在10 mol/L NaOD的D2O溶液中制备,样品浓度为25 mg/mL。使用GC-TCD型气相色谱收集催化反应产生的氢气。
聚合物(PET)在催化实验之前需要经过预处理。将PET(25 mg/mL)浸泡在10 mol/L的aq·KOH水溶液中,随后将密封小瓶以400 r/min的速度在40 ℃下搅拌24 h。然后将所有溶液用于催化实验,包括未完全溶解的聚合物片段。在光催化实验中,将200 mg光催化剂Ni2P-NiP2/TiO2/C NFs薄膜和10 mL预处理溶液置于55 mL石英光反应器中,然后在环境压力下用N2吹扫10 min。之后,将容器用硅橡胶隔片密封并放入装有500 W汞灯的光化学反应装置中。所有样品均以400 r/min的转速搅拌,并在辐照期间保持在20 ℃的恒温。为了量化气体逸出,使用微升注射器定期从试管中抽取400 μL的气体体积,并使用气相色谱仪评估气体逸出量,包括H2、O2和CO2。
所有分析测量均以算数平均值±标准偏差(σ)的形式给出。每克底物的H2产量Yield(μmolH2/gsub)和σ分别由下式计算得到。
(1)
(2)
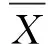
2 结果与分析
2.1 Ni2P-NiP2/TiO2/C表面形貌与结构表征
使用SEM对Ni2P-NiP2/TiO2/C纳米纤维膜的微观形态和组分进行表征。图1(b)为经过800 ℃碳化后的TiO2/C复合纳米纤维膜,纳米纤维之间相互独立,分布均匀,且表面粗糙,纤维膜表面镶嵌着少量纳米颗粒。图1(c)为经过水热处理后的Ni-OH/TiO2/C复合纳米纤维膜,纳米纤维膜呈现出连续且随机分布的纤维状,纳米纤维膜表面被大量纳米片包覆,但分布较为分散,出现部分团簇现象。图1(d)展示了经过高温磷化处理后的Ni2P-NiP2/TiO2/C复合纳米纤维膜,大量的纳米片包覆在纳米纤维膜表面,从局部放大图中看出纳米片上分布着一层纳米颗粒。纳米纤维膜表面粗糙,呈现纤维状,部分纳米纤维膜与团簇的纳米片连接在一起。为了进一步确定纳米纤维膜表面元素组成,本文对Ni2P-NiP2/TiO2/C复合纳米纤维膜进行了能量色散X射线元素映射表征。在图2(a)的元素映射中可以观察到C、Ti、O、P和Ni均匀地分布NFs上。结合图2(b)的EDS可以看出,Ni和P被成功地负载在纳米纤维膜上。
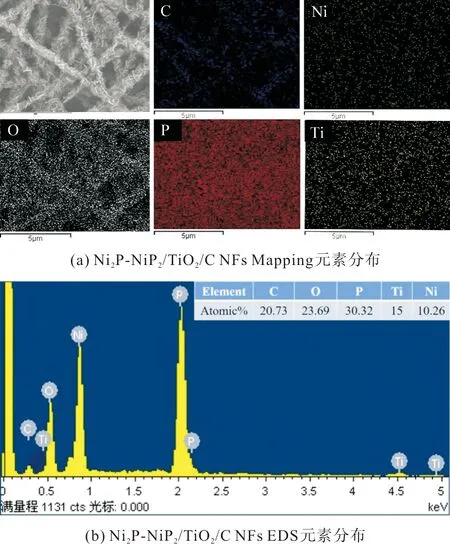
图2 Ni2P-NiP2/TiO2/C纳米纤维膜的元素分布Fig.2 Elemental distribution of Ni2P-NiP2/TiO2/C NFs
为了进一步确认纳米纤维膜的晶体结构,本文对样品进行了X射线衍射(XRD)测试。从图3中的XRD结果显示,水热处理加热后,样品上有Ni(OH)2(PDF #14-0117)形成。磷化处理后,2θ=40.7°、44.5°、47.3°、54.2°、54.9°和74.6°处的峰是Ni2P(PDF #03-0953)的特征衍射,分别对应于(111)(201)(210)(300)(211)和(400)的晶面,以及2θ=28.2°、32.7°、36.6°、40.3°、46.9°、55.6°、58.4°、61°、63.5°、75.6°和77.9°处的峰是NiP2(PDF #21-0590)的特征衍射,分别对应于(111)(200)(210)(211)(220)(230)(321)(331)和(420)的晶面。此外,Ni(OH)2的衍射峰基本消失,这说明复合纳米纤维膜被完全磷化。因此,可以确定Ni2P-NiP2/TiO2/C纳米纤维膜被成功制备。结合SEM的结果,说明Ni2P-NiP2纳米片位于纳米纤维膜的表面。
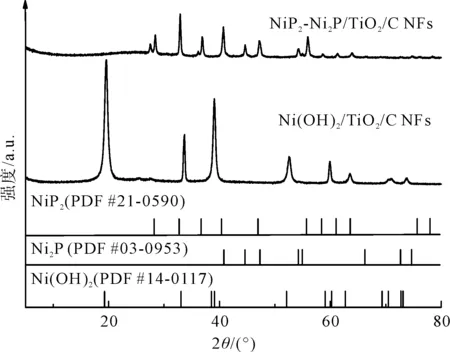
图3 Ni2P-NiP2/TiO2/C纳米纤维膜和Ni(OH)2/TiO2/C 纳米纤维膜的XRD图谱Fig.3 XRD pattern of Ni2P-NiP2/TiO2/C NFs and Ni(OH)2/TiO2/C NFs
Ni2P-NiP2/TiO2/C纳米纤维膜表面各元素的电子组成是通过X射线光电子能谱(XPS)测量确定。如图4(a)所示,Ni 2p3/2在854 eV的峰值可以归因于Ni-P化合物中部分带电类别的Ni(Niδ+,δ可能接近于0)存在,而位于857.28 eV左右的峰值可以归因于氧化镍中的Ni2+。对于Ni 2p1/2,在Ni-P化合物中对应于Niδ+的峰位于871.4 eV,而对应于Ni2+的峰则位于875 eV。863.4 eV和881 eV处的峰分别是Ni 2p3/2和Ni 2p1/2的卫星峰。此外,在P 2p的光谱中可以观察到两个双峰,主要结合能为129.39 eV和134.92 eV(图4(b))。129.39 eV的结合能略低于P元素(130.0 eV),表明P是部分带负电的(Pδ-,0<δ<2)[14]。这些结果清楚地表明,电子从Ni转移到P,这与观察到的Ni2P-NiP2的形成是一致的[15]。其中Ti 2p的峰并不尖锐,分析认为是由于磷化后大量的纳米片包覆在纳米纤维表面所造成的。从图4(c)可以看出,465.05 eV和458.97 eV的结合能分别归属于Ti 2p1/2和Ti 2p3/2,属于锐钛矿中的Ti4+。同样,未检测到明显的Ti—O峰,如图4(d)所示,在532.31 eV处的O—H峰,可能归因于纤维表面的吸附氧及没有完全磷化的Ni(OH)2。

图4 Ni2P-NiP2/TiO2/C纳米纤维膜的XPS图谱Fig.4 XPS patterns of Ni2P-NiP2/TiO2/C NFs
2.2 Ni2P-NiP2/TiO2/C光学性能表征
通过紫外可见分光光度计测试所制备的光催化剂的吸收光谱,如图5所示,TiO2/C纳米纤维膜在320 nm处出现了吸收峰值,这与TiO23.2 eV的带隙一致。经过水热处理后,纳米纤维膜在可见光段(400~800 nm)的吸光能力大幅提高,这主要归因于Ni基氢氧化物的散射作用。当高温磷化处理后,纳米纤维膜在整个光区的吸光度都有所增加,分析认为是由于Ni2P-NiP2纳米片的形成,进一步增强了对光的散射。其中,Ni2P-NiP2/TiO2/C纳米纤维膜在330~380 nm处出现吸收峰值,随后在可见光区域吸光度略有降低。值得注意的是,复合纳米纤维膜光催化剂在整个光区都表现出良好的吸光度,主要是由于使用碳纳米纤维膜作为载体时,纤维状碳基质可以减少光的反射。

图5 Ni2P-NiP2/TiO2/C纳米纤维膜紫外-可见光吸收光谱Fig.5 UV-Vis absorption spectra of Ni2P-NiP2/TiO2/C NFs
2.3 Ni2P-NiP2/TiO2/C催化性能测试
本文通过检测PET的降解及析氢效果来研究Ni2P-NiP2/TiO2/C纳米纤维膜的催化性能。为了直观地观察Ni2P-NiP2/TiO2/C纳米纤维膜对PET降解的效果,对实验前后的PET纤维做了SEM测试。如图6(a)所示,未使用的PET纤维表面光滑平整。在经过碱溶液预处理后,PET纤维膜表面出现杂质,且纤维出现褶皱情况,如图6(b)所示。经过12 h的光催化实验后,光滑的PET纤维表面被严重破坏,从图6(c)可以看出纤维表面甚至出现裂纹,初步显示该纳米纤维膜对PET纤维具有降解作用。

图6 PET纤维催化前后扫描电镜照片Fig.6 SEM images of PET fibers before and after catalysis
随后本文收集了该系统析氢效率的数据。首先评估了PET对光催化析氢的影响,如图7(a)所示,可以很明显看到在没有PET的情况下,Ni2P-NiP2/TiO2/C纳米纤维膜在KOH水溶液中产生的氢气可以忽略不计。通常认为这种光反应是光催化剂通过吸收能量大于或等于自身带隙的光子,从而激发出的电子从价带迁移到导带,从而产生电子空穴对。其中空穴被加入的空穴清除剂(如TEOA)吸收,电子则将水中质子还原成H2。KOH水溶液中缺少牺牲剂,单纯催化水解在热力学上是极其困难的。然而当PET作为牺牲剂时,可以更有效地与H+结合,减少载流子复合,从而有效促进H2的释放[16]。此外,与TiO2/C纳米纤维膜相比负载了Ni2P-NiP2的纳米纤维膜的光催化析氢性能显著提高,如图7(b)所示。这主要是由于Ni2P-NiP2是一种很好的电子传输材料,能够有效地提升析氢效率。作为光催化剂载体的柔性碳纳米纤维膜(图7(c))不仅可以在高pH值环境中保持良好的稳定性,而且方便的回收利用使其具有多种用途。在这方面,本文对相同的纳米纤维膜进行了多次循环光催化实验,结果如图7(d)所示。经过5次催化循环和10次催化循环后,Ni2P-NiP2/TiO2/C纳米纤维膜的析氢活性略有降低,分析认为这是由于Ni2P-NiP2在强碱环境中被部分氧化而造成的,但催化剂整体上仍保持高效的析氢性能。

图7 析氢效率测试和实物照片Fig.7 Hydrogen analysis efficiency diagram and physical photos
复合纳米纤维膜在强碱溶液中的稳定性和持久性是评估其是否是可重复利用光催化剂的重要因素。Ni2P-NiP2/TiO2/C纳米纤维膜强碱性溶液(KOH)中的稳定性照片如图8所示,可见在浸泡1周后的纳米纤维膜未有任何损坏。为了进一步验证纳米纤维膜在碱溶液中的稳定性,本文对使用10次的Ni2P-NiP2/TiO2/C纳米纤维膜进行了SEM测试。如图9所示,使用10次后的纳米纤维膜表面仍被纳米片包覆,并未出现腐蚀或脱落的情况。

图8 Ni2P-NiP2/TiO2/C纳米纤维膜在碱性溶液中稳定性照片Fig.8 Structural stability of Ni2P-NiP2/TiO2/C NFs in basic solutions

图9 纳米纤维膜使用前后扫描电镜对比Fig.9 SEM comparison of NFs before and after use
整个催化系统在还原反应期间产生氢气,同时通过聚合物(PET)的氧化产生有用的产品。1H HMR[17-18]光谱用于识别分解后的产物。图10(a)显示,在碱性条件下预处理后,PET部分水解为对苯二甲酸酯(TPA,b)和乙二醇(EG,c)。在光反应氧化后也发现了这些相同的物质,如图10(b)所示。由于芳香族组分对光催化降解具有挑战性,并且间苯二甲酸酯在原始聚合物中以TPA异构体的形式少量存在,因此它们可能不是氧化产物。相反,乙二醇具有更高的反应性,并且更容易吸收空穴并因此被氧化分解。因此,在图10(b)中,发现更多的乙二醛、乙醛酸盐、乙酸盐和甲酸盐是聚合物(PET)在光催化降解后的氧化产物。

图10 PET的1H HMR光谱Fig.10 The 1H HMR spectra of PET
3 结 论
通过静电纺丝和水热法等制备了柔性Ni2P-NiP2/TiO2/C纳米纤维薄膜。TiO2纳米颗粒嵌入碳纳米纤维中,Ni2P-NiP2包覆在TiO2/C纳米纤维膜表面。Ni2P-NiP2/TiO2/C纳米纤维膜表现出优异的吸光度。Ni2P-NiP2/TiO2/C纳米纤维膜将预处理的废PET悬浮液降解为有机小分子(如醋酸盐),同时产生H2。Ni2P-NiP2/TiO2/C纳米纤维膜表现出优良光催化活性,同时在强碱性环境中具有良好的稳定性。此外,复合纳米纤维膜光催化剂易于回收重复利用。这为不可回收废弃物的再利用提供了思路,同时拓宽了光催化制氢绿色途径。

《丝绸》官网下载

中国知网下载

