腹腔镜肝门部胆管癌根治性切除术的初步体会(附13例报告)
李 超,杨 培,曾新桃
(1.川北医学院,四川 南充,637000;2.电子科技大学医学院附属绵阳医院 绵阳市中心医院肝胆外科)
肝门部胆管癌(hilar cholangiocarcinoma,HCC)又称Klatskin瘤,是临床常见的胆道系统恶性肿瘤,占所有胆管癌的50%~70%[1]。HCC起病隐匿,多因梗阻性黄疸被发现。由于HCC特殊的生物学行为,目前外科根治性切除术仍是患者获得远期生存的主要方法[2-5]。HCC病变解剖部位特殊,易侵犯邻近血管,根治性手术切除范围包括肝门部及胰腺上肝外胆管、区域淋巴结、部分肝脏(包括尾状叶),必要时需要进行血管重建,被认为是肝胆外科领域最具有挑战性的手术之一。近年,随着腹腔镜技术的不断成熟,腹腔镜肝门部胆管癌根治术(laparoscopic radical hilar cholangiocarcinomectomy,LRHC)在一些大的医学中心逐步开展[6-8]。本研究回顾分析2017年12月至2021年4月绵阳市中心医院完成的13例腹腔镜肝门胆管癌根治术患者的临床资料,现将结果报道如下。
1 资料与方法
1.1 临床资料 采用回顾性描述性研究方法,收集2017年12月至2021年4月绵阳市中心医院采用腹腔镜手术治疗的13例HCC患者的临床资料,其中男8例,女5例,平均(67.6±5.8)岁,BMI平均(21.6±2.1)kg/m2。13例患者中Bismuth Ⅰ型2例、Ⅱ型2例、Ⅲa型2例、Ⅲb型5例、Ⅳ型2例。10例患者术前接受经皮经肝胆管穿刺置管引流。实验室检查:CA19-9(779.8±327.2)U/mL、癌胚抗原(3.12±1.19)ng/mL、谷草转氨酶(145.8±81.1)U/L、谷丙转氨酶(201.2±134.2)U/L、总胆红素(214.5±116.0)μmol/L、白蛋白(38.4±4.8)g/L,患者术前均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)术前未接受化疗等相关治疗;(2)剩余肝脏体积/标准肝体积>40%;(3)术后病理学诊断为肝门胆管癌;(4)临床资料及术后随访资料完整。排除标准:(1)发生远处转移无法行根治性切除或肝门血管受侵,难以在腹腔镜下完成;(2)合并严重心肺等疾病无法耐受手术;(3)术后病理学诊断为良性病变;(4)随访资料不完整。
1.3 术前准备 术前完善血常规、肝肾功、凝血功能等检查,评估患者一般情况;肝功能储备评估方法:Child-Pugh分级;合并胆管炎、需要大范围肝切除或胆红素>200 μmol/L的患者术前接受经皮经肝胆管穿刺置管引流;术前行上腹部增强CT、MRI或磁共振胰胆管成像(图1、图2),了解胆管腔内肿瘤轴向、径向侵犯深度,进行Bismuth分型,明确门静脉、肝动脉及其分支与肿瘤毗邻关系;CT三维重建(图3)测算剩余肝脏体积,评价血管变异或受侵情况[9]。
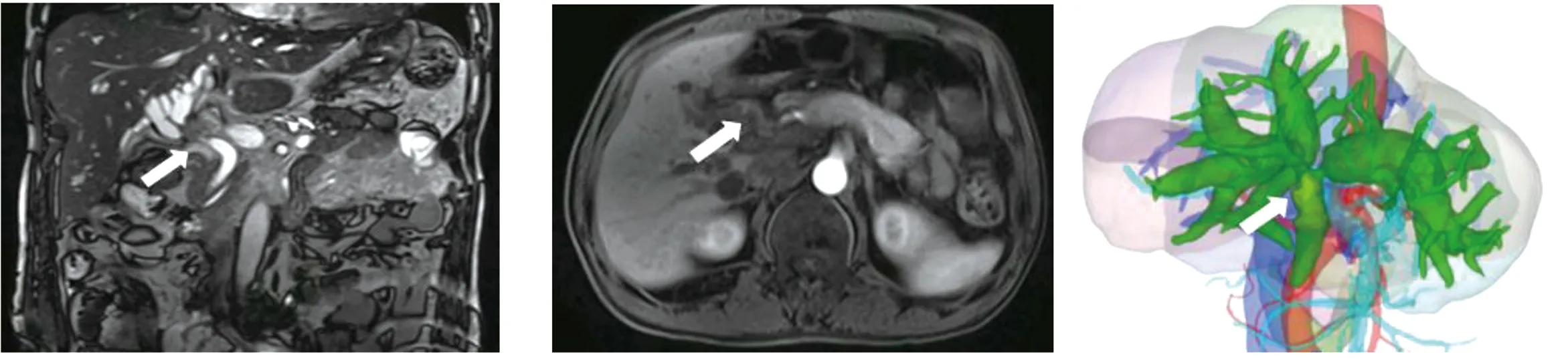
图1 MRI,箭头示肝门部胆管狭窄,累及左右肝管 图2 MRI,箭头示胆管壁增厚,管腔狭窄 图3 三维重建,箭头示胆管占位
1.4 手术方法 由具有授权的高级职称肝胆外科医师主刀。采用气管插管全身麻醉,患者取“大”字平卧位,五孔法施术。脐下缘切口建立气腹,压力维持在12~14 mmHg,其余操作孔围绕病变呈扇形分布。首先探查腹腔明确有无转移病灶。
1.4.1 肝十二指肠韧带及肝门区骨骼化 游离悬吊肝总动脉,向上分离显露肝固有动脉、胃十二指肠动脉及左右肝动脉。于胰腺段离断胆总管,胆管下切缘行术中快速冰冻病理检查确保切缘阴性后,胆管远端予以夹闭或缝闭。游离悬吊门静脉主干及分支。清扫7、8、9、12a、12b、12p组淋巴结。完成肝十二指肠区域的骨骼化清扫(图4)。

图4 围肝门切除术后术野 图5 箭头示右肝管断端2个开口,行胆肠吻合 图6 箭头示左肝管断端行胆肠吻合
1.4.2 肝切除 游离肝周韧带。根据术中探查情况进一步明确Bismuth分型,确定肝切除范围。胆管近端行冰冻检查,明确肿瘤浸润情况。
1.4.3 胆肠吻合及肠肠吻合 距Treitz韧带15 cm处离断空肠,将远端空肠经结肠后上提至保留侧胆管断端处,邻近胆管支适当整形后与空肠吻合。若胆管分支距离较远,则分别行胆肠吻合(图5、图6)。距胆肠吻合口约50 cm处行空肠侧侧吻合。
1.5 观察指标 (1)手术情况:手术方式、R0切除率、手术时间、术中出血量、术中输血情况;(2)术后情况:按照相关诊断标准[10-12]统计术后主要并发症发生情况、术后进食时间、术后住院时间;(3)术后病检:肿瘤分化程度、淋巴结转移情况;(4)患者出院后均通过门诊或电话等方式随访,了解局部复发、远处转移、生存率等情况。
2 结 果
2.1 手术情况 13例患者均顺利完成手术,无中转开腹,R0切除率100%,患者均行区域淋巴结清扫,行肝外胆管切除2例,围肝门切除2例,右半肝切除2例,左半肝切除5例,扩大左半肝切除1例,扩大右半肝切除1例;胆管断端数量1~6个,行胆管断端成形5例,胆肠吻合口数量1~3个;手术时间平均(560.3±210.2)min,出血量平均(400.0±260.9)mL,术中3例(23%)患者需要输血。肝门阻断时间0~120 min,中位肝门阻断时间55 min;肝切除时间20~250 min,中位肝切除时间110 min;胆肠吻合时间20~125 min,中位胆肠吻合时间80 min。
2.2 术后恢复情况 无非计划再手术及死亡病例,术后5例患者转入外科监护室治疗,B级肝功能衰竭1例,经保肝等治疗治愈;术后A、B级胆漏各1例,保持引流通畅,保守治疗治愈;术后肺部感染1例,经抗感染、促进排痰等治疗后治愈;术后24 h开始进食低脂流质饮食;术后24 h排除活动性出血后,开始下床活动;术后引流管拔除时间3~25 d,中位7 d;术后住院9~31 d,中位14 d。
2.3 术后病检 13例均为胆管腺癌,其中中-低分化腺癌7例、中分化腺癌5例、中-高分化腺癌1例;淋巴结检出数量6~13枚,其中2例存在区域淋巴结转移(均为Bismuth Ⅳ型),胆管周围神经侵犯3例。
2.4 随访结果 随访截至2022年2月1日,12例(92%)患者获得随访,随访4~46个月,中位18个月。随访时间大于1年的患者纳入生存分析。术后1、2、3年生存率分别为85.6%、50.0%、48.0%,中位生存时间为22.3个月。
3 讨 论
HCC起病隐匿,早期不易发现,多以梗阻性黄疸就诊,通过CT、MRI等影像学检查明确。由于肿瘤位于肝门,空间位置狭小,周边毗邻血管丰富而易受侵,加之HCC具有轴向、径向侵犯的生物学特性,手术难度高,肝门胆管癌根治术仍是肝胆外科领域最具有挑战性的手术之一[13]。
3.1 LRHC的开展基础 近年,随着腹腔镜外科器械的推陈出新及腹腔镜手术经验的积累,很多高难度的肝胆外科手术逐步实现了微创化。腹腔镜独特的视角优势、放大作用可使手术更加精准。笔者所在单位已常规开展腹腔镜下肝叶切除、腹腔镜下胰腺良恶性肿瘤切除等高难度手术,在此基础上,进行了LRHC的探索,13例手术均顺利完成,无中转开腹。我们体会,开展LRHC应具备以下基础:(1)有相对固定的手术与麻醉团队,对术中可能出现的各种意外情况都能应对自如;(2)具备丰富的腹腔镜肝切除术的经验,能完成LRHC术中大范围肝切除、尾状叶切除或围肝门切除;(3)有肿瘤淋巴清扫、动静脉血管骨骼化清扫的能力;(4)能高质量完成高位胆管整形及胆肠吻合。本研究中1例Bismuth Ⅱ型患者行围肝门切除,切除后肝断面上胆管开口6支,进行胆管整形后行胆肠吻合,术后出现B级胆漏,保持引流通畅痊愈。
3.2 术前评估 围手术期的精细管理是安全施行LRHC的前提。术前CT、MRI等影像学检查可大致判定HCC的分型。根据术中探查结果进一步明确最终分型。术前三维成像能使术者对肿瘤病灶有更直接、客观的认识,对血管侵犯做出判断,同时可测量肝脏各部分体积,评估大范围肝切除的耐受性[14-15]。本组病例术前均进行三维成像,对于有动静脉侵犯的患者,未纳入本研究。
3.3 LRHC的技术难点 LRHC手术范围包括肝门部及胰腺上方肝外胆管、区域淋巴结、部分肝脏(包括尾状叶)的整块切除,甚至需要联合受侵血管切除重建,手术难度极大。
3.3.1 第一肝门解剖与淋巴清扫 第一肝门位置深在且解剖结构复杂,变异较常见。因此,第一肝门区域的解剖及淋巴结清扫是手术的一大难点[16]。我们体会,术前认真阅片及借助三维成像结果可帮助手术医师更好地了解肝门局部解剖结构,做到术前心中有数。在第一肝门解剖时,重点是探查病变的部位与范围,术中行切除胆管断端冰冻检查,帮助确定手术切除范围与术式。部分患者经过术中探查后才能最终确定分型。术中淋巴清扫时常规进行肝动脉与门静脉骨骼化,完整切除区域淋巴结[17]。本组手术均达到R0切除,术后1年生存率达85.6%,表明在腹腔镜下达到与开腹手术相同的根治性切除是可行的。
3.3.2 肝切除 除部分Ⅰ型HCC外,LRHC术中常需进行包括尾状叶在内的大范围肝切除。腹腔镜下由尾侧到头侧的视线角度,使游离切除尾状叶时较开腹手术具有更佳视野。半肝切除提倡循肝中静脉的解剖性肝切除。因HCC患者往往以黄疸就诊,肝脏淤胆明显,行肝切除时渗血常较明显。术中低中心静脉压控制利于顺利完成肝切除。本组2例Ⅱ型患者行腹腔镜下围肝门联合尾状叶切除术,7例Ⅲ型患者行腹腔镜下左或右半肝联合尾状叶切除术,2例Ⅳ型患者行腹腔镜下扩大左半肝或扩大右半肝联合尾状叶切除术。
3.3.3 胆肠吻合 高质量的胆肠吻合是安全开展LRHC的另一大难点。大范围肝切除术后胆管残端一般为1~3支,胆肠吻合相对简单,围肝门切除术后胆管残端可达4~8支,对腹腔镜下消化道重建技术要求极高[18]。使用可吸收缝合线行黏膜对黏膜的胆肠吻合利于减少胆漏、腹腔感染等并发症。文献报道[19],LRHC与开腹手术的胆漏、腹腔感染发生率差异无统计学意义,表明对于度过腹腔镜学习曲线的外科医师,腹腔镜下胆肠吻合的质量与开腹手术无明显差异。胆肠吻合时显露是关键,无张力是基本要求。胆管开口较多时,邻近的胆管分支可进行拼接整形后吻合,距离较远的胆管分支只有单独吻合,可采取后壁连续、前壁间断的方式进行吻合。胆管分支较细时,可于胆管内放入支撑管后再进行吻合;特别困难的情况下,可采取肝肠吻合。
肝门血管侵犯是LRHC的相对禁忌。刘鑫宇等[20]报道了6例腹腔镜下联合门静脉切除重建的肝门胆管癌患者,近期疗效满意。但LRHC联合受侵血管切除、重建的安全性及可行性尚需进一步证实。目前认为LRHC联合血管切除重建难度极大,对于有明确血管侵犯的患者推荐中转开腹[18]。
综上,目前LRHC仍处于初步探索阶段,相关回顾性研究中腹腔镜手术的手术时间显著长于开腹手术[21]。本研究中手术时间平均(560.3±210.2)min,主要因高位胆肠吻合的时间较长。随着手术经验的累积,LRHC的手术时间有望逐步缩短。本研究结果显示,LRHC是极具挑战性的术式,在严格把握手术适应证的基础上,由经验丰富的腹腔镜外科医师施术是安全、有效的。但本组病例数较少,LRHC的安全性及可行性仍需前瞻性大样本临床研究进一步证实。

