基于前十字韧带切断联合部分半月板切除的大鼠创伤性骨关节炎模型的建立和试验评估
于 跃 , 马天文 , 赵明超 , 吕良钰 , 贾丽娜 ,宋霄鹏 , 徐新宇 , 白 荟 , 王鑫宇 , 高 利
(1. 东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030 ; 2.黑龙江省普通高等学校动物普通疾病防治重点实验室 , 黑龙江 哈尔滨 150030)
骨关节炎(Osteoarthritis,OA)是一种退行性关节疾病[1]。患病动物常伴发不同程度的疼痛反应,同时也造成巨大的经济损失。在动物临床上,犬、马和奶牛患OA较为常见[2],其微观特征是由于细胞外基质(Extracellular matrix,ECM)的合成代谢平衡紊乱,导致关节软骨被破坏,关节发生重塑[3],疼痛反应是OA的标志性症状。临床上使用的药物大多是对症治疗,如非甾体抗炎药(Non-steroidal antiinflammatory drugs,NSAIDs)缓解疼痛,但NSAIDs的副作用是不可估量的。OA的发病是多因素引起的,由关节不稳诱发的OA在动物发病中较为常见。
诱导型一氧化氮合酶(Inducible nitric oxide synthase,iNOS)是一种可溶性酶,以二聚体形式存在,iNOS催化产生过量的一氧化氮(Nitric oxide,NO)会对细胞产生毒性作用[4]。在OA中,NO介导炎症因子的表达,抑制胶原和聚蛋白多糖的合成,诱导软骨细胞凋亡和疼痛[5]。Ⅱ型胶原是维持关节软骨拉伸特性、保持结构稳定所必需的部分[6-7]。通过裂解II型胶原分子的三螺旋结构来启动纤维性胶原变性,初级切割发生在三螺旋内部,产生特异性片段。Ⅱ型胶原3/4片段裂解后羧基末端暴露出的新表位(C2C)[8]和1/4片段的羧基端端肽(CTX-Ⅱ)[9],都是Ⅱ型胶原裂解后产生的重要的OA标志物[10]。
为了探究在大鼠OA模型中,关节疼痛反应及iNOS、C2C和CTX-Ⅱ指标的变化情况,为OA的早期诊断和监控病情提供理论依据。本试验通过前十字韧带切断联合部分半月板切除手术(Anterior cruciate ligament cut combined with partial meniscus resection,ACLT+PMMx)进行大鼠OA造模,观察造模30 d内大鼠关节肿胀程度和疼痛行为学改变,Pelletier评分评估关节损伤程度,ELISA法检测大鼠血清中iNOS、C2C和CTX-Ⅱ的变化趋势。
1 材料与方法
1.1 主要试剂和仪器 异氟烷、丙酮,均购自北京友诚盛达生物科技有限公司;大鼠iNOS、C2C、CTX-Ⅱ ELISA试剂盒,均购自上海酶联生物科技有限公司。手术器械,购自上海医疗器械有限公司手术器械厂;手术缝线,购自上海浦东金环医疗用品股份有限公司;Epoch酶标仪,购自美国BioTek公司;超低温冰箱,购自青岛海尔特种电器有限公司。
1.2 实验动物 40只SD大鼠,雄性,11~12周龄,平均体重220 g,购自长春市亿斯实验动物技术有限责任公司,生产许可证号:SCXK(吉)-2018-0007。本试验所有动物福利和试验设计均获得东北农业大学动物伦理委员会批准。大鼠在温度20~24 ℃,湿度65%的环境下,进行7 d适应性饲养,期间随意采食,笼内自由活动。
1.3 OA模型的建立 大鼠随机分为对照组(n=20)和模型组(n=20),参照参考文献[11]方法进行造模。试验前大鼠禁食12 h,维持良好的机体状态。模型组大鼠建立异氟烷吸入麻醉通路,仰卧保定,剔除右下肢膝关节周围被毛,酒精、碘伏消毒,创巾隔离手术部位。大鼠右膝内侧副韧带前做2~4 cm的切口,打开关节囊,移位髌骨,暴露胫骨面和股骨髁,修整附近肌肉。切断前十字韧带,抽屉试验判断是否完全切断。再次髌骨移位后,以前十字韧带胫骨起点为圆点外旋45°切除内侧半月板的1/3。生理盐水冲洗关节腔,归位髌骨,可吸收缝线常规缝合,术后给予适量抗生素。对照组进行假手术,只打开关节腔但不切断半月板和任何韧带。
1.4 行为学检测 OA造模后第0、7、14、21天和第28天进行行为学检测,评价膝关节疼痛情况,持续5周。
1.4.1 膝关节肿胀检测 根据Nirmal等[12]的方法进行膝关节肿胀检测。固定大鼠后,伸直右膝关节,用电子数显游标卡尺测定模型组大鼠手术侧(右侧)和对侧(左侧)膝关节的直径,每次测量由同一人完成。计算膝关节直径差值进行统计,膝关节直径差值/mm = 手术侧膝关节直径-对侧膝关节直径。
1.4.2 伸膝发声检测 根据Im等[13]的方法进行伸膝发声检测,通过大鼠发声次数反映膝关节疼痛情况。从静止姿势、膝略微弯曲开始测试。首先保定大鼠,伸展膝关节,保证膝关节完全伸展,将膝盖夹在大拇指和食指之间,在内侧方向对膝关节挤压,上下左右伸膝。大鼠发声记“X”,不发声记“O”,每次间隔5 min,共计5次,记录发声次数。
1.4.3 冷敏感性检测 根据Katri等[14]的方法进行冷敏感性检测,将大鼠放置在铁丝网上静置15 min,待安静后开始测试。使用丙酮从铁丝网底部涂抹大鼠右后爪评估冷敏感性,观察丙酮作用20 s内的行为学变化,并进行评分。评分标准:0=无反应;1=快速撤回,甩动脚掌(总反应时间<1 s);2=长时间撤回或重复甩动(总反应时间1~3 s);3=重复拍打,舔爪腹侧(总反应时间3~10 s);4=长时间舔爪(总反应时间>10 s)。每爪进行3次测试,2次测试至少间隔10 min,记录3次评分,3次评分之和最高12分。
1.5 样品采集与处理 OA造模后第0、10、20天和第30天各组选取5只大鼠收集关节样本和血清。通过尾静脉采血法取血,置于无菌EP管中,室温下1 000 g离心20 min,收集血清,-80 ℃保存待用。之后将大鼠安乐死,解剖右膝关节并分离股骨和胫骨周围软组织,对股骨和胫骨面进行眼观观察和Pelletier评分,并对胫骨进行病理学观察。
1.6 形态学观察与Pelletier评分 使用Nikon单反相机对胫骨和股骨面进行拍照,并进行Pelletier评分[15]。Pelletier评分标准:0=关节表面正常;1=关节表面轻微损伤和变色;2=侵蚀至关节浅层或中层;3=侵蚀至深层;4=侵蚀至软骨下骨。
1.7 组织病理学检查 10%福尔马林缓冲液固定大鼠股骨、胫骨72 h,10%EDTA溶液脱钙3周,包埋并切成5 μm厚的切片。进行甲苯胺蓝染色,显微镜下拍摄胫骨甲苯胺蓝染色图像。
1.8 ELISA检测iNOS、C2C和CTX-Ⅱ水平 采用ELISA方法测定各组大鼠血清iNOS、C2C和CTX-Ⅱ水平,严格按照试剂盒说明书进行。使用ELISA Calc软件绘制iNOS、C2C和CTX-Ⅱ标准线性回归曲线,将OD值纳入方程,计算各样品的浓度。
1.9 统计学处理 使用GraphPad Prism 8软件进行统计分析,各组数据表示为平均数±标准差(Mean±SD),组间比较采用单因素方差分析(One-way ANOVA),P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 行为学检测
2.1.1 膝关节肿胀检测 如图1所示,与对照组相比,第7、14、21天和第28天模型组大鼠膝关节直径差均保持增加趋势,并呈极显著增加(P<0.01)。结果表明,OA模型中大鼠关节肿胀显著增加,并呈时间依赖性。
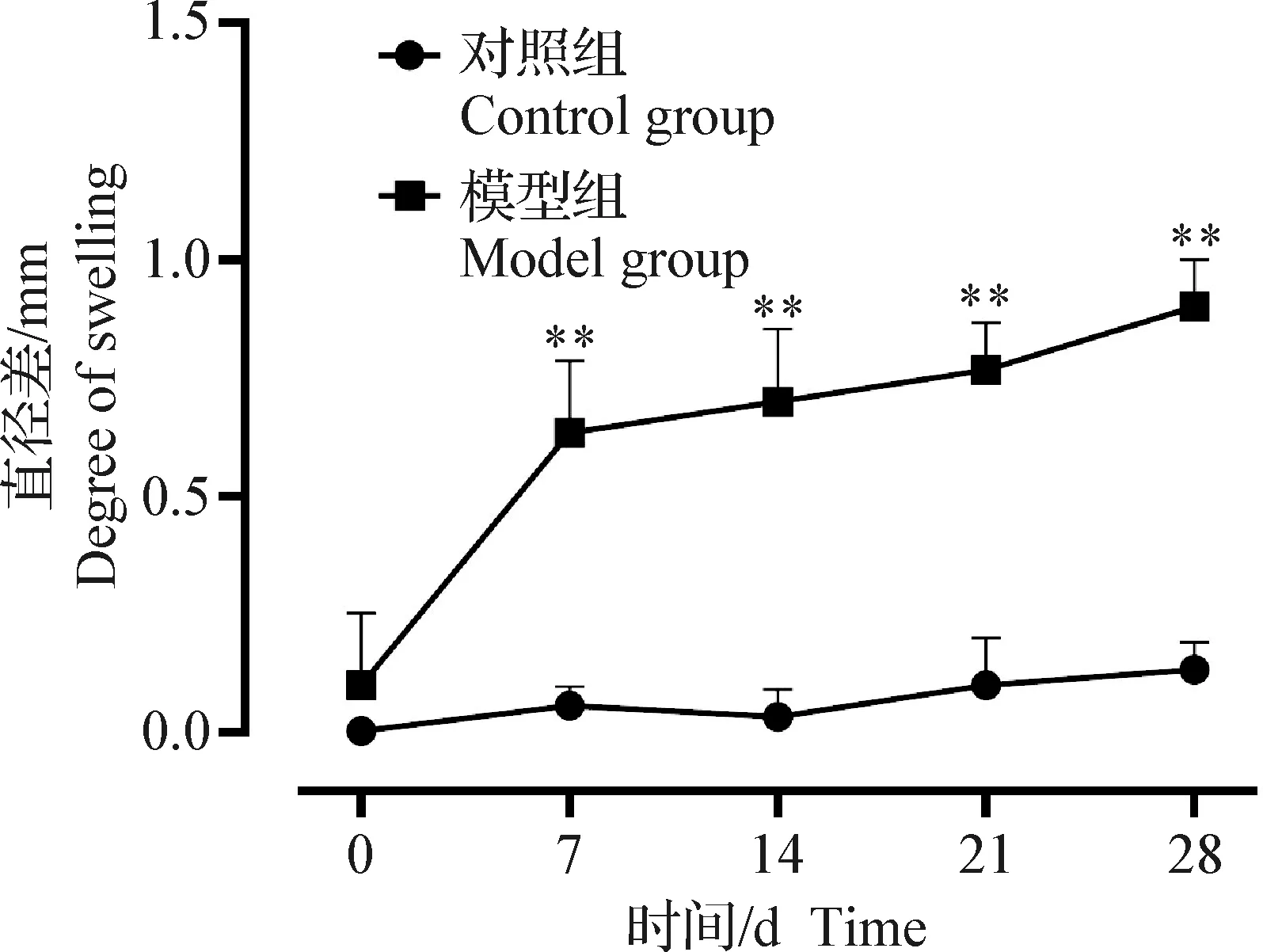
图1 膝关节肿胀程度变化Fig.1 Changes in the degree of swelling of knee joint与对照组比较,*:P<0.05,**:P<0.01;下同Compared with the control group,*:P<0.05,**:P<0.01.The same as below
2.1.2 伸膝发声检测 如图2所示,伸膝发声行为学检测显示,与对照组相比,OA造模后第7、14天和第21天发声次数极显著增加(P<0.01);造模后第28天发声次数与第21天相比呈下降趋势,但与对照组相比仍显著增加(P<0.05)。造模后发声次数总体呈升高趋势,说明大鼠疼痛反应敏感,OA伴发疼痛反应。
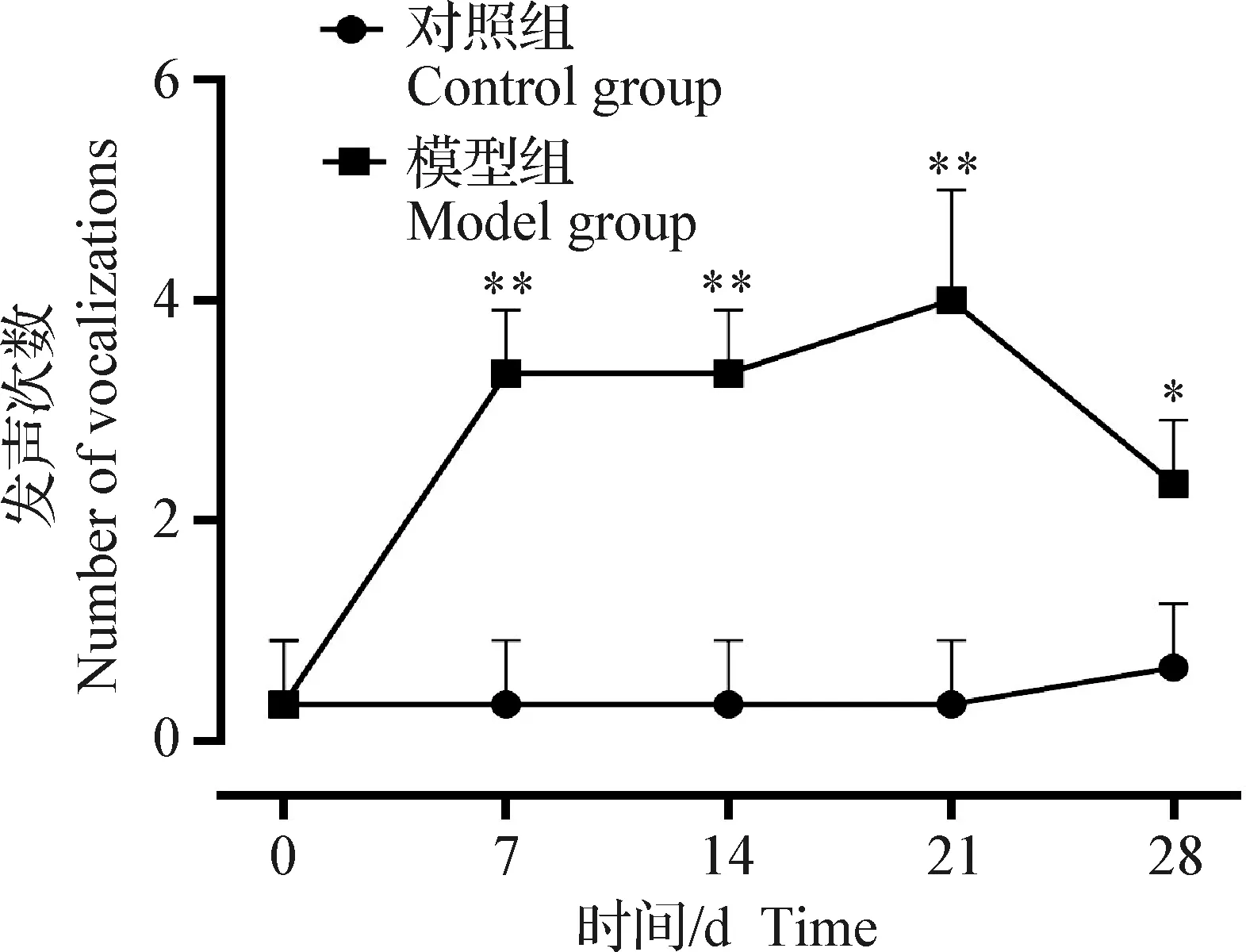
图2 伸膝发声次数变化Fig.2 Changes in the number of vocalizations at knee extension
2.1.3 冷敏感性检测 如图3所示,与对照组比较,大鼠OA模型第7、14、21天和第28天,冷敏感性评分极显著升高(P<0.01)。
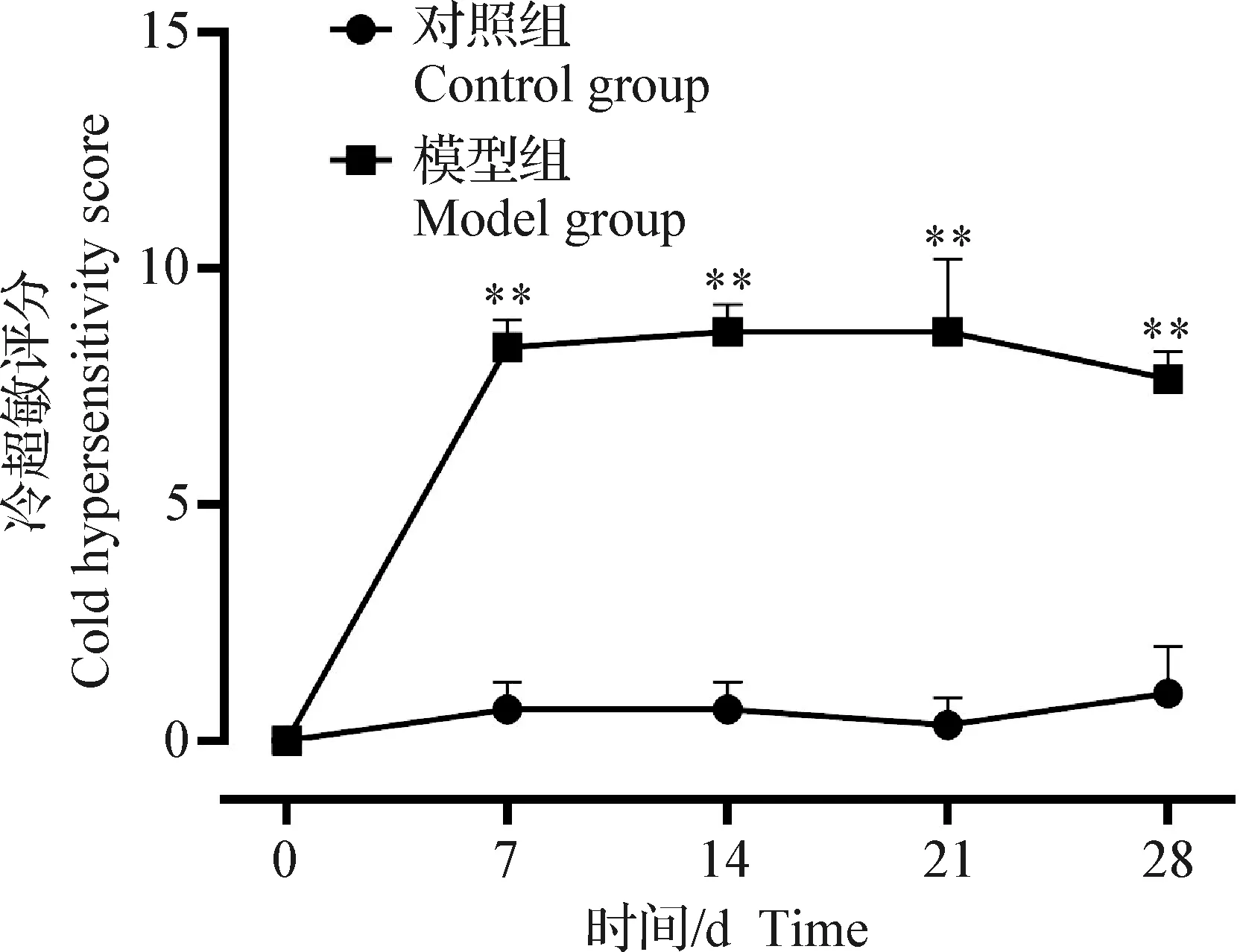
图3 冷敏感性测试评分变化Fig.3 Changes in cold sensitivity test scores
2.2 形态学观察及Pelletier评分 对大鼠膝关节胫骨和股骨面进行形态学观察,结果显示,对照组(第0天)胫骨和股骨软骨表面光滑,颜色正常(图4A和4E);造模后第10天股骨内侧溃疡程度逐渐增加(图4B黑框),胫骨表面轻微失去光泽,软骨层变薄(图4F箭头);造模后第20天股骨表面粗糙不平,溃疡程度增加(图4C黑框),胫骨表面严重磨损甚至部分暴露软骨下骨(图4G黑框);造模后第30天股骨表面呈深红色,凹陷(图4D黑框),胫骨软骨表面严重磨损甚至变形(图4H箭头)。如图5所示,与对照组相比,大鼠OA造模30 d 内Pelletier评分呈升高趋势,且第20天和第30天时均极显著升高(P<0.01)。
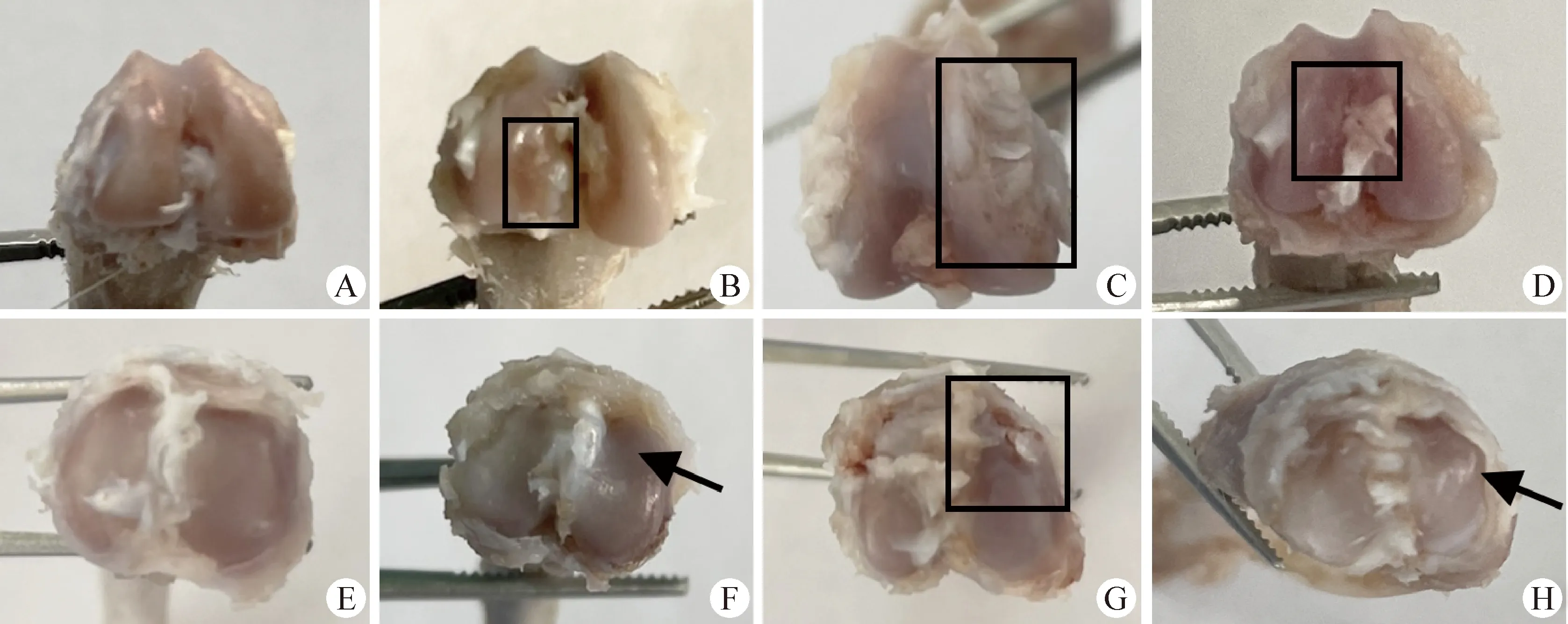
图4 大鼠股骨和胫骨面形态学观察Fig.4 Macroscopic observation of rat femur and tibial plateauA:对照组股骨; B:造模10 d模型组股骨;C:造模20 d模型组股骨; D:造模30 d模型组股骨; E:对照组胫骨; F:造模10 d模型组胫骨;G:造模20 d模型组胫骨; H:造模30 d模型组胫骨A:Femur of control group; B:Femur in model group after modeling for 10 d; C:Femur in model group after modeling for 20 d; D:Femur in model group after modeling for 30 d; E:Tibia of control group; F:Tibia in model group after modeling for 10 d; G:Tibia in model group after modeling for 20 d; H:Tibia in model group after modeling for 30 d
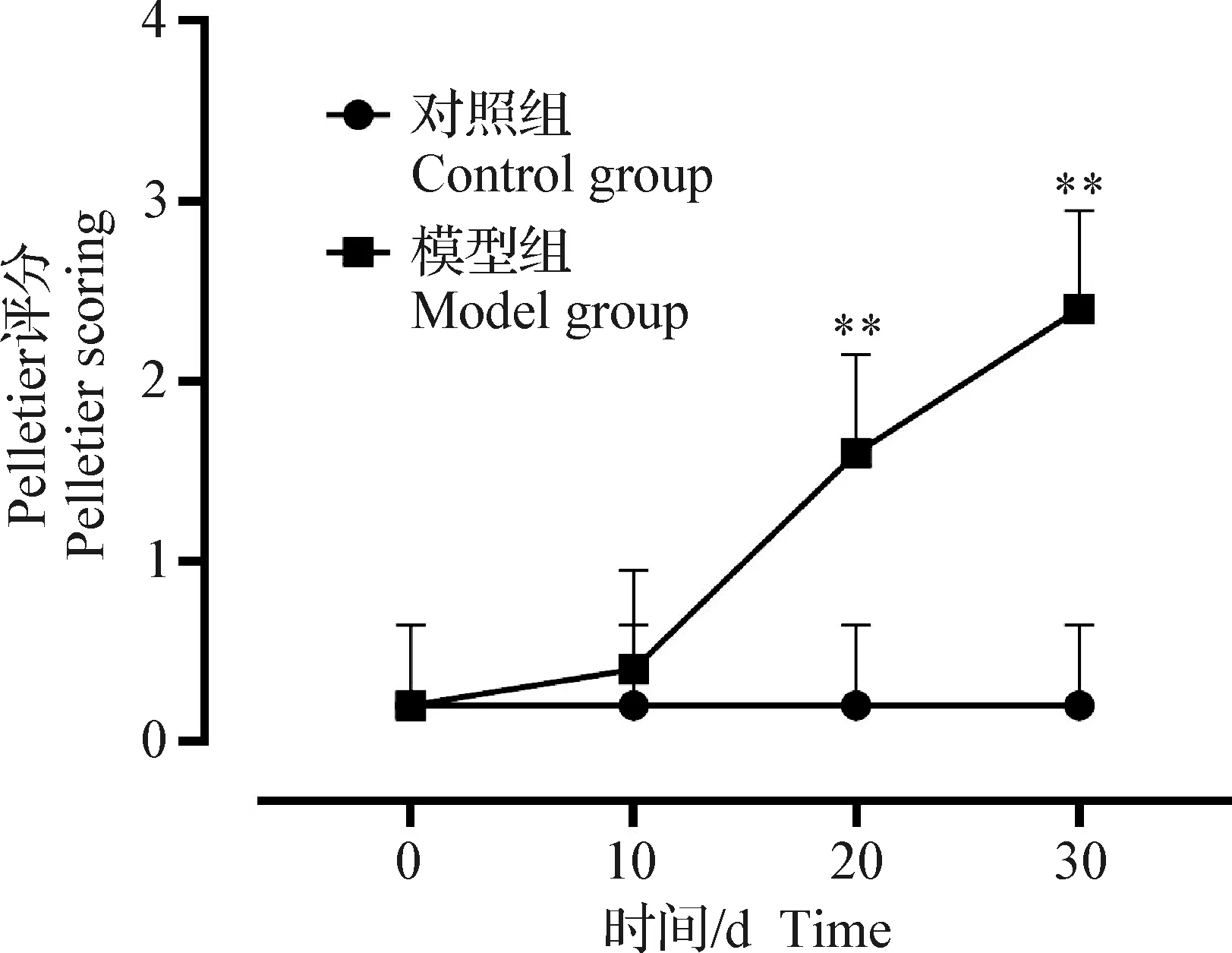
图5 Pelletier评分Fig.5 Pelletier scoring
2.3 组织病理学观察 结果显示,对照组(第0天)软骨表层光滑,染色均匀颜色较深(图6A和6E);造模后第10天股骨软骨浅层有裂缝(图6B),胫骨软骨细胞排列不均匀,聚集在软骨表层(图6F);造模后第20天软骨浅层破损、凹凸不平,裂缝至软骨下层,染色较浅(图6C和6G);造模后第30天软骨表层染色不均,颜色变浅,软骨细胞减少,潮线不完整,损伤严重(图6D和6H)。
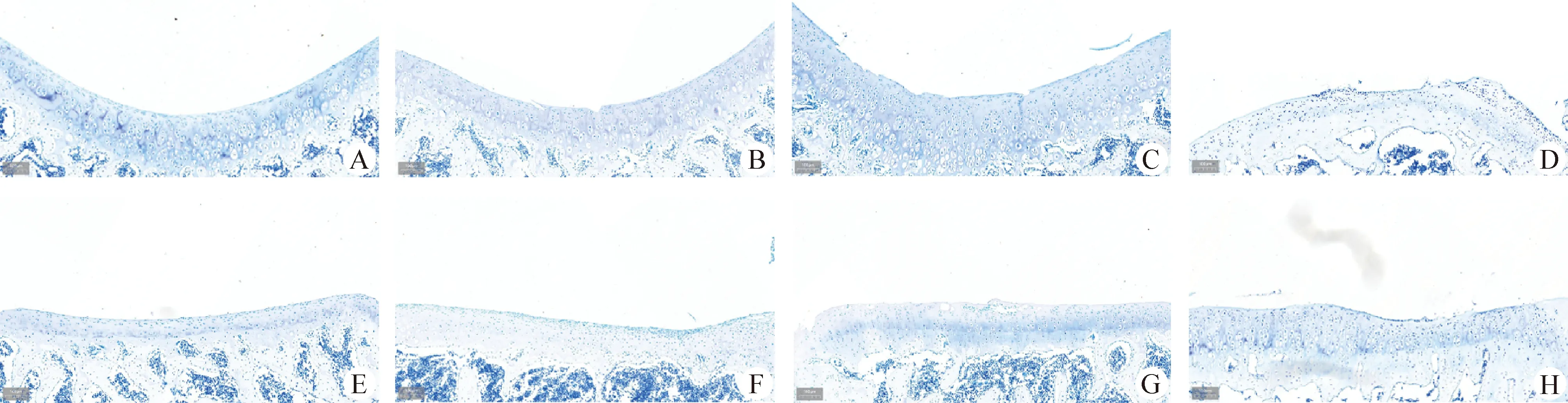
图6 软骨组织染色观察(甲苯胺蓝染色,100×)Fig.6 Observation of cartilage tissue by staining (Toluidine blue staining,100×)A:对照组股骨; B:造模10 d模型组股骨;C:造模20 d模型组股骨; D:造模30 d模型组股骨; E:对照组胫骨; F:造模10 d模型组胫骨;G:造模20 d模型组胫骨; H:造模30 d模型组胫骨A:Femur of control group; B:Femur in model group after modeling for 10 d; C:Femur in model group after modeling for 20 d; D:Femur in model group after modeling for 30 d; E:Tibia of control group; F:Tibia in model group after modeling for 10 d; G:Tibia in model group after modeling for 20 d; H:Tibia in model group after modeling for 30 d
2.4 血清中iNOS、C2C、CTX-Ⅱ浓度变化 与对照组相比,造模后第10天和第30天大鼠血清中iNOS浓度显著升高(P<0.05)(图7A);模型组血清中C2C、CTX-Ⅱ浓度在建立模型后30 d内呈升高趋势,且在第30天浓度显著升高(P<0.05)(图7B和7C)。对照组在30 d内血清iNOS、C2C、CTX-Ⅱ浓度无明显变化。
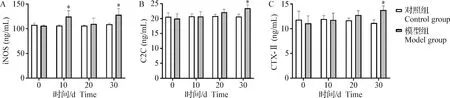
图7 大鼠血清中iNOS(A)、C2C(B)、CTX-Ⅱ(C)浓度Fig.7 Concentration of iNOS(A),C2C(B) and CTX-Ⅱ(C) in rat serum
3 讨论
传统上OA被认为是一种关节“磨损”疾病,随着研究的不断深入,OA现被认为是由炎症和代谢因子作用的复杂过程[16]。慢性超负荷和关节生物力学受损使关节软骨遭到破坏,关节内发生炎症反应。临床上OA多以关节疼痛为主要表现,伴发关节僵硬、肿胀和活动性丧失,从而导致动物跛行和残疾[17]。兽医临床针对OA的治疗,通常采用非甾体类药物[18],这些药物仅限于缓解疼痛,且副作用较大。
OA机制的研究需要相应病理模型的支持。近年来,ACLT+PMMx手术建立OA的方法广泛应用于OA的研究[19]。ACLT属于关节不稳定性模型,产生异常关节生物力学。这种类型的模型诱导软骨细胞产生生理变化,ECM被破坏,4周左右软骨细胞发生退变,8~12周软骨降解,并形成骨赘[20]。PMMx属于负荷异常分布模型,是最常用的半月板损伤模型。PMMx模型在4周出现第1次异常,8周和12周时OA明显进展[21]。Hamilton 等采用ACLT+PMMx造模方法研究OA不同时期的行为学变化[22]。Rudnik-Jansen 等采用ACLT+PMMx造模方法研究皮质类固醇作用的最佳条件[23]。不同模型类型决定了OA的等级和程度,本研究采用的ACLT+PMMx联合造模缩短了OA病程。由于关节稳定性降低,导致关节间磨损加速,短时间内产生疼痛反应。在造模前后每周进行疼痛行为学检测发现,OA模型在造模后第1周即伴随明显的疼痛反应,并一直持续到试验结束。选取第0、10、20天和第30天4个时间点收集血清和关节样品进行关节损伤评估以及iNOS、C2C和CTX-Ⅱ指标检测。结果发现,在造模30 d内胫骨和股骨软骨损伤逐渐加重,OA程度逐渐增加,尤其在第20天后损伤程度明显增加,提示创伤性OA模型建立成功。
研究表明,iNOS产生的NO与OA的发病机制密切相关,它通过调节ECM的稳态和细胞因子的表达,导致氧化损伤和软骨细胞凋亡,增强基质金属蛋白酶活性,下调聚集素和胶原的生物合成,导致软骨损伤[24]。许多iNOS抑制剂有望开发成为新的OA缓解制剂。本研究OA主要炎症介质iNOS在造模后第10天和第30天血清中浓度都显著升高,说明炎症参与了OA病变过程,与以往的研究结果相吻合[25]。软骨由软骨细胞和ECM组成,Ⅱ型胶原是ECM重要的组成成分[26]。Ⅱ型胶原是关节软骨抗张强度的核心组分,由于软骨内胶原的周转速度非常慢[27],因此主要由Ⅱ型胶原组成的纤维网损伤,是许多关节疾病中的不可逆病理改变。在OA中,关节软骨的破坏将导致ECM降解,Ⅱ型胶原被降解成C2C和CTX-Ⅱ等标志物。分析关节损伤和恢复期间Ⅱ型胶原转换的标志物有助于理解OA损伤的病变程度[28]。研究表明,血清中CTX-Ⅱ的水平能够在OA无症状期间被检测到[29]。在马OA模型9周内,C2C浓度随OA病程增加而升高[30]。在犬OA模型第3周后,C2C和CTX-Ⅱ浓度显著增加[31]。本试验在造模后30 d内,大鼠血清中C2C和CTX-Ⅱ的浓度呈升高趋势,说明随着OA病程的进展,Ⅱ型胶原被降解导致ECM退变,从而加速关节软骨损伤。
综上所述,本研究通过ACLT+PMMx手术建立大鼠OA模型,在建立模型30 d内关节疼痛反应剧烈,关节损伤增加,血清中炎症因子iNOS和Ⅱ型胶原降解产物C2C、CTX-Ⅱ分泌增加,为OA治疗和监测提供潜在的指标及理论依据。该模型可以有效模仿OA病理过程,为深入研究OA的发病机制、治疗靶点、药物评价等研究提供模型选择。

