基于p38MAPK/NF-κB信号通路探讨苏木提取物对ApoE-/-小鼠动脉粥样硬化的机制研究*
范增光,袁 野
(江西中医药大学附属医院 南昌 330006)
动脉粥样硬化(atherosclerosis,AS)是一种以动脉血管壁白细胞浸润为特征表现的慢性炎性疾病,以脂质沉积,血管硬化,弹性下降,内膜斑块形成及管腔狭窄为主要病理变化,是心脑血管疾病发生发展的重要原因[1-3]。近年来,AS发病率呈逐年上升状态,根据WHO最新统计的数据可以看出,全球每年大约有1790万人死于AS相关的心脑血管疾病,占全球总死亡率的31%,已经成为严重威胁人们健康的慢性疾病之一,因此,深入研究AS的发病机制,并以此为靶点延缓,甚至逆转AS进程,是降低心脑血管疾病的关键[4-5]。越来越多的研究表明,炎症反应在AS的各个阶段均起到关键的作用[6-7]。并且关于炎症因子及C反应蛋白的研究已取得初步成效,研究表明,直接靶向炎症因子治疗AS成为目前的研究热点[8]。丝裂原活化蛋白激酶(MAPK)信号通路广泛存在于细胞中,可调节多种生物过程,如细胞生长、趋化及增殖等,对多种心血管疾病进展均发挥着重要作用,而p38MAPK是MAPKs信号通路家族成员之一,与AS的形成具有密切的关系,p38MAPK在受到外界刺激后发生磷酸化而被激活,从而引发多种生物学反应,可促进VSMCs增殖信号传入细胞核,使其从中膜迁至内膜,并发生增殖,促使机体内发生炎症性瀑布反应,进而促进了AS的发生和发展[9-12]。核转录因子-κB(NF-κB)是p38MAPK的下游信号通路,NF-κB是炎症最重要的调节因子之一,其主要形式为p50和p65组成的二聚体,参与AS病理过程的各个阶段[13-15]。研究表明,当NFκB被激活后,NF-κB可以从IκBα释放,使得NF-κB由细胞质转移至细胞核,并在其中介导炎性因子及趋化因子如IL-6、TNF-α和ICAM-1的产生和分泌,进而诱发或促进AS的发生[16]。
本课题组前期研究证实了苏木是一种具有抗炎、免疫抑制、抗心脏移植排斥反应、保护血管、抗肿瘤、抗氧化等多方面的作用的药物[17]。近年来,关于苏木的实验及现代药理研究大多围绕在抗炎、免疫抑制等方面,其中苏木抗动脉粥样硬化的作用虽然已得到证实,但是具体的机制尚未完全阐述清楚,故深入研究其抗动脉粥样硬化的作用机制显得尤为重要。因此,本研究拟从p38MAPK/NF-κB信号通路入手,探讨苏木提取物是否通过该途径调节AS模型小鼠的炎症因子、粘附分子及血脂水平,为进一步探讨苏木提取物治疗AS的具体机制提供可靠的实验依据。
1 材料和方法
1.1 实验动物
8周龄雄性ApoE-/-小鼠40只和相同基因背景的8周龄雄性C57BL/6J小鼠10只,体质量约18-21 g,许可证号SCXK(京)2016-0006,均购于北京维通利华实验动物技术有限公司。饲养于清洁级动物实验室,调节温度(20-25)℃,湿度(55±15)%,风速(0.1-0.2)m·s-1,12 h循环照明。
1.2 实验药物
苏木提取物制备:取苏木生药,产地为云南,购于黑龙江省药材公司,由黑龙江中医药大学药学院提取和制备。具体方法:经生药鉴定制成40目苏木粗粉并浸泡浓度为75%乙醇溶液中4 h,经重复回流2次,去渣,加热至85℃,水浴蒸干制成干粉,将提取的干粉加入双蒸水中充分混匀得到混悬液,然后使用乙酸乙酯进行萃取,即得到苏木提取物。
1.3 实验试剂与仪器
苏木伊红染液(碧云天生物)、4%多聚甲醛(武汉塞维尔公司)、ELISA试剂盒(碧云天生物)、p38MAPK及NF-κB抗体(德国CST公司)。显微镜(广州明美光电技术有限公司)、4℃冰箱(青岛海尔股份有限公司)、-80℃超低温冰箱(中科美菱)、石蜡切片机(德国Leica公司)、石蜡包埋机(德国Leica公司)、液氮罐(中国四川乐山东亚公司)、离心机(常州峥嵘仪器有限公司)、移液枪(德国Eppendorf公司)、全自动生化分析仪(深圳雷杜生命科技)等。
1.4 动物分组
所有小鼠适应性饲养2周后,将10只C57BL/6J小鼠设为空白组(Control);40只ApoE-/-小鼠随机分为,模型组(Model)、苏木提取物低剂量组(Low-dose SEAE),苏木提取物中剂量组(Medium-dose SEAE),苏木提取物高剂量组(High-dose SEAE),每组10只。
1.5 模型制备
本实验采用高脂饮食喂养复制动脉粥样硬化模型:小鼠适应性喂养2周后,C57BL/6J小鼠继续给予普通饲料喂养;ApoE-/-小鼠给予高脂饲料(含15%可可脂、2.5%胆固醇)喂养8周建立动脉粥样硬化模型。
1.6 动物给药
配制成为5‰的羧甲基纤维素钠溶液(CMCNa)。根据课题组前期实验结果及人小鼠换算公式给药,小鼠的给药剂量=人的剂量(mg·kg-1)×人的体重(kg)×换算系数(0.0026)/所求动物的体重(kg)。于实验的第9周对各组小鼠进行灌胃,时间为4周。具体方法如下:①空白组:等体积的5‰ CMC-Na(0.1 mL/10 g)灌胃;②模型组:等体积的5‰ CMC-Na(0.1 mL/10 g)灌胃;③苏木提取物低剂量组:苏木混悬剂(0.1 mL/10 g)灌胃,相当于生药量0.83 g/(kg·d);④苏木提取物中剂量组:苏木混悬剂(0.1 mL/10 g)灌胃,相当于生药量1.66 g/(kg·d);⑤苏木提取物高剂量组:苏木混悬剂(0.1 mL/10 g)灌胃,相当于生药量3.32 g/(kg·d)。
1.7 标本取材与指标检测
于实验的第12周末,小鼠禁食12 h,不禁水,10%水合氯醛(0.1 mL/10 g)腹腔注射麻醉,摘取眼球取血,3000 r·min-1,离心10 min,分离血清;剥离主动脉,并将周围的组织剔除干净,取主动脉根部,用4%多聚甲醛溶液固定,用石蜡包埋标本,切片备用。
1.8 HE染色观察主动脉窦病理形态
取固定好的主动脉根部,制备石蜡标本、切片,苏木素溶液中染色5 min,清水冲洗1 min,1%盐酸乙醇溶液分化10 s,清水冲洗3 min,用0.5%伊红染色2 min,清水冲洗1 min,依次放入不同浓度的乙醇溶液中脱水,再放入二甲苯中透明,中性树胶封片,光镜下观察各组小鼠主动脉窦部病理形态改变,并拍照。
1.9 ELISA检测血清IL-1β、TNF-α、ICAM-1、VCAM-1水平
按ELISA试剂盒说明书的步骤,检测IL-1β、TNF-α、ICAM-1、VCAM-1的含量。
1.10 全自动生化仪测定TC、TG、LDL-C、HDL-C水平
应用全自动生化仪测定TC、TG、LDL-C、HDL-C水平。
1.11 Western Blot法检测p38MAPK、NF-κB蛋白表达
取小鼠主动脉组织匀浆,进行总蛋白的提取。根据BCA蛋白质浓度测定试剂盒说明书测定样品蛋白浓度。取40µg蛋白,在SDS/PAGE中以分离胶电压按120 V、浓缩胶电压按50 V进行恒压电泳。100 V恒压转膜,并根据靶蛋白的分子量大小调整。转膜结束后,取下支架,将转好的膜放入封闭液中,室温下封闭1 h;弃去封闭液,加入已稀释的一抗缓冲液中,4℃过夜;回收已稀释好的一抗,室温下TBST漂洗3次,每次5 min;加入稀释好的二抗,室温下培养30 min,室温下TBST在摇床漂洗4次,每次5 min。在NC膜的蛋白面侧滴加超敏ECL显色液,暗室中操作;将胶片依次显影、定影后,用Image J软件计算各条带的密度值,以目的条带密度值与内参(GAPDH)密度值的比值,作为其相对表达量。
1.12 统计学分析
应用SPSS23.0软件对实验数据进行统计分析,计量资料以均数±标准差(±s)表示,统计方法采用单因素方差分析(One-Way ANOVA),方差齐者行LSD检验,方差不齐者行Dunnett’s T3检验。以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义,P>0.05为差异无统计学意义。
2 结果
2.1 对病理形态的影响
空白组小鼠主动脉内膜各层结构及层次清晰,内膜光滑,血管内皮完整连续,未见明显的脂质沉积及斑块形成;中膜可见梭型排列整齐的血管平滑肌细胞;外膜为疏松的结缔组织;模型组小鼠主动脉内膜排列紊乱,内皮增厚;中膜可见排列不整齐的平滑肌细胞,局部可见炎症细胞浸润,并有脂质斑块形成,呈AS病理形态学改变;苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量小鼠主动脉窦AS病理形态学改变均较模型组有一定的改善,表现为小鼠主动脉窦部血管壁三层结果基本完整,内皮细胞表面排列不规整,可见少量脱落的内皮细胞(图1)。

图1 各组小鼠主动脉窦HE染色结果(×200)
2.2 对小鼠血清IL-1β、TNF-α、ICAM-1、VCAM-1的影响
2.2.1 对IL-1β、TNF-α的的影响
如表1所示:与空白组比较,模型组小鼠血清IL-1β、TNF-α水平升高,差异具有显著统计学意义(P<0.01);与模型组比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组IL-1β、TNF-α水平降低,差异具有统计学意义(P<0.05,P<0.01)(图2)。
表1 各组小鼠血清IL-1β、TNF-α水平比较(±s,pg·mL-1,n=10)
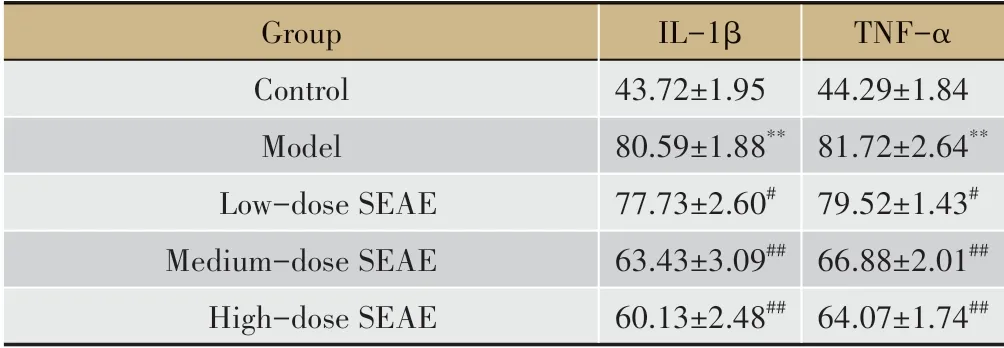
表1 各组小鼠血清IL-1β、TNF-α水平比较(±s,pg·mL-1,n=10)
注:**P<0.01 vs Control group;#P<0.05 vs Model group;##P<0.01 vs Model group。
Group Control Model Low-dose SEAE Medium-dose SEAE High-dose SEAE IL-1β 43.72±1.95 80.59±1.88**77.73±2.60#63.43±3.09##60.13±2.48##TNF-α 44.29±1.84 81.72±2.64**79.52±1.43#66.88±2.01##64.07±1.74##
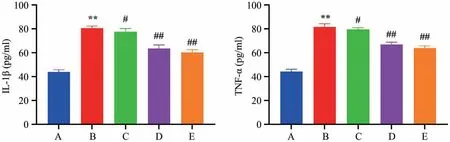
图2 各组小鼠血清IL-1β、TNF-α水平比较
2.2.2 对ICAM-1、VCAM-1的影响
如表2所示:与空白组比较,模型组小鼠血清ICAM-1、VCAM-1水平升高,差异具有显著统计学意义(P<0.01);与模型组比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组ICAM-1、VCAM-1水平降低,差异具有统计学意义(P<0.05、P<0.01)(图3)。
表2 各组小鼠血清ICAM-1、VCAM-1水平比较(±s,ng·mL-1,n=10)
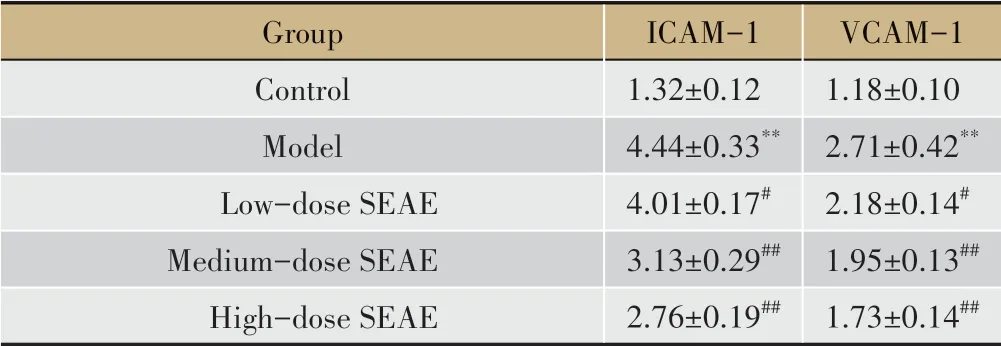
表2 各组小鼠血清ICAM-1、VCAM-1水平比较(±s,ng·mL-1,n=10)
注:**P<0.01 vs Control group;#P<0.05 vs Model group;##P<0.01 vs Model group。
Group Control Model Low-dose SEAE Medium-dose SEAE High-dose SEAE ICAM-1 1.32±0.12 4.44±0.33**4.01±0.17#3.13±0.29##2.76±0.19##VCAM-1 1.18±0.10 2.71±0.42**2.18±0.14#1.95±0.13##1.73±0.14##
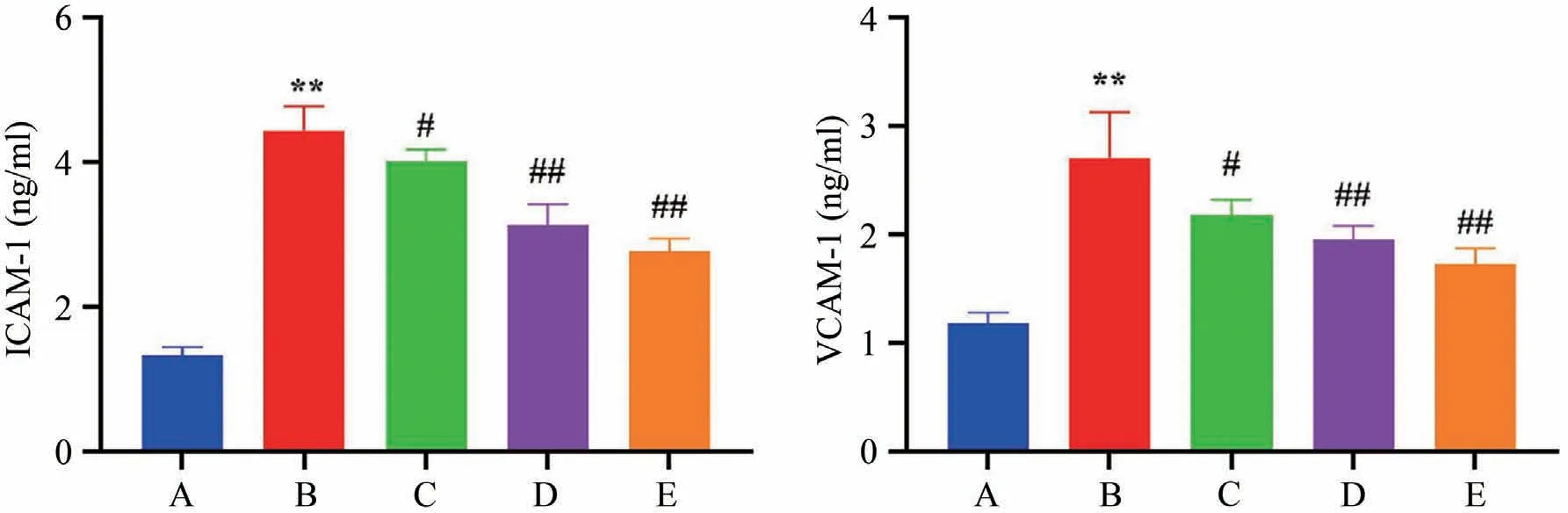
图3 各组小鼠血清ICAM-1、VCAM-1水平比较
2.3 对小鼠血清TC、TG、LDL-C、HDL-C的影响
如表3所示:与空白组比较,模型组小鼠血清TC、TG、LDL-C升高,差异具有显著统计学意义(P<0.01);与模型组比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组TC、TG、LDL-C降低,差异具有统计学意义(P<0.05,P<0.01)(图4)。
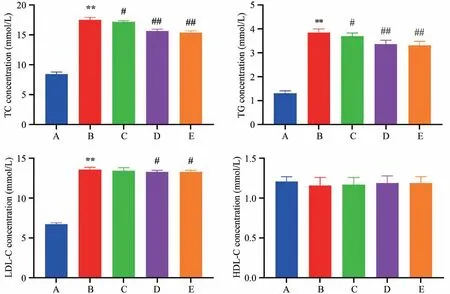
图4 各组小鼠血清TC、TG、LDL-C水平比较
表3 各组小鼠血清TC、TG、LDL-C水平比较(±s,mmol·L-1,n=10)
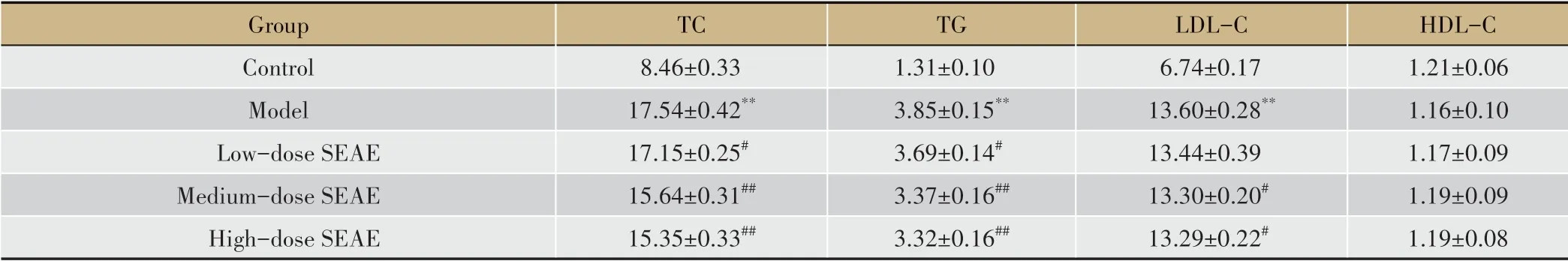
表3 各组小鼠血清TC、TG、LDL-C水平比较(±s,mmol·L-1,n=10)
注:**P<0.01 vs Control group;#P<0.05 vs Model group;##P<0.01 vs Model group。
Group Control Model Low-dose SEAE Medium-dose SEAE High-dose SEAE TC 8.46±0.33 17.54±0.42**17.15±0.25#15.64±0.31##15.35±0.33##TG 1.31±0.10 3.85±0.15**3.69±0.14#3.37±0.16##3.32±0.16##LDL-C 6.74±0.17 13.60±0.28**13.44±0.39 13.30±0.20#13.29±0.22#HDL-C 1.21±0.06 1.16±0.10 1.17±0.09 1.19±0.09 1.19±0.08
2.4 对小鼠主动脉p38MAPK、NF-κB蛋白表达的影响
如表4所示:与空白组比较,模型组p38MAPK、NF-κB蛋白表达水平升高,差异具有显著统计学意义(P<0.01);与模型比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组p38MAPK、NF-κB蛋白表达水平降低,差异具有显著统计学意义(P<0.05,P<0.01)(图5)。
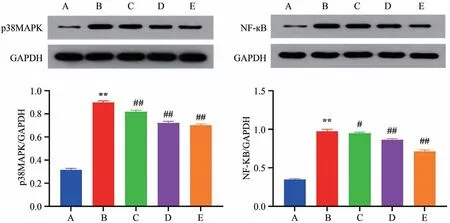
图5 各组小小鼠主动脉p38MAPK、NF-κB蛋白表达比较
表4 各组小鼠主动脉p38MAPK、NF-κB蛋白表达比较(±s,n=10)
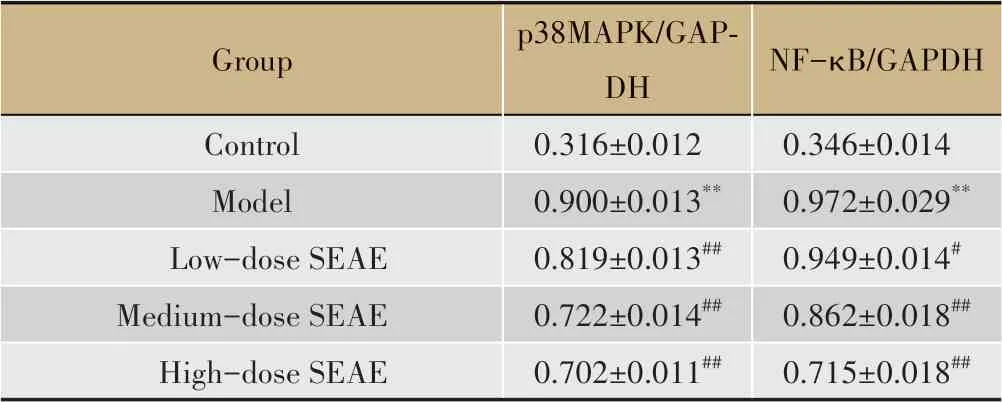
表4 各组小鼠主动脉p38MAPK、NF-κB蛋白表达比较(±s,n=10)
注:**P<0.01 vs Control group;#P<0.05 vs Model group;##P<0.01 vs Model group。
Group Control Model Low-dose SEAE Medium-dose SEAE High-dose SEAE p38MAPK/GAPDH 0.316±0.012 0.900±0.013**0.819±0.013##0.722±0.014##0.702±0.011##NF-κB/GAPDH 0.346±0.014 0.972±0.029**0.949±0.014#0.862±0.018##0.715±0.018##
3 讨论
建立动物模型目的是用于疾病的防治,为了更好地服务临床,进而为人类健康保驾护航。而AS模型的合理建立有利于深入研究其发病机制,可以丰富我们对这一类疾病的认识,以便发掘更好的治疗方案。常用的动物模型主要包括大鼠、家兔、灵长类动物、猪及基因敲除小鼠等,但由于动物模型是模拟原型,所以优化动物模型对于进一步深入探讨AS的发生发展具有重要的作用。目前,鼠类依然AS动物模型研究最多的动物,尤其基因敲除小鼠,具有AS模型成模周期短,模型稳定等诸多优点。载脂蛋白E(ApoE)是极低密度脂蛋白(VLDL)、乳糜微粒(CM)等重要的组成成分,缺乏ApoE会引起胆固醇在血管壁不断堆积,进而使得血管壁增厚硬化,弹性减少,甚至引起管腔狭窄,极易促使AS的发生,目前,ApoE-/-基因敲除小鼠作为最为经典AS动物模型之一,不仅因其可自发形成动脉粥样硬化病变,更为重要的是ApoE-/-小鼠病理改变与人类II型高脂血症极为相似,并且AS斑块主要好发于主动脉弓、主动脉瓣、胸主动脉等主动脉及其分支,晚期AS斑块易出现钙化等情况,非常符合临床AS患者病变特征,故被广泛运用于冠心病、高脂血症等疾病的研究。
中医学多将AS归属于“胸痹”的范畴,认为动脉斑块的形成,主要在于血液运行不畅、痹阻不通,如《素问》中记载“痹在于脉则血凝而不流”,较为清晰的阐述了血液滞涩不通为脉痹总的病因病机。并认为动脉粥样硬化是冠心病的病变基础,所以及时正确的防治对于预防、甚至延缓冠心病的发生具有重要的意义,而中医药对于预防和治疗动脉粥样硬化具有显著的作用,且安全性较高。苏木为豆科云实属植物苏木的干燥心材,又名赤木、苏杨、苏枋,首载于唐代苏敬等人所著的《新修本草》[18-19]。具有舒经活络、活血散瘀、消肿止痛等功效,临床上主要用于治疗心腹疼痛、瘀滞肿痛、跌打损伤、痈肿疮毒、血滞经闭、痛经及产后瘀阻腹痛等病症[20]。关于苏木的药物成分国内外学者进行了更为深入的研究,但由于苏木的化学成分较为复杂,目前仅仅从苏木的心材中分离鉴定出大约120个化合物,而其中,又尤以巴西苏木素含量最高,是苏木化学成分的主要类型,也是目前苏木药材的质控的主要成分[21]。现代药理学研究表明苏木具有免疫抑制、抗炎、抗心脏移植排斥反应、保护血管、抑制淋巴细胞、抗氧化、抗肿瘤等多方面作用[22]。本研究结果显示苏木能够降低小鼠血清中IL-1β、TNF-α、ICAM-1、VCAM-1及TC、TG、LDL-C水平。综合上述文献及本研究结果再次证实了苏木具有抗炎、降低血脂等方面的作用,进一步为苏木防治AS提供可靠的理论依据。
AS是一类慢性炎症性疾病,最早由Ross提出[23],并认为在AS发病的全过程各种炎症细胞和炎症介质均参与其中。但是,现阶段人们对于这种慢性低度的炎症具体的发病机制缺乏认识,同样对于治疗也缺乏有效的治疗方案,因此,深入研究炎症相关机制将对于AS的防治具有重要的意义。研究表明,MAPKs在哺乳动物细胞内广泛存在,被认为是炎症反应中一种重要的激酶,在调控炎症反应周期、调节细胞生长及分化等生理过程中起到关键的作用,其中,p38MAPK是其家族中最重要的成员之一,其活化后可以促使白细胞不断地发生聚集,进而引起或放大炎症反应,而一旦阻断p38MAPK的活化便可以缓解炎症反应[24-25]。NF-κB是真核细胞内一种重要的转录因子,研究表明,NF-κB的表达与MAPK信号通路密切相关,为p38MAPK的下游通路,活化的p38MAPK能够引起NF-κBp65磷酸化,而一旦NF-κB活化后便可以多种炎症因子、黏附分子的释放,如IL-6、IL-1β、TNF-α、细胞间黏附分子(ICAM-1)及血管细胞黏附因子(VCAM-1)等,进而引起多种免疫炎症反应[26-28]。IL-1β在AS发生发展中具有重要作用,研究表明,当Apo E-/-小鼠敲除IL-1β后可以延缓AS的进展,同样,与正常人比较,冠心病患者体中IL-1β水平明显升高[29]。TNF-α亦参与了AS的形成,研究表明,TNF-α可通过介导内皮细胞损伤、促进凝血、抑制纤溶等途径促进平滑肌细胞增殖、迁移从而引起AS的发生[30]。ICAM-1属于免疫球蛋白家族,通常情况下其很少表达,而在炎症因子的刺激下ICAM-1表达会明显升高,进而促进内皮细胞和单核细胞两者的黏附,促进炎症反应,诱发AS的发生发展,研究表明,ICAM-1、VCAM-1与AS早期斑块的进展密切相关,同时和AS的严重程度成正比[31]。同样,脂质代谢紊乱作为AS独立的危险因素,是AS的病理基础,已被证实TC、TG、LDL等水平的升高与AS呈正相关,而HDL水平与AS发病呈负相关[32-33]。
本研究在体内实验中,结果显示:与空白组比较,模型组小鼠血清中IL-1β、TNF-α、ICAM-1、VCAM-1及TC、TG、LDL-C水 平 升 高,同 样,主 动 脉 中p38MAPK、NF-κB蛋白表达亦升高;与模型组比较,苏木提取物低、中、高组小鼠血清中IL-1β、TNF-α、ICAM-1、VCAM-1及TC、TG、LDL-C水平降低,主动脉中p38MAPK、NF-κB蛋白表达降低。初步说明了苏木提取物能够抑制炎症因子、黏附分子及血脂的表达水平,同时下调p38MAPK/NF-κB信号通路的表达。即苏木提取物能够通过抗炎、降血脂等途径发挥抗AS的作用,部分机制可能与抑制p38MAPK/NF-κB信号通路活化有关。

