骨质疏松性椎体压缩骨折经椎体成形术治疗后责任椎体及邻近椎体再骨折情况研究
刘成洲 贾宝欣 尹爱斌 刘爱国 任聪慧 王 亭(通讯作者)
( 1 临朐县人民医院脊柱骨科 , 山东 临朐 262600 ; 2 青岛大学附属医院脊柱外科 )
骨质疏松是一种常见病、多发病,以骨量减少、骨密度降低、脆性增加、易发骨折为特点。骨质疏松患者易发脆性骨折,发生在脊柱部位的骨折称为骨质疏松性椎体压缩性骨折(osteoporosis vertebral compression fracture,OVCFs)。OVCFs在骨质疏松骨折中约占39%,是导致老年患者腰背痛的主要原因之一[1]。经皮椎体成形术(percutsneous verteroplasty,PVP)属于一种脊柱微创手术,它通过注入骨水泥强化骨折椎体的方式,在治疗OVCFs方面优势显著,已成为治疗此类骨折的首选方法[2]。OVCFs经椎体成形术治疗后疼痛缓解明显,术后早期即可下床功能锻炼,能明显改善患者的自理能力和自我效能。目前对于PVP术后早期疗效报道较多,但对于中长期随访及并发症发生情况相关文献较少。对于PVP术后责任椎体及邻近椎体再骨折的风险因素及再骨折发生时间的相关研究较少。为此,本研究通过对PVP术后患者进行1年的持续追踪,观察OVCFs经PVP治疗后责任椎体及邻近椎体再骨折情况,并就可能导致上述情况发生的因素进行初步探讨。报告如下。
临床资料
1 一般资料:回顾性选取2017年1月-2020年11月因OVCFs在我院行PVP治疗的158例患者作为研究对象,所有患者均符合骨质疏松性椎体压缩性骨折的诊断,均行椎体成形术治疗,均为单椎体骨折。排除凝血异常者、合并其他疾病者、行PKP治疗者及肿瘤患者。所有158例患者年龄在60-85岁,平均年龄为(71.25±8.82)岁,男性63例,女性95。本研究经患者及家属同意并签署知情同意书,由我院伦理委员会批准通过并备案。
2 方法:患者完善相关检查后,俯卧于手术台上,调整手术床的位置,使伤椎与地面保持垂直,术前先行椎体定位、标记椎弓根投影,然后消毒、铺巾。2%利多卡因于标记点行局部浸润麻醉,然后以定位针定位椎弓根位置,穿刺点在左侧椎弓根投影10点方向,右侧椎弓根投影2点方向。然后于两侧穿刺定位点分别作0.5cm切口,插入穿刺针,在透视下将穿刺针通过椎弓根穿入椎体内壁约0.5cm,透视正侧位穿刺针位置良好后,通过细导针更换并植入工作套管,建立工作通道,应用骨钻钻出推注通道,同时取少量骨组织送病理检查。然后调配骨水泥,将调好的骨水泥注入推注管内,于骨水泥拔丝期进行骨水泥推注。推注完成后,拔出工作套管,结束手术。术后禁食2小时,第2天带腰围下床活动,第3天出院,出院后3个月内佩戴腰围下床活动。
3 观察指标:记录患者年龄、性别等一般资料,对患者手术时间、骨水泥用量、骨水泥渗漏等情况进行统计,然后对患者进行1年的追踪随访,观察PVP术后责任椎体及邻近椎体再骨折情况,并就可能发生的原因进行相关分析。
4 统计学方法:采用SPSS22.0对本研究数据进行相关分析,计量资料采用表示,计数资料采用卡方(x2)检验,再骨折风险因素研究,先将相关因素进行单因素分析,再将存在差异的结果进行logistics多因素回归分析进行。以P<0.05为差异有统计学意义。
5 结果
5.1 158例患者手术情况:158例患者均顺利完成手术,手术时间35-75分钟,平均用时为(51.46±8.58)分钟;骨水泥用量2.5-6.5ml,平均推注量为(3.77±1.49)ml;骨水泥泄露6例,主要以椎旁、椎前渗漏为主,患者均无明显临床症状,无椎管内渗漏等严重并发症出现。
5.2 责任椎体及邻近椎体再骨折情况:在为期1年的追踪随访中,发生责任椎体及邻近椎体再骨折17例。其中责任椎体再骨折3例(1.90%),邻近椎体骨折14例(8.86%)。PVP术后1-3个月发生再骨折9例,4-6个月4例,7-9个月2例,10-12个月2例。通过比较发现1-3个月发生再骨折概率明显高于其他时间段(P<0.05)。见图1。
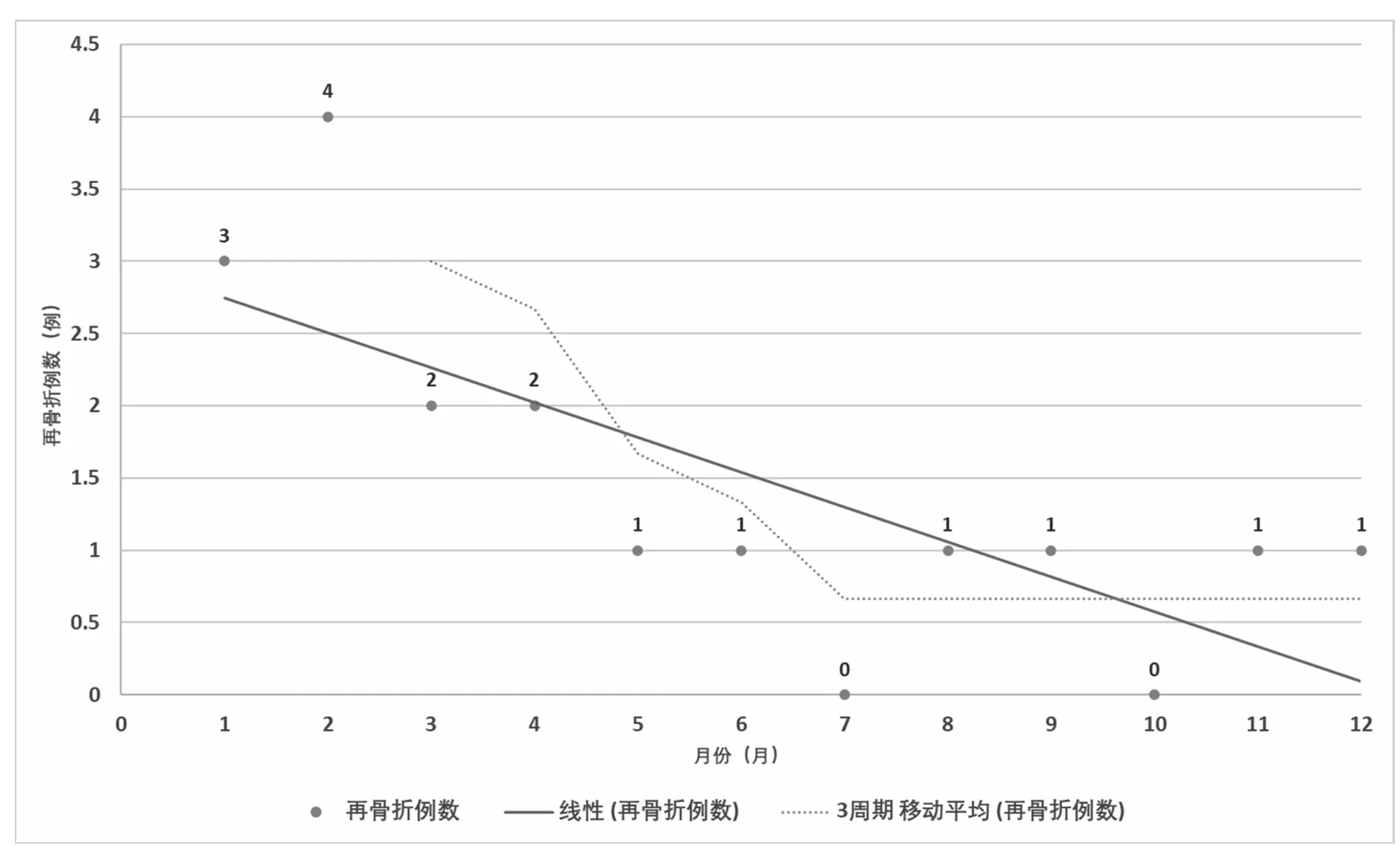
图1 不同月份椎体再骨折发生情况(例)
5.3 PVP术后再骨折风险因素的logistics回归分析:通过2次分组,将再骨折患者与未再骨折患者进行单因素比较,然后将存在差异的结果进行赋值后进一步行多因素logistic回归分析,结果显示:年龄、既往骨折史、骨水泥渗漏、骨质疏松是PVP术后再骨折风险因素(P<0.05)。见表1。
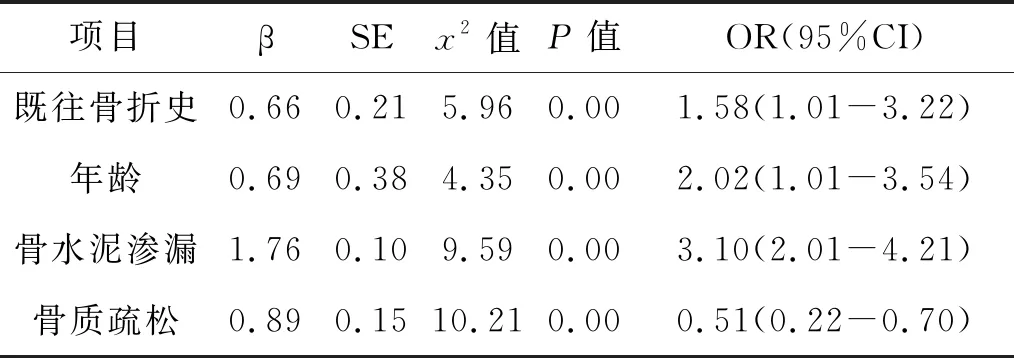
表1 PVP术后再骨折风险因素的logistics回归分析
讨 论
随着我国老龄化的进展,我国骨质疏松患者越来越多,一项多中心、大样本调查显示[3],我国50岁以上人群中,男性骨质疏松患病率为6.5%,女性患者则达到了29.1%。虽然患病率较高,但由于该病比较隐匿,临床症状多不明显,且临床医生重视程度不足,因此存在低就诊率、高漏诊率的现象。多数患者出现骨折等并发症后,才进行正规抗骨质疏松治疗。骨质疏松性椎体骨折不同于普通外伤性骨折,此类骨折暴力往往较小,有的患者在轻微外力或者没有明显外力时也可出现骨折。Kutsal研究表明[4],在70岁以上以腰背痛为主要症状的就诊患者中,有约63.5%经磁共振检测确诊为椎体压缩性骨折。以往对于OVCFs多以卧床休息、佩戴支具等保守治疗为主,但保守治疗的后果是骨质疏松进一步加重,Haffner研究发现[5],老年患者卧床1周所丢失的钙量相当于平常1年总的钙丢失量。因此,目前对于OVCFs多主张采取手术治疗。开放手术由于创伤较大,老年患者对全麻耐受性差,以及钉棒把持力不足等,限制了此类手术的开展。
近年来,随着医疗技术的不断发展,椎体成形术在骨质疏松骨折中的应用日趋成熟,特别是3D打印技术、导航技术、骨填充网袋、侧方开口骨水泥推杆、弯角针穿刺技术、新型骨水泥等的临床应用,使得椎体成形手术更加精准,术中骨水泥渗漏风险明显降低,然而,并非所有患者均能取得良好效果。部分患者在术后一段时间再次出现了腰痛等症状,进一步的检查显示有的患者出现了责任椎体再骨折,也有部分患者出现了邻近椎体骨折。因此,如何减少此类并发症的出现,是当今的亟待解决一项热点话题。对于椎体成形术后责任椎及邻近椎体再骨折的发生机制,目前尚有争议。Pouvelle进行的一项Meta分析发现[6],椎体成形术后再骨折的发生率不同文献差距较大,为6.69%-43.75%。Tamkeen的一项PVP术后3年随访研究发现[7],120个骨折椎体在进行PVP术后3年中有38个椎体出现的再骨折,骨折发生率为31.67% 。大量研究发现,骨水泥分布情况、骨质疏松程度、椎体Cobb角、骨水泥渗漏、多椎体骨折、既往骨折史等与椎体成形术后再骨折关系密切[8-13]。Garnon研究发现[14],骨水泥分布不良可导致椎体应力轴线发生倾斜,导致术后再骨折的发生。Andrew对单侧推注与双侧推注骨水泥进行比较发现[15],双侧骨水泥推注效果优于单侧推注,且术后并发症少(P<0.05)。骨水泥分布情况受多种因素影响,例如骨水泥浓度、推注时间、工作套管的方向、推注速度、骨质疏松程度等。骨水泥越稀薄越容易弥散,但也增加骨水泥渗漏风险。推注时间越早骨水泥在椎体内弥散越充分,但过早推注可增加骨水泥渗漏风险,目前多数学者主张在骨水泥“拉丝期”进行推注。骨水泥推注过晚,可因为骨水泥的硬化导致推注困难。工作套管方向在一定程度上也影响着骨水泥的分布状态,偏上或者偏下都可导致骨水泥在椎体局部聚集,而影响骨水泥在椎体内的均匀密布。推注速度过快或者过慢,均可在一定程度上影响骨水泥的分布状态。骨质疏松程度可明显影响骨水泥分布状态,骨质越疏松,椎体内“孔洞”越大,越容易使骨水泥弥散。除此之外,有研究发现放在冰箱内的低温骨水泥,在取出来调配后,拥有更长的推注时间窗。也有学者发现,部分患者椎体内存在“致密带”,能够阻挡骨水泥的弥散,进而影响骨水泥的分布。椎体Cobb角的大小可影响椎体的生理曲线,Cobb角纠正不良,可使术后生物力线发生改变,加速邻近椎体退变与骨折[16]。一项骨质疏松椎体力学模型研究发现[17],Cobb角增大可使身体的重心发生前移,骨折椎体前缘应力明显增加,其中Cobb角每增加5°椎体前部应力增加1.3倍。骨质疏松、多椎体骨折及既往骨折史均在一定程度上使得椎体弹性模量及硬度发生改变,骨质变脆,更易出现再骨折现象[18-24]。
在椎体成形术后再骨折发生时间上,Fahim研究发现[25],术后6个月是再骨折的高发期。Dohm研究发现[26],椎体成形术后伤椎及邻近椎体再骨折的时间主要集中在术后3个月内,可能与椎体后壁部分骨水泥较少,椎体骨折尚未完全愈合而过早负重等因素有关。Girardo研究发现[27],PVP术后3个月内未进行任何防护者发生椎体再骨折的风险是佩戴腰围者的3.75倍。本研究发现,术后6个月再骨折发生率为8.23%,是7-12个月再骨折发生率的3.25倍。同时,在6个月内,前3个月发生再骨折9例,4-6个月为4例,前3个月发生再骨折风险是后3个月的2.25倍。因此,对于OVCFs患者而言,在椎体成形术治疗后的半年内,特别是前3个月,进行腰围、支具等必要的防护措施,具有重要意义。本研究样本量相对较低,对相关因子进行了初步探讨,但未进一步深入研究,因此尚需多中心、大样本及多因素回归分析等进一步证实。

