肠道菌群失调与口腔疾病研究概述
——以儿童龋齿为例
翟敏
深圳市光明区妇幼保健院口腔科,深圳 518107
中国第四次口腔健康流行病学调查报告结果显示,在我国3~5 岁儿童的患龋率约占一半以上,且患龋率与发病年龄呈正比[1]。儿童龋齿具有发展快、侵蚀广、发病初期症状不明显等特点,严重影响咀嚼功能,造成恒牙排列不整齐,还可严重妨碍患儿身心健康和生长发育[2-3]。基于以上原因,对待龋病的宗旨是预防大于治疗,而预防应从龋齿的发病机制入手,一般来说,龋齿的发生必须满足细菌(bacteria)、宿主(host)、食物(food)和时间(time)4 个基本条件[4]。然而目前对于龋齿发病机制的研究,主要集中在口腔菌群对龋齿发生发展的影响,很少有研究关注肠道菌群失调和儿童龋齿之间的联系。众所周知,人体内和体表的微生物数量众多。为了表征人类微生物群落,第一阶段人类微生物组项目(human microbiome project,HMP)已于2007 年启动,该项目分析了300 名健康成年人的微生物群落[5-6]。随着HMP的完成,人们对微生物与人类健康的关系也取得了新的突破性的认识,“微生物组”的新时代已经开始[7]。肠道和口腔微生物群是人体中最大的两个微生物生态系统[8]。口腔和肠道既有物理联系,也有化学联系。有研究显示:肠道菌群失调儿童的龋齿发生率显著高于胃肠道健康儿童。肠道菌群失调主要指肠道优势菌群如双歧杆菌、乳酸杆菌等益生菌菌落丰度失衡,双歧杆菌作为重要的肠道益生菌主要参与微量元素(如铁、锌、钙等)和维生素D的生物合成[9]。维生素A、维生素C、维生素D 以及钙、磷、铁等离子的缺乏与儿童龋齿发生密切相关[10]。其中,钙离子、磷离子以及维生素D 参与牙体硬组织的发育形成和矿化。目前,有关肠道菌群失调与口腔疾病及儿童龋齿发生之间因果关系的研究相对较少[10]。故本文通过查阅PubMed、中国知网、万方等数据库,重点介绍口腔-肠道微生物轴及其对口腔疾病,特别是对儿童龋齿的影响,从而为临床中口腔疾病和儿童龋齿的诊断、治疗和预防提供理论依据。
肠道微生物和口腔微生物的组成
1、肠道微生物组成
肠道是人体中最大、特征最明确的微生物生态系统,包含500~1 000 种微生物类型[11]。肠道微生物群,主要是厌氧菌,由5 个主要菌门组成——拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门,但以拟杆菌门和厚壁菌门两个门为主,占肠道菌群的90%以上[12]。在属水平上,拟杆菌属最为丰富[13]。众所周知,人类肠道微生物群在生命早期就建立起来,后续会随着年龄和环境(如饮食和营养)而改变,类似于人类口腔微生物群的变化规律[13]。因此,口腔和肠道微生物群直接反映了宿主的健康状况。虽然肠道与口腔持续相连,但由于口腔-肠道屏障的存在,口腔和肠道微生物分布得到很好的隔离。口腔-肠道屏障可归因于胃中胃酸和十二指肠中胆汁酸的分泌[14]。胆汁酸可导致肠道细菌膜DNA 完整性受损,充当了口腔和肠道之间有效的天然屏障[15]。因此,胃酸和胆汁酸也是造成肠道和口腔微生物独特模式的原因之一。
2、口腔微生物组成
根据人类口腔微生物组数据库(HOMD,www.homd.org)资料显示,人体口腔存在大约700 种微生物。口腔中的共生菌门主要包含厚壁菌门、变形菌门、拟杆菌门、放线菌门、梭杆菌门和奈瑟菌门等[16]。口腔有几种不同的微生物栖息地,包括颊黏膜、龈下菌斑、龈上菌斑、角化牙龈、硬腭、唾液、扁桃体、舌头和喉咙[17]。健康人群的口腔均携带链球菌属、双菌属、韦荣菌属、嗜血杆菌属、奈瑟菌属、卟啉单胞菌属、梭杆菌属、放线菌属和普氏菌属等微生物菌属[18]。根据口腔pH 值、盐度、氧化还原电位、氧气和营养等影响因素,口腔生态位可分为以下3 个不同的亚组:颊黏膜、角化牙龈和硬腭微生物群;唾液、舌头、扁桃体微生物群;喉咙及龈下和龈上菌斑微生物群[19]。
肠道微生物和口腔微生物的生理功能
1、肠道微生物群的生理功能
人类肠道微生物组可以根据健康状况、环境因素、遗传学甚至生活方式而发生改变[20]。宏基因组分析表明,肠道微生物可以调节代谢途径,例如碳代谢和氨基酸合成[21]。微生物由于具有保守的分子基序,称为微生物相关分子模式(microbial-associated molecular patterns,MAMPs)和病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),可被宿主模式识别受体(pattern recognition receptors,PRR)例如 Toll 样受体进行识别[22]。这种微生物与宿主的相互作用可以刺激人体的免疫系统和炎性反应过程[23]。这意味着肠道菌群可以调节人体的中枢生物功能、新陈代谢和免疫反应,因此肠道菌群失调与多种人类疾病有关[24]。
2、口腔微生物的生理功能
虽然口腔是人体第二大微生物栖息地,但就目前的研究而言还不足以完全理解口腔微生物组对人类健康的影响。毫无疑问,口腔微生物组与牙齿健康直接相关[24]。口腔疾病中存在一些公认的病原体,例如与龋齿相关的变形链球菌和与牙周炎相关的牙龈卟啉单胞菌[25]。关于龋齿,目前最被接受的理论之一为“生态斑块假说”(图1)。这一假设指出,频繁的糖摄入促使共生细菌适应口腔酸性的微环境,同时有利于酸性菌物种(如链球菌属、乳酸杆菌属和放线菌属)的富集,同时抑制在中性pH 值下生长的有益微生物[26]。口腔微生物不仅影响牙齿健康,同时也可以影响全身健康状况[27]。流行病学和和实验研究发现,口腔微生物生态失调与一些系统性疾病密切相关,包括阿尔茨海默病、糖尿病和心血管疾病等[27]。在阿尔茨海默病患者中发现,莫拉菌属、细毛菌属和球毛菌属丰度升高[28]。与健康人群相比,1型糖尿病患者口腔微生物中放线菌门和厚壁菌门丰度升高[28]。此外,据报道,在动脉粥样硬化患者的口腔微生物群中,厌氧球菌属显著富集[29]。在牙周炎患者中,其标志性病原体牙龈卟啉单胞菌的富集可引起局部和全身慢性炎症[30]。此外,口腔生态失调可诱导PAMPs 信号的产生,从而导致先天免疫反应和炎症转录因子引发的的全身性刺激反应[31]。值得注意的是,口腔微生物群可以转移到其他器官,这被认为是口腔生态失调引起的全身性疾病的一种机制[32]。例如,口腔病原体牙龈卟啉单胞菌在阿尔茨海默病患者的脑组织中已检测到[33]。口腔病原体直接转移至大脑可通过诱导神经炎症和神经退行性病变而加重阿尔茨海默病[34]。此外,在冠状动脉疾病患者的动脉粥样硬化斑块中也检测到许多口腔共生菌,进一步表明口腔细菌可能易位至远端器官[35]。由于物理和化学联系,口腔微生物向胃肠道系统迁移的频率更高,在某些致病条件下,一些口腔细菌类群在胰腺和肠道中定植并富集,表明口腔和肠道微生物群之间存在直接的相互作用[36]。
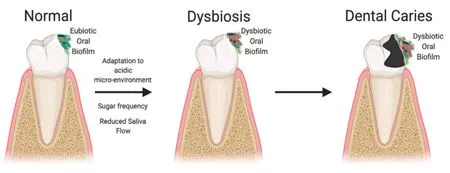
图1 口腔微生物失调与龋齿
口腔-肠道微生物轴
1、口腔-肠道微生物易位
由于存在口腔-肠道屏障、物理距离以及化学障碍(如胃酸和胆汁),口腔和肠道微生物群被很好地隔离[37]。然而,当口腔-肠道屏障受到损害时可导致微生物群在不同器官间发生易位。双歧杆菌是儿童肠道中最丰富的细菌类型[38]。有趣的是,儿童口腔中也检测到肠道常驻的双歧杆菌[39]。同样,与健康成年人相比,老年人口腔中也存在诸如卟啉单胞菌属、梭杆菌属和假杆菌属等肠道微生物群[40]。此外,低胃酸浓度可使口腔微生物群向肠道微生物群易位,进一步证明在口腔-肠道屏障功能障碍的情况下口腔微生物群可易位至肠道[41]。有研究者也通过无菌鼠进行粪菌移植实验证明口腔微生物群可以易位至肠道[42]。总之,这些数据表明口腔微生物在某些情况下可以克服口腔和肠道之间的物理和化学屏障转移到肠道中。例如,在炎症性肠病患者的肠道黏膜中发现了显著富集的嗜血杆菌和韦荣氏菌,同时它们也是常见的口腔共生菌[43]。在结肠癌患者中,他们的肠道微生物群中也检测到了梭杆菌等口腔微生物[44]。这意味着口腔微生物群可以侵入并定植在肠道黏膜中,并在黏膜稳态被破坏的条件下成为机会性病原体。
这种口-粪传播不仅仅是在病理或屏障破坏状态下发生,在生理条件下同样也可发生。HMP 将机体微生物群划分为不同部位的类群,口腔和肠道微生物组类型显示出强烈的相互关联,有研究分析了470 个健康个体口腔和粪便微生物组中的310 个微生物群,而唾液和粪便样本中普遍存在125 个微生物类群,包括链球菌、韦荣氏菌、放线菌和嗜血杆菌菌株等[45]。综上所述,即使在健康状态下,口腔微生物群也可以比预期更广泛地转移到肠道中,从而引发一系列生理和病理过程。
2、肠道-口腔微生物易位
肠道微生物可以通过粪-口途径直接接触或通过受污染的液体和食物间接接触而传播[46]。人体手部微生物群谱与口腔和肠道微生物组模式高度重叠,这表明手部可能是粪口微生物传播的主要载体[47]。此外,免疫功能低下的个体也容易受到粪口传播的影响。口腔卫生条件差也会进一步加剧粪口传播[48]。因此,不良的卫生条件或免疫功能低下都可能促进微生物群的粪口传播。尽管需要进一步研究以了解粪口传播在口腔和肠道微生物群中的作用,但令人信服的是,口腔和肠道微生物群通过口腔到肠道和肠道到口腔的途径密切相关。 口腔-肠道微生物和肠道-口腔微生物这种双向相互作用可以重塑两个栖息地的微生物生态系统,最终调节机体生理和病理过程,统称为“口腔-肠道微生物轴”(图 2)[49]。
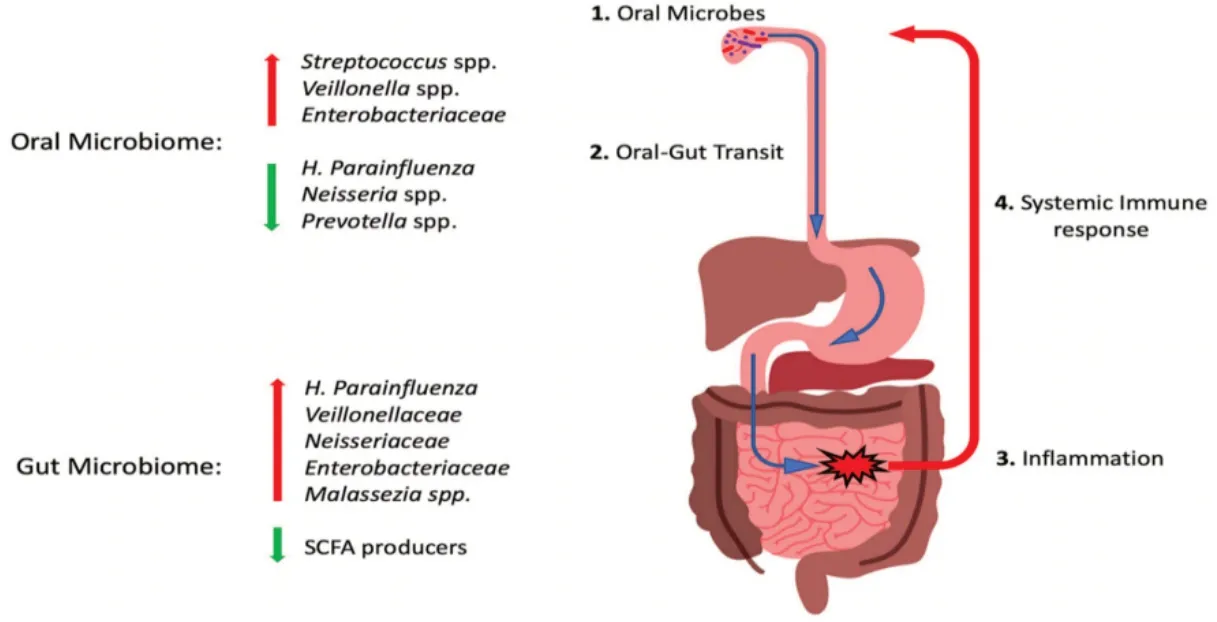
图2 口腔-肠道微生物轴
肠道菌群生态失调与儿童龋齿关系概述
1、宏基因组学在口腔和肠道微生物研究中的应用
人体和动物口腔中寄居着种类丰富的微生物类群,之前人们对口腔和肠道微生物的研究大多局限于单纯的细菌培养来进行分离纯化和鉴定,由于培养技术受到局限,很大一部分微生物很难或根本不能通过体外培养进行分离纯化和鉴定,而宏基因组学恰恰打破了这一局限性,帮助研究者发掘更为丰富的口腔和肠道微生物资源[50]。近年来,以宏基因组测序为基础的研究描绘出了口腔和肠道生态系统的图谱,越来越多的研究表明肠道微生物在各种口腔疾病甚至全身系统性疾病中具有举足轻重的作用,这也为基于人类微生物组的诊断和治疗提供了新思路、开辟了新的途径[51]。宏基因组学是研究人类肠道和口腔疾病乃至全身疾病相关微生物的强有力的工具,不仅有广阔的发展空间,同时也讨论了宏基因组学在应用中有待克服的局限性,为临床治疗相关疾病提供理论依据[52]。
2、肠道菌群与儿童龋齿的关系
目前认为变异链球菌、乳杆菌和放线菌与龋病的发生和发展密切相关,但是肠道微生物在龋病发生发展过程中的具体机制仍不明确[53]。有研究者通过持续饲喂Keyes 2000 高糖饲料和口腔涂布变异链球60 d 构建幼龄SD 大鼠龋齿模型;并使用头孢曲松钠药物溶液灌胃构建幼龄SD 大鼠肠道菌群失调模型,以此来分析大鼠肠道菌群失调是否会加快SD 大鼠龋齿的进展速度,以及是否会影响与口腔免疫功能相关的唾液分泌性免疫球蛋白A(secreted immunoglobulin A,sIgA)的浓度[54]。造模成功后,对SD大鼠粪便行16S rRNA测序,同时采集SD大鼠唾液通过ELISA法测定各组唾液中sIgA 的浓度,并取颌骨段进行Keyes 龋齿评分。
研究者接着对某市幼儿园内约1 000 名3~5 岁儿童进行口腔流行病学调查,详细记录每名儿童的性别、年龄和乳牙龋失补指数(dmft指数)[54]。根据龋失补指数将符合纳入标准的儿童分为无龋齿组(dmft=0)及高龋组(dmft ≥10),从两组中随机抽取25 名儿童搜集粪便和唾液进行16S rRNA测序和唾液sIgA 浓度测定,并经过生物信息学分析和数理统计,分别在门、属、种水平上发现相对丰度具有显著差异的微生物菌群。通过两组间Studentt-test 统计发现,无龋齿组中Eubacterium(真杆菌属)等菌群丰度高于高龋组,差异有统计学意义(P<0.05);无龋齿组中Parasutterella(副沙门氏菌)、Christensenellaceae(克里斯滕森菌)菌群丰度低于高龋组,差异均有统计学意义(均P<0.05);无龋齿组中Bacteroides cellulosilyticus(纤维素类拟杆菌)菌群丰度高于高龋组,差异有统计学意义(P<0.05);无龋齿组中Streptococcus mutans(变异链球菌)、Bacteroides vulgatus(共生假单胞菌)、Streptococcus anginosus(咽峡炎链球菌)菌群丰度低于高龋组,差异均有统计学意义(均P<0.05)。同时,动物肠道菌群失调间接导致其唾液sIgA浓度的降低。由此表明,肠道菌群失调会加快大鼠的龋齿恶化速度,且二者呈正相关,这可能与肠道中双歧杆菌属含量的降低有关。同样,低龄儿童龋齿会引发其某些肠道菌群如Streptococcus mutans(变异链球菌)、Bacteroides vulgatus(共生假单胞菌)以及Streptococcus anginosus(咽峡炎链球菌)丰度升高。
总结和展望
目前,关于肠道菌群与口腔疾病及儿童龋齿发生发展关系的研究,仍是起步阶段。动物肠道菌群的组成与多样性与地域、年龄、家庭状况,饮食结构等因素均有密切关系[55]。肠道微生物会随着个体年龄的变化而变化,但个体内的核心微生物群一般不会发生明显改变[56]。口腔与肠道作为人体微生物寄居的两大栖息地,已被研究者证实存在一定的联系,且具有致病共性。但目前通过数据库可搜索到的关于肠道菌群与儿童龋齿之间关系的相关研究相对较少,且仅局限于对现象的描述,未深入探究其详细机制。此外,益生菌的防龋齿作用与益生菌可改善肠道菌群失调的现象也间接说明,肠道菌群失调与口腔疾病及儿童龋齿之间可能存在一定联系。本文通过查阅PubMed、中国知网、万方等数据库,重点介绍口腔-肠道微生物串扰在口腔疾病及儿童龋齿中的作用,为后续通过操纵肠道微生物治疗口腔疾病和儿童龋齿提供理论依据。

