葛根素对腹泻型肠易激综合征肠道平滑肌神经递质调节机制的影响研究
林雨康 易书林 杨梅林 李幸展 李璟弘 陈涛 谈博 张佳敏
1湖南中医药大学中西医结合学院,长沙 410208;2广州中医药大学基础医学院,广州 510006
腹泻型肠易激综合征(irritable bowel syndrome with predominant diarrhea,IBS-D)是一种常见的功能性肠道疾病,以腹痛、腹部不适为主症,伴随排便习惯和/或性状的改变[1]。根据调查当前国人肠易激综合征(irritable bowel syndrome,IBS)患病率为1.4%~2.3%[2]。IBS共有4种亚型,而IBS-D 是国内最常见的分型[1]。虽然IBS-D 并非致命性疾病,但其难根治、易复发的特征严重影响着患者的日常生活,尤其是睡眠质量、心理状态和社交活动等方面,大大降低了患者生活质量和学习工作能力。目前中医治疗IBS-D效果尚可,因此深入探索中药药物对治疗IBS-D 的药效物质基础有着巨大前景[3]。本研究通过建立IBS-D动物模型,应用葛根素进行治疗,以内脏敏感性及肠组织的神经递质水平为评价指标,探讨葛根素对IBS-D 肠道平滑肌神经系统传导的影响,有望为IBS-D 的中药治疗提供新的实验依据和转化应用基础。
材料与方法
1、实验动物
实验动物采用SPF 级4 周龄雄性SD 大鼠,体质量为(100±10)g,购自广州中医药大学实验动物中心,实验动物生产许可证号:SCXK(粤)2018-0034,实验单位使用许可证[SCXK(粤)2018-0085]。
本研究通过广州中医药大学动物实验伦理委员会批准(202103160003)。
于2021 年11 月开始,适应性饲养1 周,正常进食和饮水,昼夜光照恒定,各循环12 h。环境温度保持于22~25 ℃,湿度为45%~55%,大鼠分4 笼饲养,每笼6 只,每天及时给水及添加灭菌全价颗粒饲料,及时清理排泄物及每日更换鼠笼,并且对鼠笼进行消毒处理。
2、主要药物与试剂
葛根素(成都曼思特生物科技有限公司,批号:MUST-22-10407);乙酰胆碱(Ach)测试盒(南京建成生物工程研究所,批号:A105-1);一氧化氮(NO)测定试剂盒(南京建成生物工程研究所,批号:A102-1);大鼠五羟色胺(5-HT)酶联免疫吸附试验(ELISA)检测试剂盒(天津安诺瑞康生物技术有限公司,批号TAE-106r)。
3、主要仪器
BioSpec-nano 岛津紫外可见分光光度计(日本岛津公司);匀浆机(北京天根生化科技有限公司);各种量程可调型移液器(德国Eppendorf公司);HR/T16M 高速冷冻离心机(湖南赫西仪器装备有限公司);医用弹力网状绷带(天津市华澳医疗保健有限公司);台式水银血压计(上海鱼跃医疗设备有限公司);8Fr导尿管(重庆加加林世纪医疗器械有限公司)。
4、实验方法
4.1、IBS-D 大鼠模型的建立及评价 根据文献建立IBS-D 大鼠模型[4]。造模方法为每日给予 2 h 束缚刺激,连续14 d。具体刺激方法为:乙醚轻度麻醉后,用医用弹性网状绷带束缚大鼠的前上肢、前肩、胸部,限制前上肢搔抓头面部,但不限制其他活动。造模完成后统计模型组大鼠内脏敏感性、排便面积指标,并观察模型组病理学有无器质性改变,以确定IBS-D 模型复制是否成功。若模型组与对照组大鼠对比出现内脏敏感性升高、排便面积增加的症状并有统计学差异,且模型组病理学无器质性改变,说明IBS-D模型成功复制。
4.2、动物分组及给药 24 只大鼠按照随机数字表法分为对照组6 只、造模组18 只。造模组在造模成功后分为模型组、葛根素低剂量组、葛根素高剂量组,每组6 只。在造模完成后连续14 d 给予灌胃给药,药物剂量依据2020 版《中国药典》[5]规定葛根临床用量为9~15 g,葛根素的得率为1.2%,按成人70 kg、葛根10 g 用量算,则人用葛根为142.86 mg/kg,换算后大鼠葛根剂量为0.9 g/kg,换算为葛根素为11 mg/kg。根据预实验结果本实验设葛根素低、高剂量组的大鼠给药量分别为22、44 mg/(kg·d),每日灌胃前精确称量4.4 g 葛根素,取少量纯水充分溶解后转入250 ml 容量瓶中定容,混匀后使用,低剂量组将溶液用纯水稀释1 倍后使用,每日灌胃前称量大鼠质量,计算出所需灌胃剂量。同时对照组与模型组给予等量生理盐水灌胃。
4.3、大鼠结肠组织病理改变评估 采用苏木精-伊红(HE)染色法观察各组大鼠结肠组织病理改变,沿结肠肌肉方向取大鼠结肠组织标本,厚度0.2~0.3 cm,尽量剔除结肠组织上附着的脂肪组织,生理盐水冲洗后,使用甲醛固定脱水、浸入石蜡包埋、切片后使用HE 染色法进行染色、封片,进行病理学分析。观察是否存在溃疡或炎症性病理改变。
4.4、大鼠内脏敏感性评估 采用球囊结直肠扩张(CRD)方法,在第28 天时检测其内脏敏感性。操作步骤如下:实验前禁食不禁水24 h,将导尿管和球囊通过肛门插入大鼠结直肠后用胶带固定,肛门外侧端球囊固定在距肛门1 cm 的尾部,将血压计通过三通阀与之连通,限制大鼠运动。逐步增大压力并仔细观察大鼠反应,记录大鼠在结直肠内压力达到60 mmHg(1 mmHg=0.133 kPa)时的活动并进行腹壁回缩反射(AWR)评分[6]。具体标准为:大鼠对CRD无行为反应计0 分;大鼠头部有短暂活动但身体无反应计1 分;大鼠腹壁肌肉出现收缩计2 分;大鼠腹部肌肉收缩并能离开桌面计3 分;大鼠身体呈弓形并伴有骨盆抬起计4分。
4.5、大鼠粪便情况评估 根据文献[4]方法,第21天和第28 天将其分别转移到铺有干净滤纸的笼内,每日相同时间段采集每只大鼠4 h粪便,在合适的高度对放有标准刻度尺的滤纸进行图像采集,通过ImageJ图像处理软件,计算大鼠4 h粪便面积。
4.6、微板法测定结肠组织Ach 含量 第28 天取大鼠组结肠组织后,使用组织匀浆机制备大鼠结肠组织匀浆,按照试剂盒说明书,取上清后依次加入各试剂制备6 组反应液,每组4 管(空白管、标准管、测定管、对照管),最后再次取上清加至96孔板在酶标仪550 nm波段处测定各孔OD值。记录每管对应OD值,计算结肠组织中的Ach含量。
4.7、硝酸还原酶法测定结肠组织NO 含量 第28 天取大鼠结肠组织后,使用组织匀浆机制备大鼠结肠组织匀浆,按照试剂盒说明书,取上清加入硝酸还原酶等试剂后滴入96 孔板,在酶标仪550 nm 波段处测定各孔OD 值。记录每管对应OD值,计算每组结肠组织中的NO含量。
4.8、ELISA 测定大鼠结肠组织5-HT 含量 应用ELISA定量测定大鼠结肠组织5-HT 的含量,在第28 天取大鼠结肠组织后,使用组织匀浆机制备大鼠结肠组织匀浆,按照试剂盒说明书,取上清后,使用纯化的抗5-HT 捕获抗体包被微孔内壁的表层,制成固相的载体。检测过程中依次加入各试剂样品,最后通过读取标准品吸光度值绘制标准曲线,并在标准曲线上根据样品吸光度值计算出待测样品的浓度。
5、统计学方法
采用SPSS 21.0 统计软件进行数据分析,符合正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,方差齐使用LSD 检验,若方差不齐使用Dunnett’s T3检验,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
1、病理评价
在光学显微镜下,模型组大鼠与对照组比较,结肠组织样本均无明显的病理改变,基本可排除炎症性病变,符合IBS-D 定义与组织学表现。同时,模型组大鼠病理切片未发现溃疡病灶,提示束缚应激的强度相对温和,未造成应激性溃疡。病理评价结果提示造模成功。具体见图1。
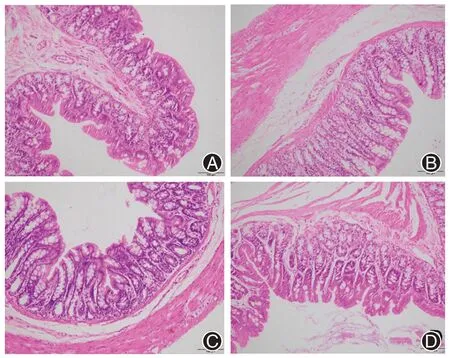
图1 各组腹泻型肠易激综合征模型大鼠结肠病理变化(HE 染色 ×200)。A 为对照组(以等量生理盐水灌胃),B 为模型组(造模完成后以等量生理盐水灌胃),C 为葛根素低剂量组[造模完成后给予葛根素22 mg/(kg·d)灌胃],D 为葛根素高剂量组[造模完成后给予葛根素44 mg/(kg·d)灌胃]
2、葛根素对IBS-D模型大鼠内脏敏感性的影响
在CRD 为60 mmHg 条件下,对照组大鼠AWR 评分为(0.53±0.02)分,模型组为(0.84±0.03)分,葛根素低剂量组(0.48±0.06)分,葛根素高剂量组(0.54±0.06)分;模型组与对照组比较差异有统计学意义(t=15.293,P<0.001);葛根素低、高剂量组与模型组比较差异均有统计学意义(t=11.811、9.338,均P<0.001)。
3、葛根素对IBS-D模型大鼠4 h排便面积的影响
与对照组比较,第21、28 天模型组大鼠4 h 排便面积均显著增加(均P<0.01);与模型组比较,第21、28 天葛根素低、高剂量组的4 h排便面积均显著减少(均P<0.01)。具体见表2。
表2 葛根素对腹泻型肠易激综合征模型大鼠4 h排便面积的影响(mm2,)
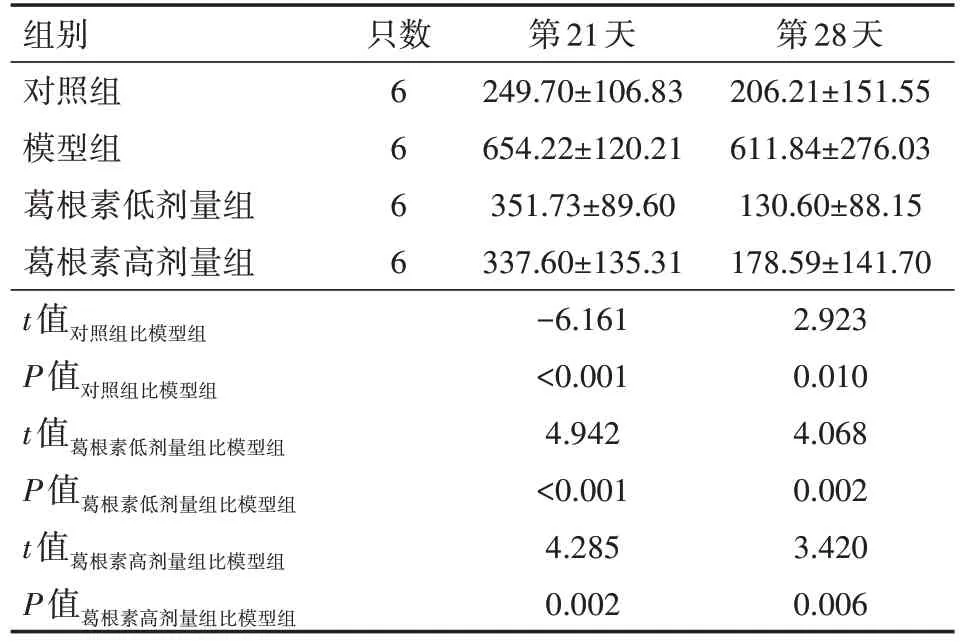
表2 葛根素对腹泻型肠易激综合征模型大鼠4 h排便面积的影响(mm2,)
注:对照组以等量生理盐水灌胃,模型组造模完成后以等量生理盐水灌胃,葛根素低剂量组造模完成后给予葛根素22 mg/(kg·d)灌胃,葛根素高剂量组造模完成后给予葛根素44 mg/(kg·d)灌胃
第28天206.21±151.55 611.84±276.03 130.60±88.15 178.59±141.70 2.923 0.010 4.068 0.002 3.420 0.006组别对照组模型组葛根素低剂量组葛根素高剂量组只数6 6 6 6 t值对照组比模型组P值对照组比模型组t值葛根素低剂量组比模型组P值葛根素低剂量组比模型组t值葛根素高剂量组比模型组P值葛根素高剂量组比模型组第21天249.70±106.83 654.22±120.21 351.73±89.60 337.60±135.31-6.161<0.001 4.942<0.001 4.285 0.002
4、葛根素对IBS-D 模型大鼠结肠组织Ach、NO、5-HT表达的影响
与对照组比较,模型组大鼠结肠组织Ach表达升高、NO含量降低、5-HT 表达升高(均P<0.05);与模型组比较,葛根素低剂量组的Ach 表达降低、NO 含量升高、5-HT 表达降低(均P<0.05),葛根素高剂量组的Ach、5-HT 表达均降低(均P<0.05)具体见表3。
表3 葛根素对腹泻型肠易激综合征模型大鼠结肠组织乙酰胆碱、一氧化氮、五羟色胺表达的影响()
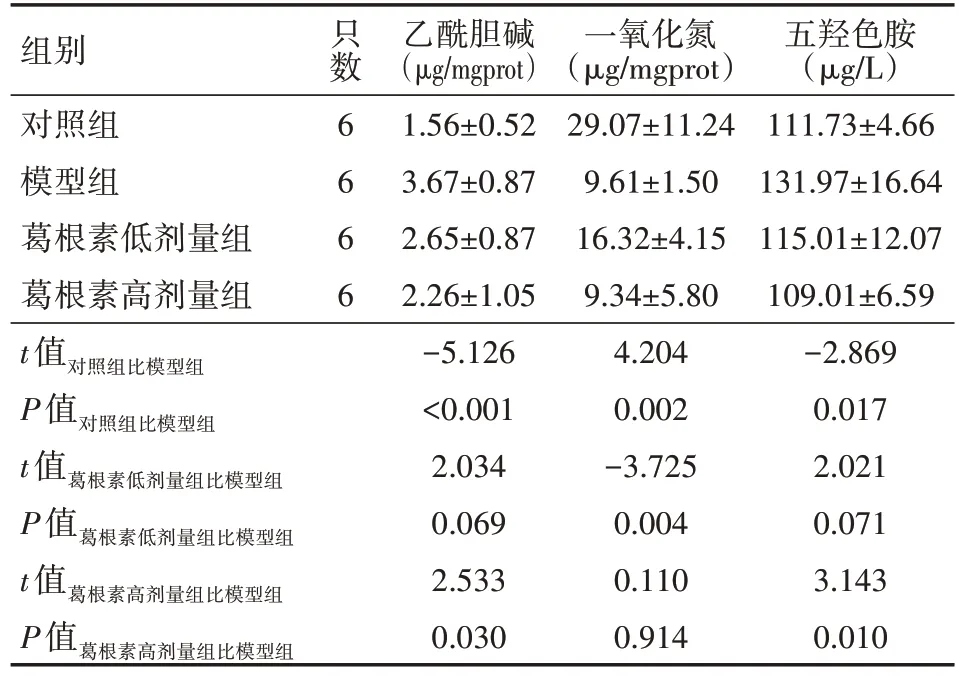
表3 葛根素对腹泻型肠易激综合征模型大鼠结肠组织乙酰胆碱、一氧化氮、五羟色胺表达的影响()
注:对照组以等量生理盐水灌胃,模型组造模完成后以等量生理盐水灌胃,葛根素低剂量组造模完成后给予葛根素22 mg/(kg·d)灌胃,葛根素高剂量组造模完成后给予葛根素44 mg/(kg·d)灌胃
组别对照组模型组葛根素低剂量组葛根素高剂量组只数6 6 6 6五羟色胺(µg/L)111.73±4.66 131.97±16.64 115.01±12.07 109.01±6.59-2.869 0.017 2.021 0.071 3.143 0.010 t值对照组比模型组P值对照组比模型组t值葛根素低剂量组比模型组P值葛根素低剂量组比模型组t值葛根素高剂量组比模型组P值葛根素高剂量组比模型组乙酰胆碱(µg/mgprot)1.56±0.52 3.67±0.87 2.65±0.87 2.26±1.05-5.126<0.001 2.034 0.069 2.533 0.030一氧化氮(µg/mgprot)29.07±11.24 9.61±1.50 16.32±4.15 9.34±5.80 4.204 0.002-3.725 0.004 0.110 0.914
讨 论
IBS-D 是以腹痛或腹部不适为主要症状的肠功能紊乱性疾病,IBS-D 的病因及发病机制尚未明确,研究表明胃肠运动异常、内脏高敏感性、脑-肠轴调节异常、肠道感染及免疫功能紊乱、肠道菌群紊乱、精神心理应激、饮食及遗传因素等都与其发病有关,目前主要采取对症治疗的方式进行干预[1]。
IBS-D 属中医学“泄泻”范畴,其中医病机多为脾运失职,小肠无以分清泌浊,大肠无法转化,水反为湿,谷反为滞,合污而下,则发泄泻,核心病机在于脾虚湿盛。治疗多以升阳化湿、健脾止泻为法。第10 版《中药学》教材中记载葛根具有止泻、生津、升阳的功效,在临床上多用于治疗脾虚型泄泻。葛根素是葛根的特有成分且含量最高,有研究指出葛根素对肠道平滑肌的舒张作用可能与其对肠神经递质释放的调控有关[7-8]。李娇娇[9]的研究结果指出葛根素可以保护肠道组织结构,预防结肠组织中5-HT 的浓度升高,从而影响肠道的蠕动功能。张凤杰[10]的研究指出葛根素对大鼠离体的平滑肌具有明显的抑制作用。综上所述,葛根素或可通过调控肠神经递质的释放进而对IBS-D 产生治疗作用。故本次实验通过制备大鼠慢性束缚应激模型,观察了葛根素对大鼠的相关各项指标的影响。
根据相关报道,IBS-D 模型评价的主要指标是粪便情况的改变,肠、大鼠内脏敏感性的改变以及病理学无器质性改变[4,11-12]。本研究运用慢性束缚应激刺激,模型组大鼠出现有内脏敏感性显著升高、排便面积显著增加的症状,且模型组病理学无器质性改变,说明IBS-D模型成功复制。
本实验中葛根素低、高剂量均能显著减少IBS-D 大鼠的排便面积并降低内脏敏感性,说明葛根素对慢性束缚应激诱导的IBS-D大鼠具有一定的治疗作用,
肠神经系统(ENS)由位于肠道壁内的神经元及其支持细胞所组成,为肠内固有的神经支配系统,支配肠道平滑肌的运动。胆碱能神经元和非肾上腺素能非胆碱能(NANC)神经元是ENS重要的组成部分。胆碱能神经元合成释放的Ach 是最主要的兴奋性运动神经递质。NANC 是新近发现的一类抑制性运动神经元主要包括NO、三磷酸腺苷、5-HT、血管活性肠肽等。从中选取Ach、NO、5-HT 3个相对具有代表性的神经递质进行实验分析。
Ach 是胆碱能神经元分泌的神经递质,属于肠道的兴奋性神经递质。其受体主要为M 受体,其中M2 和M3 亚型主导肠道平滑肌收缩[13]。本实验结果发现,葛根素低、高剂量均对IBS-D 大鼠结肠组织Ach 表达水平有明显下调作用(均P<0.05),提示葛根素可能通过抑制Ach 表达水平从而降低Ca2+释放和底物蛋白发生磷酸化改善大鼠结肠平滑肌舒缩状态。
NO 是平滑肌神经肌肉接头的主要抑制性神经递质,是一种肠动力强抑制性神经递质。NO 由一氧化氮合成酶生成,NO 通过激活可溶性鸟苷酸环化酶产生环磷酸腺苷,促进平滑肌舒张[15-16]。Jang 等[17]的研究证明 NO 水平降低可直接导致肠道蠕动加快,缩短结肠中水的吸收时间,从而导致IBS-D 大鼠大便含水量的增加,内脏敏感性增高,从而出现腹痛、腹泻等症状。本实验模型组大鼠结肠组织中NO含量明显降低,低剂量组葛根素可使大鼠结肠组织NO表达水平显著增高,改善平滑肌收缩从而改变排便情况达到止泻作用。
5-HT 是一种参与中枢神经系统和肠道活动的神经递质,在肠上皮细胞内分布的5-HT可以控制肠平滑肌舒缩和分泌反射[18]。有研究提示 5-HT 通过 5-HT2B 受体直接作用于肠道黏膜上皮细胞或平滑肌细胞调节结肠的运动及分泌,5-HT 还可通过作用于外源性传入神经元上的5-HT3、5-HT4 受体,增加细胞内Ca2+的浓度,调节中枢神经和外周神经元的兴奋性,导致内脏高敏感性和腹部不适等肠道功能异常[19]。本实验研究发现葛根素可明显降低大鼠结肠组织中5-HT 的浓度(P<0.05),提示葛根素可能通过下调5-HT的表达水平从而发挥治疗IBS-D的作用。
综上所述,本实验通过建立IBS-D 大鼠模型探究葛根素对IBS-D 肠道平滑肌神经系统传导的影响,研究结果提示葛根素能够显著改善IBS-D 大鼠的内脏高敏感性以及排便状况,且从总体结果分析葛根素低剂量组取得的治疗效果相对更显著,提示在临床应用当中应注意葛根素的使用剂量。其机理或是通过上调结肠NO 表达水平,下调结肠Ach、5-HT 表达水平来对IBS-D 起到治疗效果。葛根素影响神经递质的释放的机制,是不是因为其能影响ENS 的囊泡转运或通过影响肠道菌群从而导致肠神经元功能改变,值得进一步思考。
利益冲突所有作者均声明不存在利益冲突

