广东花生果腐病病原菌鉴定及药剂筛选试验
邢珏珺,许毓钊,苏钰彤,魏欣莹,江海琪,喻国辉,尹 艳
(1.仲恺农业工程学院实验与设备处,广东 广州 510225;2.仲恺农业工程学院植物健康创新研究院/农业农村部华南果蔬绿色防控重点实验室/广东省普通高校果蔬病虫害绿色防控重点实验室,广东 广州 510225;3.仲恺农业工程学院农业与生物学院,广东 广州 510225;4.仲恺农业工程学院资源与环境学院,广东 广州 510225;5.广东省农业科学院蔬菜研究所,广东 广州 510640)
【研究意义】花生果腐病是世界性分布的花生重大土传病害,主要由镰刀菌(Fusariumspp.)和腐霉菌(Pythiumspp.)等病原真菌复合感染引起,在我国花生产区普遍发生并造成严重的经济损失,是影响花生产量的重要因素之一[1-2]。【前人研究进展】花生果腐病最早在美国报道,患病花生地上部分无症状,病害主要为害果柄和荚果,不同发育阶段的荚果均可受害,果仁也表现出不同程度的腐烂[3],由群结腐霉P.myriotylum和茄病镰刀菌F.solani混合感染引起[4]。国内花生果腐病最早在河北省被发现,鉴定的病原菌也是P.myriotylum和F.solani[5]。从地理分布上来看,镰刀菌引起的花生果腐病在我国发生最为普遍,包括河北[1]、山东[6]和海南[7]。除此之外,近年来还有一些新的病原菌报道,如P.deliense[8]、Neocosmospora vasinfecta[9]和N.striata[10]都可以引起花生果腐病。对花生果腐病的防控主要从抗性品种选育[11-13]、土壤调理剂应用[14]和生物防治[15-16]等几个方面展开:山东花生研究所测试了76 个花生品种(系)对花生果腐病的抗性,未发现免疫品种,但获得高抗品种2 个、抗病品种7 个、中抗品种12个,其中花育9115 的抗性最好[13];在吉林利用解淀粉芽胞杆菌(Bacillus amyloliquefaciens)SWM-1 的可湿性粉剂和固体发酵剂对花生果腐病开展的田间防控效果显示,固体发酵剂具有明显的防效和增产效果[17];利用解淀粉芽胞杆菌(B.amyloliquefaciens)GF-3 和GF-22 制备的生物有机肥也能够显著降低由花生侵脉新赤壳菌(N.vasinfecta)引起的果腐病[15];贝莱斯芽胞杆菌(B.velezensis)Hsg1949 菌株的菌悬液也可以显著降低发病率,对花生果腐病的防治效果与多菌灵相当[16];此外,土壤调理剂改良土壤或用种衣剂拌种,也可以有效降低花生果腐病的发生[14]。目前尚无花生果实腐烂病化学防控药剂筛选的报道。【本研究切入点】花生是广东最主要的油料作物,近年来栽培面积逐年上升,2020年达到34.67 万hm2,产量达到112.05 万t[18]。广东省花生大豆产业技术体系2019 年调查发现粤北地区花生果腐病发生严重,但病原菌不清楚,缺乏有效的防控药剂供农户参考。【拟解决的关键问题】分离并鉴定广东花生果腐病的病原菌,筛选对病原菌具有较好抑菌效果的杀菌剂,为进一步采取措施减少花生果腐病在广东的传播和危害提供指导。
1 材料与方法
1.1 病原菌的采集、分离和回接
1.1.1患病花生样品采集和病原菌分离 2019 年8 月从韶关市曲江区樟市镇采集罹患果腐病的花生样品,采用常规组织分离法进行病原菌分离,从果荚的病健交界处取小块组织,表面消毒后置于PDA 培养基上,25 ℃培养,待长出菌丝后,立即挑取边缘菌丝到新的PDA 上培养,直至获得纯化的菌株并保藏备用。从花生果腐病样品中共分离获得9 株真菌。
1.1.2分离真菌的致病性回接 采用了2 种花生荚果作为回接材料验证菌株致病性,回接方法参照文献[6-7]。初筛使用仲恺农业工程学院选育的花生品种仲恺花1 号的干燥荚果为回接材料,将荚果洗净后无菌水冲洗4 次,再用70%酒精浸泡10 s 消毒,消毒后用无菌水清洗4 次。在超净工作台内将荚果吹干。将接种针在火焰上灼烧冷却后,在花生果嘴部位刺5 个小孔,将菌丝块倒贴刺孔的位置,用湿润的无菌脱脂棉覆盖保湿,再用保鲜膜固定。接种5 d 后,观察各菌株接种后的发病情况,将发病症状与果腐病症状相似的荚果开展病原菌分离,确定9 株真菌中的R4.2 和R5 菌株是致病菌。从韶关采集新鲜的花生荚果,使用幼嫩荚果和成熟荚果同时进行回接实验,再次检查2 株病原菌对不同成熟度花生荚果的致病性。
1.2 病原菌的分子鉴定
1.2.1基因组DNA 制备 使用PDB 培养液培养病原菌,离心获得菌丝球后,用ZR Fungal/Bacterial DNA Miniprep(货号D6005,购自ZYMO)制备基因组DNA。
1.2.2ITS1-ITS4 区PCR 扩增和 序列测定 采用真菌核糖体rDNA 区的通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)扩增待测真菌的ITS1-5.8S-ITS2 rDNA 全序列及部分18S和28S rDNA 序列。引物由生工生物工程(上海)股份有限公司合成。PCR 反应体系:2×Taq Plus PCR MasterMix(货号KT205,购自天根生化科技(北京)有限公司)12.5 μL,上游引物1 μL,下游引物1 μL,模板DNA 1 μL,ddH2O 9.5 μL。PCR 反应条件:94 ℃预变性3 min,94 ℃变性1 min,55℃退火1 min,72℃延伸1.5 min,35 个循环,最后72℃延伸5 min。扩增产物经1%琼脂糖凝胶电泳分离,目的片段用胶回收试剂盒Gel Extraction Kit(货号D2500,购自OMEGA)回收纯化,送生工生物工程(上海)股份有限公司测序。
1.2.3系统发育分析 获得2 个菌株的序列后,利用BLAST 在线分析软件在NCBI 核酸数据库中比对,挑选其中已公开发表的菌株序列,用Mega5.1 软件采 用Maximum-Likelihood(Kimura 2-parameter model,Bootstrap 500)法构建系统发育树。
1.2.4药剂对病原菌的毒力测定 2022 年4 月在仲恺农业工程学院植物健康创新研究院实验室采用菌丝生长速率法对几种市售杀菌剂开展室内毒力测定[19-20]。供试杀菌剂包括:98%噁霉灵可溶粉剂(天津市绿亨化工有限公司生产)、40%福美双悬浮剂(广东植物龙生物技术股份有限公司生产)、24%井冈霉素A 水剂(武汉科诺生物科技股份公司生产)、10%苯醚甲环唑水分散粒剂(先正达南通作物保护有限公司生产)、10%多抗霉素可湿性粉剂(日本科研制药株式会社生产),药剂均购于农化市场。将药剂配制成不同浓度梯度,使药剂有效成分形成浓度梯度(噁霉灵浓度梯度为0、0.125、0.25、0.5、1、2 mg/L,井冈霉素A 浓度梯度为0、1.5、3、6、12、24 mg/L,福美双浓度梯度为0、0.25、0.5、0.1、0.2、0.4 mg/L,苯醚甲环唑浓度梯度为0、0.1、1、10 mg/L,多抗霉素浓度梯度为0、0.01、0.1、1 mg/L),将药剂加入已灭菌的PDA 培养基内混合均匀,倒入一次性培养皿中,对照组的培养基中加入无菌水。将病原菌菌饼接种至无药剂的PDA 培养板及含不同浓度药剂的PDA 培养板的中心位置,每个处理重复3 次,培养板放置26℃培养箱内培养,至对照PDA 培养基中真菌长满整个培养皿后测量各药剂处理的PDA 培养基中病原菌的直径。计算各药剂对病原菌的平均抑制百分率:

利用DPS 数据处理系统计算毒力回归方程、相关系数并求出EC50。
2 结果与分析
2.1 花生果腐病发病症状
罹患花生果腐病的植株地上茎叶在大田无症状,但是花生荚果和果柄出现腐烂(图1A),大部分严重发病的花生,果仁也腐烂并出现空壳(图1B)。果腐病在韶关十分普遍,但不同地块的发病程度有差异,水稻和花生轮作可以减轻病害发生。果腐病发生严重程度目前尚无统一的评价方式,文献报道的评价方式主要有2 种,一种是根据荚果腐烂程度设置病级并计算病情指数来统计发病率,另一种是根据被害荚果数占总荚果数的比例来判断发病率。根据图1 和田间调查的情况来看,发病严重时使用发病率指数来判断比较能反应实际情况,但在病害发生情况不严重时,病情指数评价更合适。

图1 花生果腐病发病症状Fig.1 Symptoms of peanut pod rot
2.2 病原菌的分离纯化
选取典型的罹患果腐病的花生荚果,用PDA培养基分离,经过反复纯化后得到9 株真菌分离物,用于进一步的致病性测定。
2.3 病原菌的致病性测定
将获得的9 株真菌分离物在室内进行回接测定,发现其中2 株真菌R4.2 和R5 回接后引起仲恺花1 号的干燥荚果出现与田间症状相似的腐烂症状(图2)。采集田间的新鲜健康荚果进一步测定2 株真菌对不同成熟度花生荚果的致病力(图3),对照荚果表面消毒后用无菌接种针扎孔,在保湿培养条件下无病害症状出现,但R4.2和R5 菌株回接后引起腐烂症状,其中R4.2 对幼嫩果实和成熟果实都有致病力,而R5 主要引起幼嫩果实发病。R4.2 和R5 的菌落形态如图4 所示,在27℃培养5 d 可以长满整个培养皿,菌丝为白色,气生菌丝丰富。

图2 2 株真菌菌株回接引起干花生果荚腐烂症状Fig.2 Rot symptoms of dry peanut pod caused by 2 fungi strains inoculation
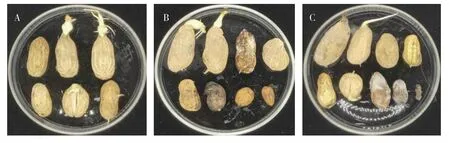
图3 2 株真菌引起成熟度不同的鲜花生果实腐烂症状Fig.3 Rot symptoms of fresh peanut pod in different ripeness caused by 2 fungi strains inoculation

图4 2 株真菌在PDA 培养基上的菌落形态Fig.4 Colony morphologies of 2 fungi strains on PDA medium
2.4 病原菌的系统发育分析
利用ITS1 和ITS4 通用引物扩增出长约540 bp 的片段,测序后进行同源性比对,发现R4.2菌株的ITS 序列与GenBank 中的茄病镰刀菌(F.solani)的同源性达到99%以上,R5 菌株与尖孢镰刀菌(F.oxyspourm)的同源性达到99%以上。从NCBI 的比对结果中下载已发表的序列,选择与尖孢镰刀菌遗传距离较近的层出镰刀菌(F.proliferatum)和与茄病镰刀菌遗传距离较近的假剑形镰刀菌F.pseudensiforme作为内参,以里氏木霉菌Trichoderma reesei为外参构建的系统发育树如图5 所示,R4.2 菌株初步鉴定为茄病镰刀菌(F.solani),R5 菌株初步鉴定为尖孢镰刀菌(F.oxyspourm)。
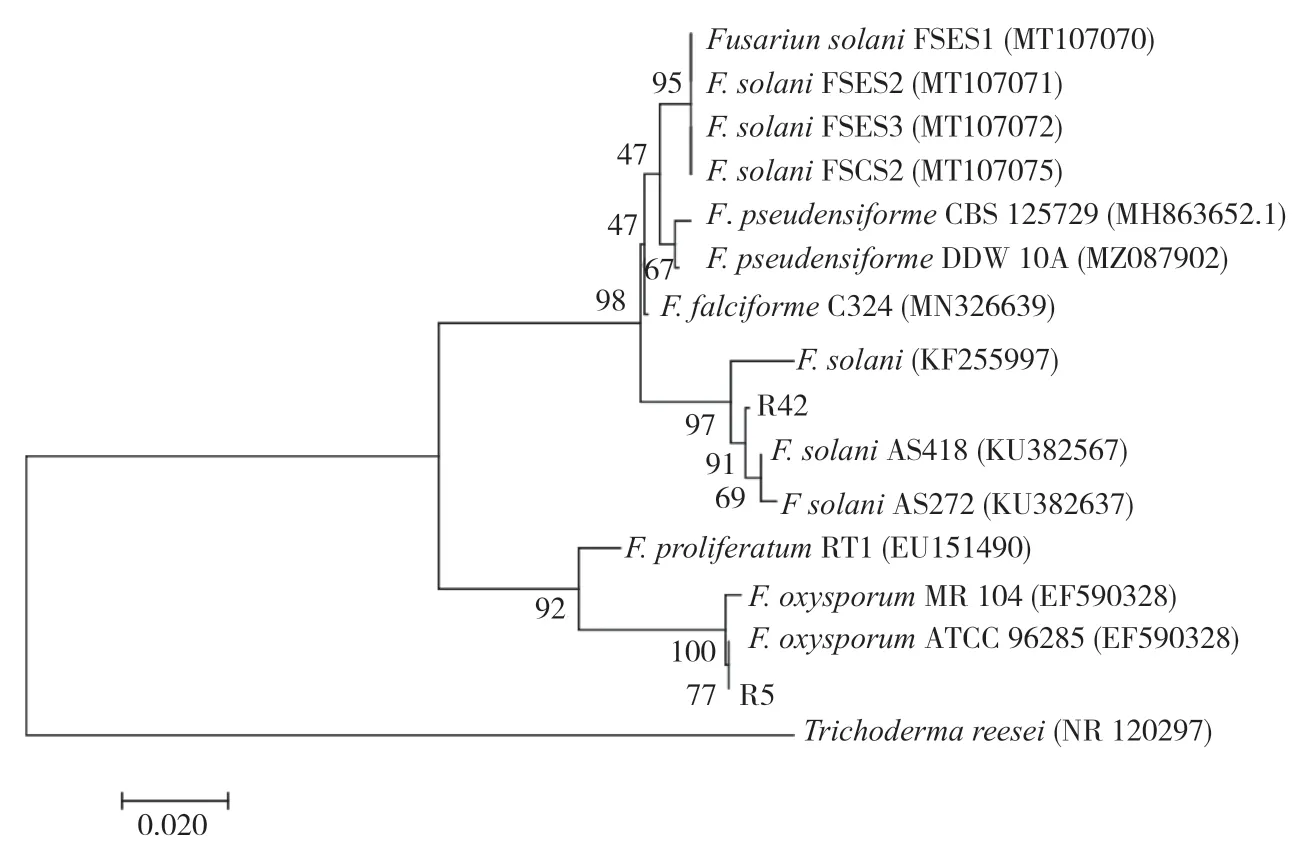
图5 基于R4.2 和R5 菌株ITS 序列构建的系统发育树Fig.5 Phylogenetic tree based on ITS sequences of R4.2 and R5 strains
2.5 杀菌剂对病原菌的毒力测定
由表1 和表2 可知,在供试的5 种杀菌剂中,苯醚甲环唑和多抗霉素对2 株花生果腐病病原真菌没有抑菌活性,但另外3 种杀菌剂,包括井冈霉素A、噁霉灵和福美双则对2 株病原菌均具有抑菌活性,福美双的抑菌活性最强,其次是噁霉灵,井冈霉素A 虽然也有抑菌活性,但是EC50较高,达到11.185 mg/L 和20.575 mg/L。

表2 5 种药剂对尖孢镰刀菌R5 菌株的毒力测定结果Table 2 Toxicity test results of 5 fungicides to Fusarium oxysproum stain R5
3 讨论
文献报道广东地区花生的真菌性病害主要有叶斑病、锈病、茎腐病、根腐病和冠腐病[21]、白绢病[22]以及黑腐病[23],还没有果腐病的报道。花生果腐病最早在美国被发现,之后许多国家相继报道了该病[3],国内最早在河北省被发现,据调查该病可能在2000 年左右已经开始发生,是群结腐霉(P.myriotylum)和茄病镰刀菌(F.solani)混合感染引起[5],但镰刀菌可能是主要的病原[1]。此外,还在河北地区发现了新的果腐病病原菌,包括侵脉新赤壳菌N.vasinfecta[9]和N.striata[10]。近年来 在海南也发现了花生果腐病,初步鉴定也是由镰刀菌(Fusariumsp.)引起[7]。本研究从广东韶关采集的样本中也仅分离出镰刀菌,通过致病性回接确定茄病镰刀菌(F.solani)可能是主要的致病菌,尖孢镰刀菌(F.oxysporum)主要在幼果期危害,与文献报道的病原菌以及国内其他地方报道的病原菌相似。
花生果腐病的发生受到气候、土壤条件和根际微生物群落等的影响。有研究显示日平均温度和降雨量的升高显著加重病害,土壤的粘质程度、含水量、连作时长和施肥量等也与病害发生正相关[2]。土壤真菌群落结构也与花生果腐病的发生相关,镰刀菌属Fusarium、毛壳菌属Chaetomium、链格孢属Alternaria和Sordariomycetes等是患病土壤的优势种[24],镰刀菌属Fusairum和隐球菌属Cryptococcus的物种在土壤样品中少,在果腐病样品中多,是主要的病原菌[25]。
福美双属于有机硫类杀菌剂,噁霉灵属于噁唑类杀菌剂,文献报道这两种类型的杀菌剂都对镰刀菌具有较好的抑制效果[26],对引起红花玉兰根腐病的病原菌F.solani1123-3 菌株的EC50分别为0.029 g/L 和0.129 g/L,本研究测定福美双对引起花生果实腐烂的F.solaniR4.2 菌株的EC50为0.021 mg/L,噁霉灵对R4.2 的EC50也远低于文献,可能与不同的菌株对药剂的敏感度不同有关。文献报道[27]井冈霉素对引起党参根腐的F.solaniCQ-4 菌株的EC50为0.095 g/L,对CQ-13 菌株的EC50为0.457 g/L,但本研究测定井冈霉素A 对F.solaniR4.2 的EC50为11.185 mg/L,低于文献报道的浓度,出现这种差异可能与测试菌株不同以及药剂剂型有关。此外,文献报道多抗霉素[27]和苯醚甲环唑[28]对镰刀菌具有抑菌活性,但本研究测定的多抗霉素和苯醚甲环唑对引起花生果腐病的F.oxysporumR5 和F.solaniR4.2 均无抑菌活性,可能与不同测试菌株对药剂的敏感性存在差异有关。
花生果腐病是土传病害,单一的防控措施可能难以持续凑效,未来需要对花生果腐病开展综合防控技术研究和集成,结合抗病品种筛选、土壤调理剂应用、种衣剂应用和生物防治产品应用等构建绿色防控技术体系,推动花生产业的健康发展。
4 结论
本研究首次报道了广东花生果实腐烂病的为害,目前该病已经在粤北地区广泛发生,应引起重视。研究结果表明韶关采集的病样是由镰刀菌复合感染引起的,经鉴定病原菌为茄病镰刀菌(F.solani)和尖孢镰刀菌(F.oxysporum),茄病镰刀菌的致病力强,可以同时感染幼果和成熟的花生果荚,而尖孢镰刀菌的致病力则较弱,主要引起幼果发病。室内药剂筛选显示福美双对茄病镰刀菌R4.2 菌株的EC50为0.021 mg/L,对尖孢镰刀菌R5 菌株的EC50为0.001 mg/L,噁霉灵对茄病镰刀菌R4.2 菌株的EC50为0.217 mg/L,对尖孢镰刀菌R5 的EC50为0.296 mg/L,可以用于花生果实腐烂病的防控,但施用方式和田间防效还有待进一步研究。

