血清细胞因子TNF-α、IL-4、sIL-2R和IFN-γ对预测抗结核治疗效果的价值
聂文娟 石文卉 刘佩英 杨扬 王隽 王庆枫 初乃惠
结核病是由结核分枝杆菌感染引起的慢性疾病,目前仍然是世界许多地区负担最重的传染病之一[1]。为监测结核病活动程度,临床上已将血红细胞沉降率和C反应蛋白等炎性标志物与胸部影像学检查、细菌负荷试验等联合使用[2],但这些生物标记物特异性较差,且易受患者炎症水平和健康状况的双重影响。
既往研究发现,宿主T细胞介导的免疫应答在结核病发病机制中起着重要作用,同时也对分枝杆菌提供免疫保护,分枝杆菌抗原激活免疫系统与细胞因子水平升高密切相关。在这些研究中,部分细胞因子包括肿瘤坏死因子-α(TNF-α)、白细胞介素4(IL-4)、可溶性白细胞介素受体(sIL-2R)和γ-干扰素(IFN-γ)等已被认为可能与患者体内免疫激活状态相关,且这些研究均为评价血清细胞因子水平,而并非经体外抗原刺激外周血单个核细胞的方法,操作过程更简便,可能成为疾病诊断和治疗过程中的生物标志物[3-4],但许多评估此类方法的研究并未能证明其在临床环境中的使用是否合理[5-6],因此,这些方法的价值仍存在争议。基于此,笔者希望通过监测活动性肺结核患者血清中细胞因子水平,并将其与临床病程进行相关性分析,以探索其监测结核病活动程度和抗结核治疗效果的意义。
对象和方法
一、研究对象
采用前瞻性队列研究方法,参照入组标准从2017年12月至2019年6月首都医科大学附属北京胸科医院收治的75例新诊断活动性肺结核患者中纳入67例患者作为研究对象。其中,男性43例(64.2%),女性24例(35.8%);<50岁18例(26.9%),≥50岁49例(73.1%);无空洞37例(55.2%),有空洞30例(44.8%);有呼吸道症状(如发热、咳嗽、咳痰或胸痛等)者31例(46.3%);痰抗酸染色涂片细菌负荷分级为阴性、+、++、+++、++++者分别为4例(6.0%)、26例(38.8%)、23例(34.3%)、10例(14.9%)、4例(6.0%),所有痰涂片阳性患者痰培养均阳性。本研究经首都医科大学附属北京胸科医院伦理委员会批准(2016年临审第02-01号)。
纳入标准:(1)经痰液或支气管肺泡灌洗液分枝杆菌培养阳性及分子或表型药物敏感性试验确诊为肺结核的患者;(2)年龄范围为18~65岁;(3)胸部CT显示伴有肺部病变,可有或无空洞;(4)糖化血红蛋白低于6.0%;(5)均自愿参与本研究并签署知情同意书。
排除标准:(1)既往抗结核治疗>30 d者;(2)目前正在接受包括糖皮质激素等影响免疫功能药物治疗者;(3)合并免疫性疾病或免疫系统异常人群,或出现其他影响免疫状态的合并症,如肝功能损伤、类赫氏反应等;(4)合并糖尿病者;(5)耐药结核病患者。
二、研究方法
1.相关细胞因子检测:在抗结核治疗前、治疗过程中每1~2个月和治疗结束时(即治疗第6个月左右)采集血样。使用2 ml离心管收集血液样本,800×g离心10 min后分离血清,处理后于-70 ℃下储存,直至使用,避免重复冻融循环。采用酶联免疫吸附试验(ELISA)试剂盒检测细胞因子TNF-α、IL-4、sIL-2R和IFN-γ水平,重复2次。将黏附的细胞上清液或标准物添加到抗细胞因子单克隆抗体涂层微量滴定板中,再添加针对细胞因子分子第2表位的酶结合抗细胞因子单克隆抗体进行培养和洗涤,去除未结合的抗体后添加底物,读取490 nm处吸光度值。标准曲线由使用细胞因子标准进行的ELISA绘制,用于量化实验样本中的细胞因子水平。实验操作过程设立阳性对照和阴性对照。
2.治疗随访:在治疗开始前和治疗后的6个月期间进行患者的诊断、治疗、不良反应处理等随访。使用抗结核药物包括异烟肼、利福平、乙胺丁醇和吡嗪酰胺。患者入院2周后开始抗结核治疗,以确保治疗依从性,并要求出院后至少每月能够返回医院1次。治疗开始时收集痰液以进行涂片和培养,治疗过程中到治疗结束时每月行痰培养,每3个月进行1次胸部CT检查。出现不良反应的患者被要求每周或每15 d复查,或根据病情严重程度判定是否入院治疗。治疗的第一个月有58例(86.6%)患者痰培养阴转,第二个月所有患者痰培养均阴转,且治疗结束后均治愈。
三、统计学处理
使用SPSS 24.0 软件进行数据的统计分析。非正态分布的计量资料以“中位数(四分位数)[M(Q1,Q3)]”描述。治疗过程中细胞因子水平变化与治疗时间的关系采用线性趋势检验,用于评估血清中各细胞因子水平在监测结核病治疗进展中的价值,同时对各细胞因子治疗前的基线血清水平值、治疗1~2个月和6个月时的水平值进行受试者工作特征曲线(ROC)分析,以确定最佳临界值,再以最佳临界值为参照标准,将高于最佳临界值者视为阳性者,以预测各指标水平的诊断效能。以P<0.05为差异有统计学意义。
结 果
一、治疗过程中血清细胞因子水平(表1)
1.治疗过程中血清TNF-α水平:治疗前血清TNF-α水平与治疗后6个月水平的差异有统计学意义(χ2=33.421,P=0.002),但与治疗1~2个月后的水平差异无统计学意义(χ2=21.375,P=0.327)。
2.治疗过程中血清IL-4水平:治疗前血清IL-4水平与治疗1~2个月和治疗6个月水平的差异均无统计学意义(χ2=32.136,P=0.232;χ2=39.158,P=0.529),且治疗1~2个月与治疗6个月的水平差异也无统计学意义(χ2=35.831,P=0.525)。
3.治疗过程中血清sIL-2R水平:治疗前血清sIL-2R水平与治疗1~2个月水平差异有统计学意义(χ2=15.276,P=0.036),与治疗6个月水平差异无统计学意义(χ2=12.613,P=0.982),且治疗1~2个月水平与治疗6个月水平的差异也无统计学意义(χ2=11.914,P=0.085)。
4.治疗过程中血清IFN-γ水平:治疗前血清IFN-γ水平与治疗1~2个月水平的差异有统计学意义(χ2=31.111,P=0.000),与治疗6个月水平的差异无统计学意义(χ2=3.212,P=0.073),且治疗1~2个月水平与治疗6个月水平差异也无统计学意义(χ2=29.903,P=0.642)。
二、各细胞因子的ROC曲线分析
对有差异的血清TNF-α、IFN-γ和sIL-2R三种细胞因子进行ROC曲线分析。结果显示:当血清TNF-α水平为845.2 pg/ml时,其检测敏感度为51.2%、特异度为60.0%,曲线下最大面积(AUC)为0.594(P=0.013)(图1),即845.2 pg/ml为其最佳临界值。当血清sIL-2R水平为15.0 pg/ml时,其检测敏感度为61.5%、特异度为55.2%,AUC为0.597(P=0.054)(图2),即15.0 pg/ml为其最佳临界值。当血清IFN-γ水平为393.3 pg/ml时,其检测敏感度为60.0%、特异度为64.2%,AUC为0.651(P=0.017)(图3),即393.3 pg/ml为其最佳临界值。

表1 治疗前后血清TNF-α、IL-4、sIL-2R和INF-γ水平

图1~3 分别为治疗前、治疗1~2个月和治疗后6个月血清TNF-α、sIL-2R和IFN-γ水平的ROC曲线分析
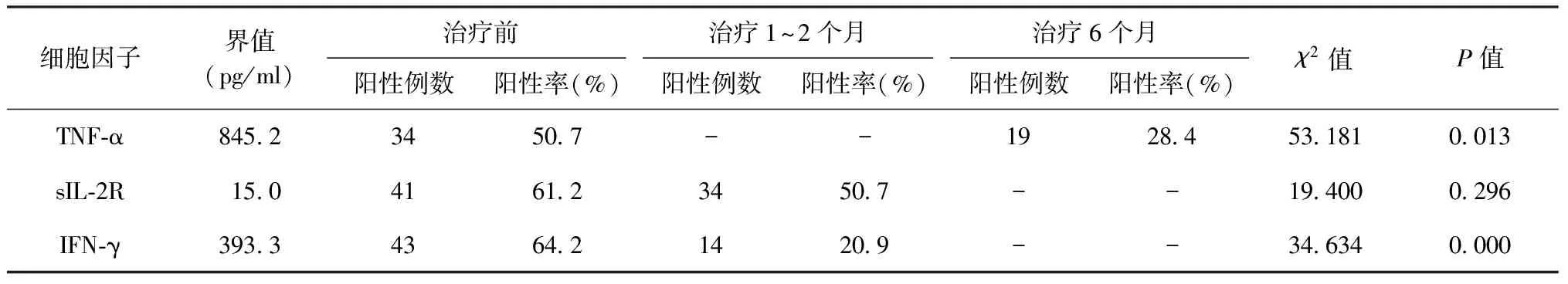
表2 67例患者以不同细胞因子最佳临界值为参照标准在不同时间的阳性率情况
三、各细胞因子在结核病治疗中的预测作用
以最佳临界值为参照标准,发现67例受试者中,治疗前血清IFN-γ和TNF-α水平高于其最佳临界值者(阳性者)分别有43例(64.2%)和34例(50.7%);治疗1~2个月后,血清IFN-γ水平阳性者为14例(20.9%),较治疗前明显降低(χ2=34.634,P=0.000);治疗6个月后,血清TNF-α水平阳性者为19例(28.4%),也较治疗前明显降低(χ2=53.181,P=0.013),见表2。
讨 论
结核分枝杆菌感染人体后的进展主要取决于结核分枝杆菌与宿主防御系统的对峙,此时宿主细胞免疫因子充当信使,在对抗病原体入侵过程中帮助整合免疫系统,其中细胞因子在结核病发病过程中受到宿主不同状态的影响,因此需要了解结核病患者治疗期间的免疫功能变化,以便为免疫学诊断、治疗和监测提供理论基础。本研究比较了血清细胞因子在宿主不同治疗阶段下的动态水平,并根据治疗时间进行分层分析。
Ⅰ型细胞因子是指由细胞产生的具有生物活性的蛋白类物质细胞因子的统称,尤其是TNF-α,在结核分枝杆菌感染过程中至关重要,也是疾病进展的主要参与者[7],高水平的TNF-α可能促进肉芽肿发展、感染和病灶进展[8]。既往研究发现,治疗后TNF-α水平的降低程度与结核病的良好预后密切相关[9],故检测其治疗前后水平的下降情况可以监测抗结核治疗的疗效[10-12],若显著降低则可能成为预测治疗效果的潜在生物标志物。进一步通过ROC曲线分析获得最佳临界值可作为生物标志物用于结核病治疗的评估手段[10]。本研究发现,本组患者治疗6个月后血清TNF-α水平显著降低(P=0.002),且AUC为0.594(P=0.013),提示血清TNF-α可能作为预测结核病治疗效果的标志物。
IL-4为调节性细胞因子,通过调节TNF-α活性等参与调控感染免疫反应。IL-4在结核病进展中的作用存在争议,部分研究认为结核分枝杆菌感染后产生的IL-4可能下调免疫反应,这种细胞因子的过度产生可能导致感染控制下调[13];且有部分研究发现伴有空洞患者的IL-4水平更高[14]。同时在其他研究中发现,IL-4可能促进结核病进展,或作为疾病活动的标志物发挥其被动作用[15]。但在对肺结核患者治疗前后的IL-4水平评估后,部分研究认为其水平变化无统计学意义,而部分研究认为治疗前后IL-4水平升高[16-17]。本研究虽然观察到治疗后血清IL-4水平有所降低,但比较不同治疗时间和进行ROC曲线分析后均未发现差异有统计学意义,故本研究结果不支持血清IL-4水平作为监测治疗效果的生物标志物。
细胞因子sIL-2R可在丝裂原或抗原激活T淋巴细胞培养上清中检测到,结核病患者sIL-2R水平升高表明T淋巴细胞活化程度较高,与疾病进程可能相关[18]。既往研究发现,血清sIL-2R水平变化可能与抗结核疗效相关,治疗后其水平显著降低[1,18]。本研究也观察到血清IL-2R水平治疗前与治疗后1~2个月的显著变化,但通过ROC曲线分析后,发现变化结果并不显著,故仍需更多临床研究以证明sIL-2R是否可作为监测结核分枝杆菌感染状态和治疗效果的生物标志物。
IFN-γ由活化的CD4+T淋巴细胞释放,是保护性抗结核免疫反应的关键成分。既往研究认为IFN-γ可用于监测抗结核治疗的效果,即有效的抗结核治疗后血清IFN-γ的水平是降低的[19-21],但也有部分研究认为成功治疗后的IFN-γ水平无显著变化,或者只有轻微变化[22-24]。本研究发现,对于最终获得治疗成功的患者,治疗1~2个月后血清IFN-γ较治疗前显著降低,据此推测血清IFN-γ水平可能可以作为监测抗结核治疗效果的生物标志物。
为了进一步验证获得的最佳临界值是否可以作为用药前后治疗效果的评价指标,本研究分别以获得的最佳临界值为参照标准,发现了部分具有阳性意义结果的截点,如治疗1~2个月的血清IFN-γ和治疗6个月的血清TNF-α高于界值的阳性者均较治疗前有明显降低,说明最佳临界值可以作为用药前后治疗效果的评价界值。
综上,本研究发现了血清TNF-α和IFN-γ水平在治疗过程中的动态变化差异,二者作为监测抗结核治疗的生物标志物可能具有一定意义,如从治疗前到整个治疗结束,TNF-α和IFN-γ水平在抗结核治疗初期下降后,在治疗后期均有不同程度的升高,这些不同的动态变化在其他研究中亦有观察到[25-27],这可能与患者处于不同的感染和治疗状态、检测细胞因子技术方法不同相关。同时,这些结果表明在治疗后期,包括IFN-γ在内的一些免疫因子和免疫功能可能会以某种方式恢复。但本研究也有其局限性:首先,本研究仅入组了67例患者,样本量较小,可能导致有统计学差异的因素未被发现;其次,因确诊肺结核患者无法设立不使用抗结核方案的对照组,故无法对抗结核方案干预与细胞因子水平进行因果关系分析,仅对血清TNF-α和IFN-γ水平动态变化进行相关性分析,以及对抗结核治疗效果进行可能的推测作用,未来还需要有更多的临床研究来验证其监测治疗过程的临床意义。
利益冲突所有作者均声明不存在利益冲突
作者贡献聂文娟和石文卉:负责酝酿和设计实验,实施研究,采集数据,分析解释数据,起草文章,对文章的知识性内容作批评性审阅,统计分析和获取研究经费;刘佩英、杨扬、王隽、王庆枫:负责实施研究,采集数据,分析解释数据和起草文章;初乃惠:负责酝酿和设计实验,对文章的知识性内容作批评性审阅,行政、技术或材料支持,指导和支持性贡献

