胸苷激酶1磁微粒化学发光检测方法的建立和性能评估
刘凤林,郭金双,2,柴 谦,杨 阳,孙秋艳
(1.山东省食品药品审评查验中心,山东 济南 250022;2.中国科学院福建物质结构研究所结构化学国家重点实验室,福建 福州 350002 ;3. 山东省菏泽市单县中心医院,山东 菏泽 274399)
胸苷激酶1(thymidine kinase 1, TK1)是细胞增殖周期中嘧啶补救合成途径的关键酶之一,是一种新的细胞增殖特异性标志物,可用于评估细胞分裂增殖周期,在肿瘤的早期筛查、肿瘤分期评估、治疗效果监测和预后评价中的作用日益受到关注[1-2]。TK1 水平检测在乳腺癌、肺癌、胃癌等恶性实体瘤监测方面的应用价值较高[3-4]。作为一种优选评估肿瘤细胞增殖速率的标志物,TK1 在健康人血清中的含量极微或检测不到,但其在恶性肿瘤患者体内会随着肿瘤细胞的急剧增殖而升高[5-7]。因此,建立一种高效灵敏、简便快捷的TK1 检测方法具有很重要的现实意义。
化 学 发 光 免 疫 分 析( Chemiluminescence immunoassay,CLIA) 是将化学发光技术与免疫分析方法相结合的一种新型分析方法,其具有高灵敏度、强特异性、操作简便快捷等优点,在多个检测领域得到了广泛应用[8-9]。目前,尚未有TK1 磁微粒化学发光检测方法的报道。本实验使用TK1 抗体-磁微粒偶联物结合并分离TK1 蛋白,TK1 配对抗体- 吖啶酯发光剂发光,建立了一种TK1 磁微粒化学发光检测方法,为TK1 的高灵敏度、强特异性、准确检测提供一种新的技术手段。
1 材料与方法
1.1 材料与仪器
羧基磁微粒(货号MS04C)购自南京瑞贝西生物科技有限公司;TK1 抗体对(CABT-16288MH&CABT-L869) 购 于 美 国Creative Diagnostics(CD)公司;重组人胸苷激酶1 抗原(8180-TK)购自美国R&D 公司;吖啶酯(货号A690047)购自生工生物工程(上海)有限公司;1- 乙基-(3- 二甲基氨基丙基)碳二亚胺盐酸盐(EDC,货号22980)、N- 羟基磺基琥珀酰亚胺(Sulfo-NHS)购自美国Sigma 公司。化学发光检测仪购自重庆科斯迈生物科技有限公司(型号:SMART500S)。发光底物(含激发液和预激发液,货号:6E23-82 和6C55-82)购自雅培公司。
1.2 抗TK1 包被抗体-磁微粒偶联物的制备
羧基磁微粒采用EDC/sulfo-NHS 方法活化,然后与抗TK1 抗体偶联。具体步骤为:将羧基磁微粒用磁微粒缓冲液(0.05 M 吗啉磺酸,pH 6.0)洗涤3 次(200 μL/ 次),加入等量的EDC 和sulfo-NHS,37℃条件下振荡活化25 min ;借助磁力架用磁微粒缓冲液洗涤2 次后(200 μL/ 次),加入抗TK1 抗体(用磁微粒缓冲液稀释至0.5 mg/mL),抗体与磁珠的质量比为1:10,室温振荡偶联5 h。用封闭缓冲液(0.05 M Tris、0.5% 酪 蛋 白、0.05% Triton X-100、0.5%Proclin300)于37℃封闭磁微粒1.5 h 后,用磁微粒缓 冲 液 洗 涤2 次(200 μL/ 次)。将TK1 抗 体- 磁微粒偶联物用磁微粒稀释液(0.05 M Tris、1% 氯化钠、2%BSA、4% 海藻糖、0.05% Triton X-100、0.5%Proclin300)稀释至0.5 mg/mL(抗体浓度),储存在4℃冰箱中。
1.3 抗TK1 标记抗体-吖啶酯发光剂的制备
选择TK1 配对抗体与吖啶酯偶联,制备TK1 配对抗体- 吖啶酯发光剂。具体步骤:按照3:1 的质量比,将TK1 配对抗体与吖啶酯混合,在37℃条件下振荡反应30 min,加入终浓度0.5% 赖氨酸终止反应。用0.1 M PBS 进行透析,以去除未结合的吖啶酯。经Sephadex G50 凝胶层析纯化后,收集具有高发光强度的产物。将纯化的TK1 配对抗体-吖啶酯发光剂用发光物稀释液(0.01 M PBS、1%氯化钠、0.5%酪蛋白、4%海藻糖、0.05% Triton X-100、0.5% Proclin300)稀释至0.05 mg/mL(抗体浓度),储存于4℃冰箱中备用。
1.4 磁微粒化学发光法检测步骤
取50 μL TK1 抗体-磁微粒(20 μg/mL),加入50 μL 的TK1 标准品或血清样本和100 μL TK1 配对抗体-吖啶酯发光剂,在37℃下温育反应20 min,用磁铁吸引磁微粒及其磁微粒偶联物至试管底部,使用洗涤缓冲液(PBS+0.05% Tween 20)轻轻洗涤试管以去除游离物质。然后分别加入100 μL 的发光底物,检测发光值。上述检测步骤均在化学发光检测仪中全自动化进行,无需人工操作,发光值与样本中的TK1浓度呈正相关。
1.5 方法学评价
1.5.1 标准曲线绘制 本研究设计的TK1 检测试剂盒溯源程序采用化学发光免疫分析法,目前TK1 暂无国家标准品,故校准品溯源到使用校准品稀释液(0.01 M PBS、2% 海藻糖、0.2% 酪蛋白、0.5% 组氨酸、0.5%Proclin300)稀释TK1 抗原,通过溯源到对比试剂盒(已获证发光试剂)一级校准品,偏差控制在±10% 以内。通过多次反复实验,标准曲线绘制为:制备重组TK1蛋白标准品的系列浓度(0 pmol/L、1.25 pmol/L、2.5 pmol/L、5 pmol/L、10 pmol/L、20 pmol/L、40 pmol/L),采用本方法检测各标曲浓度对应的发光光度值,绘制标准曲线。每个浓度测定3 个复孔,采用双对数数学模型(Log-Logit)进行标准曲线的拟合。
1.5.2 稀释线性检测 按照CLSI EP6-A2,将接近标曲线性范围上限的高值样本稀释不低于5 个梯度至接近该方法的线性下限,每个浓度重复测定三次。用最小二乘法将测定的结果和对应稀释比例进行线性拟合,并计算两者之间的相互关系,得出线性相关系数R。
1.5.3 灵敏度评估 根据CLSI EP17-A2,准备五份接近0 值的临床样本或健康人血清样本,用本研究的试剂进行检测,每个样本重复检测3 次,连续检测4 d,得到所有样本的发光均值和标准差;准备五份浓度范围在LoB 1 ~4 倍之间的血清样本,每天检测4 次,间隔超过2 h,每次检测重复进行3 次,共进行5 d ;依据EP17-A2 文件的方法和公式进行数据处理和分析,计算得到空白限(LoB)、检测限(LoD)、功能灵敏度(FS)。
1.5.4 准确度评估 根据EP09 文件对检测试剂的加标回收率进行评估,方法是:将已知浓度的TK1 蛋白标准品加入基质血清中,且加入的高值样本体积占比不超过总体积的10%,制备成加标浓度的血清样本,使用本方法重复检测3 次,计算高浓度样本、加标浓度样本和基质浓度样本这3 个样本的测定平均值、SD、变异系数(CV)、加标回收率,以评价该方法的准确度和重复性。根据公式〔加标回收率=(测定浓度-基质浓度)/ 加标浓度×100%)〕计算加标回收率。
1.5.5 精密度(重复性)评估 采用TK1 的试剂,按照CLSI EP05-A3,检测高、中、低三个浓度水平的TK1 校准品,不同浓度标本每天上午和下午各检测2次,每次检测重复进行2 次,两次检测的时间间隔不低于2 h,连续测定20 d,分别计算各浓度样本的分析内精密度、分析间精密度及总不精密度。
1.6 干扰实验
本次评估采用了三种常见的血清干扰物质,分别是血红蛋白、甘油三酯和胆红素,将一定浓度的干扰物分别加入高浓度TK1 和低浓度TK1 的血清待测样本中,设为干扰物质样本,加入的干扰物的体积不超过总体积的5%,对照组同时添加相同体积的PBS 作为对照样本,然后对两组样本分别进行测试,每个浓度检测3 次,并根据公式〔干扰率=(干扰物质样本的测定浓度- 对照组样本的测定浓度)/ 对照组样本的测定浓度×100%〕计算得到干扰率。
1.7 特异性评估
用本方法同时检测TK1 标准品(30 pmol/L)、人血清白蛋白(100 ng/mL)、纤维蛋白原(100 ng/mL)、癌胚抗原(CEA)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),以评估本方法的特异性。上述几个蛋白均为人血清中常见的蛋白。
1.8 稳定性评估
将制备的试剂盒置于37℃下7 d,进行加速稳定性试验。观察试剂盒的物理外观,对其检测灵敏度、准确度、重复性、特异性等指标进行测定,以评估该检测方法的稳定性。灵敏度、准确度、重复性、特异性检测方法同上。
1.9 统计学方法
采用SPSS 17.0 统计软件进行数据分析。结果以mean±SD 表示,采用GraphPad Prism 5 软件计算标准曲线方程。
2 结果
2.1 方法建立的条件优化
采用单因素测试及多因素交叉测试筛选得到了最优的抗体对、重组抗原、磁珠与抗体最优标记比例、吖啶酯与抗体最优标记比例、基础缓冲液、校准品、反应体系以及筛选不同需求对应的血清样本。反复优化及验证得到的反应体系是:样本上样量50 μL,磁珠标记抗体上样量50 μL,吖啶酯标记抗体上样量100 μL;反应步骤为一步法,反应时间为20 min;相应最优缓冲液配方为:磁微粒稀释液:0.05 M Tris、1% 氯化钠、2%BSA、4% 海藻糖、0.05% Triton X-100、0.5%Proclin300 ;发光物稀释液:0.01 M PBS、1% 氯化钠、0.5% 酪蛋白、4% 海藻糖、0.05% Triton X-100、0.5% Proclin300 ;校准品或质控品稀释液:0.01 M PBS、2% 海藻糖、0.2% 酪蛋白、0.5% 组氨酸、0.5%Proclin300。
2.2 方法学性能评估
2.2.1 标准曲线 以TK1 标准品系列浓度的Log10 值为横坐标,其对应的化学发光值的Log10 值为纵坐标,建立四参数拟合数学模型,其拟合的标准曲线方程为:Y=(6.77662-3.45135)/ ﹝ 1+(X/1.63798)(-1.37946)﹞ +3.45135,R=0.99869,如图1 所示。TK1 浓度在1.25 ~40 pmol/L 范围内时,本检测方法具有良好的剂量-反应效应。

图1 TK1 的标准曲线
2.2.2 线性范围评估 将45 pmol/L(接近线性上限)浓度水平的血清样本逐级稀释至接近线性下限的浓度1.4 pmol/L,对所得三次结果取均值,并与理论值以最小二乘法进行线性拟合,得出对应的线性相关系数R(如表1 结果所示)。在1.5 ~45 pmol/L 范围内,得出相关系数R 为0.997(不低于0.9900),故本研究建立的方法设定的线性范围1.25 ~40 pmol/L 是符合要求的。
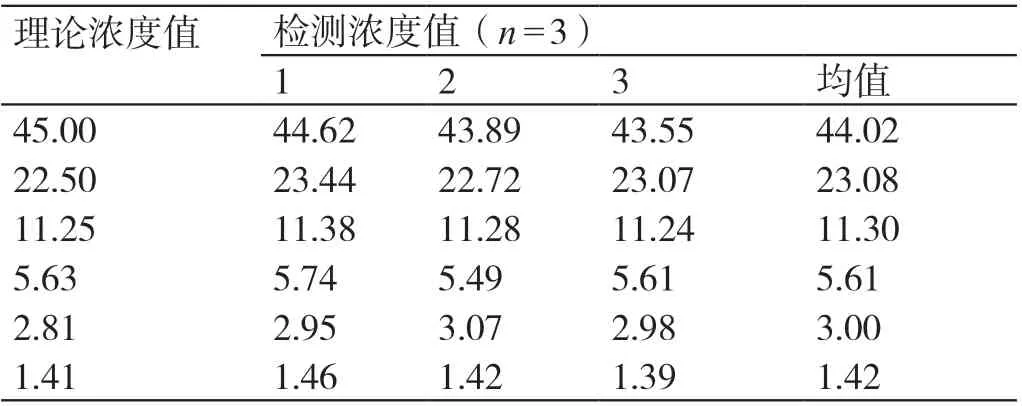
表1 TK1 稀释线性检测数据(pmol/L)
2.2.3 灵敏度评估 依据CLSI EP17-A2 的要求,本方法的灵敏度测试评估的结果为:LOB 0.70 pmol/L;LOD 1.02 pmol/L;FS 1.50 pmol/L。
2.2.4 准确度评估 在线性范围内,选择高、中、低5个浓度系列的血清样本,用较低含量的阴性血清作为基质浓度,按照比例1:9 进行稀释,制备成加标回收样品,回收率在90% ~110% 视为符合要求。如表2所示,五个浓度覆盖从低到高的浓度,数据显示:加标回收率在99.24%~106.91%之间,均在10%以内,说明该TK1 磁微粒化学发光法检测血清样本中TK1的浓度具有较高的准确度。
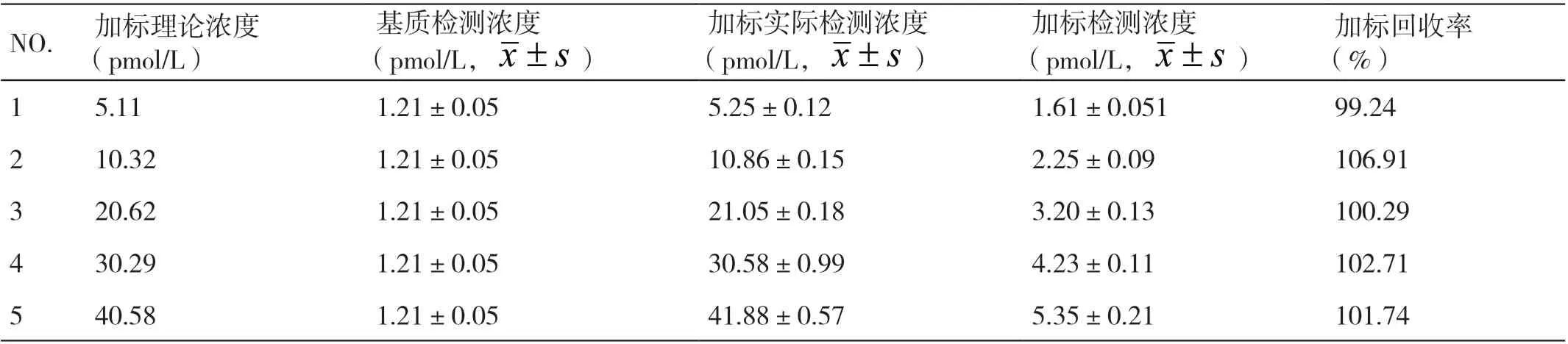
表2 TK1 磁微粒化学发光检测试剂加标回收率检测结果
2.2.5 精密度评估 根据CLSI EP05-A3 文件,对高浓度水平、中浓度水平和低浓度水平的三个标本的各80份检测数据进行分析(结果如表3 所示)。三个浓度水平的分析内精密度在1.02% ~2.82% 范围内,分析间精密度在3.12% ~5.35% 范围内,总不精密度在6.30% ~8.12% 范围内。可见,分析内和分析间精密度均低于6%,总不精密度低于9%。

表3 TK1 磁微粒化学发光试剂精密度测试结果分析
2.3 干扰实验
分别将不同浓度的胆红素、甘油三酯、血红蛋白加入2 份待测标本中作为干扰标本,同时以添加相同体积的体系缓冲液作为基础标本,根据公式计算得到干扰率,根据表4 的结果分析可以看出,三种干扰物质(胆红素、甘油三酯和血红蛋白)在不同浓度情况下对高浓度TK1 水平和低浓度TK1 水平两份样本影响效果不一致,胆红素、甘油三酯、血红蛋白浓度分别不高于30 Umol/L、1.5 mmol/L、2.5 g/L 时,各浓度干扰率均不超过10%,即干扰物在上述三个浓度的情况下,未见明显干扰。
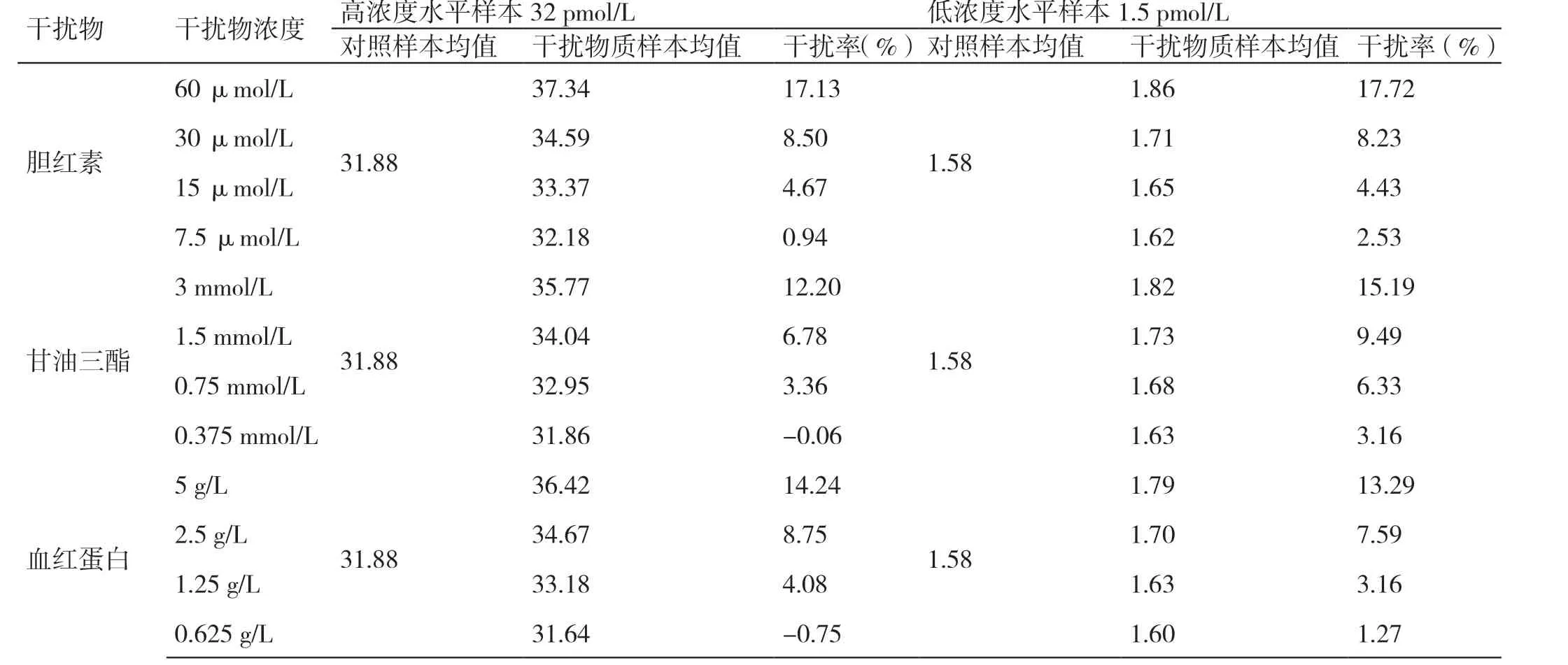
表4 干扰试剂对TK1 磁微粒化学发光试剂检测影响的测试结果
2.4 特异性实验
用本方法制备的试剂盒重复检测30 pmol/L TK1 标准品3 次,得到的平均浓度为31.54 pmol/L;人血清白蛋白、纤维蛋白原、CEA、IL-6 和TNF-α 的检测值分别为1.49 pmol/L、1.31 pmol/L、1.20 pmol/L,1.45 pmol/L和1.14 pmol/L,交叉反应率均不大于2%,如表5 所示,表明该检测方法对TK1 检测的特异性较好。
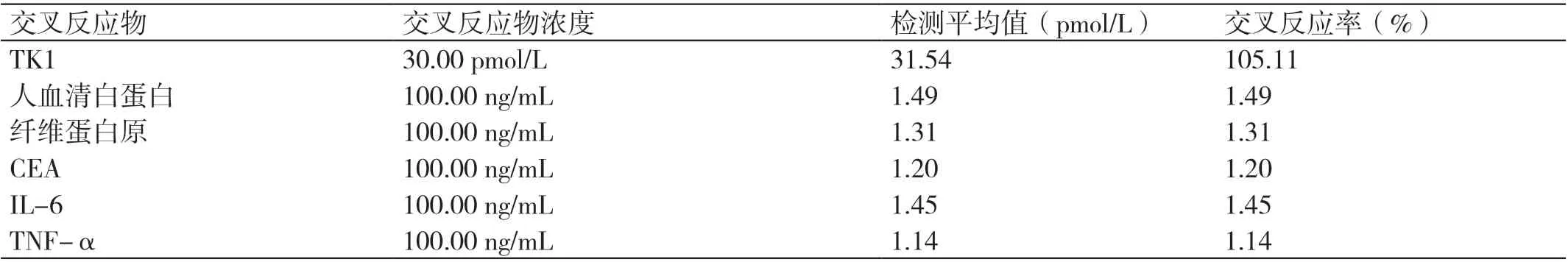
表5 特异性实验结果
2.5 稳定性实验
将本方法制备的试剂盒置于37 ℃下7 d,进行加速热稳定性实验。7 d 后,使用TK1 标准品、基质血清等进行灵敏度、准确度、重复性和特异性等检测,灵敏度、加标回收率、批内CV、批间CV 和交叉反应率均未有显著性改变,表明该方法制备的试剂盒稳定性较好,可长期保存使用。
3 讨论
化学发光作为一种检测技术经历了不断的演变。传统的化学发光免疫分析方法虽然能够满足一般需求,但是对于基质复杂或浓度极低的样本,存在着特异性不足、背景干扰、检测灵敏度不够等问题。因此,降低背景干扰值、提高检测灵敏度和特异性一直是众多实验室研究的重点[10]。近几年,基于磁性微粒子及金纳米粒子的化学发光免疫分析的研究越来越多,在快速分离与高灵敏度上有了很大的突破[11-12]。本方法选择磁微粒作为反应载体,实现了降低背景干扰、增强检测灵敏度的目的。本TK1 化学发光免疫反应的原理:将TK1 抗体偶联在磁微粒表面,在待测抗原与固定在磁微粒表面上的抗体发生免疫反应后,在外加磁场的作用下免疫复合物被分离出来,然后加入发光底物TK1 配对抗体- 吖啶脂发光剂,通过检测发光信号强弱来计算TK1 的浓度。磁微粒化学发光检测方法已有文献报告。郑国金等[13]建立了一种管式磁性微粒子化学发光免疫分析法测定人尿液中的雌三醇的方法,该方法具有很高的灵敏度、稳定性和重现性。叶春蕾等[14]建立了一种基于微粒子化学发光免疫分析的人血清脂联素检测方法。多种磁微粒化学发光检测方法的建立,说明了此方法在基质复杂的血清样本检测中具有明显优势,发展前景较好。
TK1 是细胞增殖周期依赖性标志物,定位于染色体17q23.2 q25 上,其活性在G1/S 期增加,在S 期/G2 期达到峰值,在G2/ 有丝分裂期开始下降,在处于非有丝分裂期的细胞中几乎不存在[1,15]。在过度无序增殖的恶性肿瘤细胞中,TK1 水平极高并大量释放到血液中。因此,组织或血清中TK1 的活性或含量可直观地反映细胞的增殖水平。研究发现,TK1 在血液中比较稳定,在-20℃以下环境中可稳定保存5 年以上,检测血清中TK1 活性/ 含量可准确地反映其在细胞中的真实水平[16-18]。TK1 临床检测的演变经历了一个复杂的过程。上世纪80 年代,血清TK1 活性检测方法被建立,主要用于白血病、霍奇金/ 非霍奇金淋巴瘤的治疗评价和预后监测。但有研究发现,TK1 活性检测并不适用于实体瘤患者的监测评估,仅对血液系统肿瘤的评估效果较好[19]。后来,血清TK1 水平的检测得到了医学界的关注。有研究发现,不仅在血液系统肿瘤(白血病、淋巴癌等)的评估中,在实体瘤如乳腺癌、胃癌、肺癌等监测评估方面,TK1 水平检测均明显优于其活性的检测,这个现象的发现大大促进了血清TK1 水平检测的发展,提高了TK1 检测方法研究的热度[3,4,20]。目前,免疫印迹增强化学发光法广泛应用于临床血清TK1 水平的测定,其具有高灵敏度、高特异性等优势。随着磁微粒化学发光法在临床血清样本检测中获得广泛认可,将这种新型的检测技术应用于血清TK1 水平的检测中引起了本文研究者的兴趣。
本研究建立了一种管式磁性微粒子化学发光免疫分析法,用来测定人血清中TK1 的水平,通过分别制备TK1 抗体- 磁微粒偶联物和TK1 配对抗体- 吖啶脂偶联物,建立了定量检测TK1 的新方法。该方法对血清中TK1 的检测灵敏度为:LOB 0.70 pmol/L;LOD 1.02 pmol/L;FS 1.50 pmol/L,线性范围为1.25 ~40 pmol/L,可以满足临床样本中对TK1 的定量检测需要,无须稀释;加标回收率为99.24% ~106.91%,在-10% ~10% 范围内,符合要求;方法精密度:分析内精密度为1.02% ~2.82%,分析间精密度为3.12% ~5.35%,总不精密度为6.30% ~8.12%,分析内和分析间精密度均低于6%,总不精密度低于9%。样本中三种干扰物在胆红素、甘油三酯、血红蛋白浓度 分 别 不 高 于30 Umol/L、1.5 mmol/L、2.5 g/L 时,干扰率均低于10%,未见明显干扰,基本不影响检测结果。该检测方法的特异性较好(与血清中常见蛋白的交叉反应率均低于2%),试剂在37℃下可稳定保存7 d 以上(等同于4℃下可稳定保存12 个月以上)。对该检测试剂的灵敏度、准确度、重复性、特异性、稳定性等性能进行评价可知,其可满足临床对血清TK1 水平检测的需求。
综上所述,TK1 磁微粒化学发光检测作为一种全自动快速的检测方法,具有高灵敏度、高准确度、高精密度、强特异性、强稳定性等优点,可为临床TK1水平的检测提供一种新的技术手段,在恶性肿瘤的早期诊断、疗效评估以及预后监控等方面可发挥重要的作用。

