Kaiser评分与ADC值对乳腺BI-RADS 4类病变的诊断效能评价
乳腺癌是女性最常见的恶性肿瘤,MRI是鉴别乳腺内良恶性病变的重要影像学检查方法,敏感性很高
。扩散加权成像(diffusion-weighted imaging, DWI)及其定量参数表观扩散系数(apparent diffusion coefficient, ADC)值可应用于乳腺病变良恶性的评估,已有研究表明恶性病变的ADC值显著低于良性病变
,可以避免不必要的临床干预
。目前DWI与动态对比增强(dynamic contrast enhanced, DCE)两种MRI 检查序列联合应用可对乳腺癌进行影像学诊断
,然而对于恶性概率跨度极大的乳腺影像报告和数据系统(Breast Imaging-Reporting and Data System, BI-RADS)4类病变的诊断价值有限,BI-RADS 4类病变的恶性概率为2%~95%
,这预示部分良性病灶将被误诊为恶性病灶而接受不必要的手术,增加了患者的心理和经济负担。作为一种临床决策依据,纳入五种影像特征的Kaiser评分在评估乳腺病变方面具有极佳的敏感性和特异性
,分值从1到11,相关文献认为评分≥4建议进行活检
。本研究的目的是比较Kaiser评分与ADC 值对BI-RADS 4 类病变的诊断效能,并获取Kaiser评分诊断良恶性的截断值,以减少不必要的有创活检。
1 材料与方法
1.1 一般资料
回顾性分析2020 年6 月至2022 年2 月于河北省人民医院行术前乳腺3.0 T MRI 平扫及动态对比增强检查的女性患者病例共128 例,年龄9~83(47±13)岁。纳入标准:诊断报告为BI-RADS 4 类的强化病灶;影像资料及病理结果完善、清晰。排除标准:MRI 检查前行乳腺穿刺、手术或放化疗。本研究经河北省人民医院伦理委员会批准,免除受试者知情同意,批准文号:2022082。
1.2 设备及参数
所有病例MRI扫描采用美国GE 3.0 T MRI仪,使用16通道乳腺表面相控阵线圈,取俯卧位,扫描范围包括双侧乳腺及腋窝。轴位快速自旋回波T2WI脂肪抑制成像序列扫描参数:TR 7061 ms,TE 104.3 ms,层厚5 mm,层间距5 mm,FOV 350×350;轴位T1WI 序列扫描参数:TR 420 ms,TE 7.6 ms,层厚5 mm,层间距5 mm,FOV 350×350;DWI 序列扫描参数:TR 5113 ms,TE 66.6 ms,层厚5 mm,层间距5 mm,FOV 350 mm×210 mm,b 值 取1000 s/mm
;DCE-MRI 扫 描 参 数:TR 5.7 ms,TE 1.8 ms,层厚1.6 mm,层间距0,FOV 350 mm×350 mm,共采集7 期图像,对比剂为钆喷酸葡胺,剂量0.2 mmol/kg,流速2 mL/s,注射后用20 mL生理盐水以3 mL/s的速度自动冲洗注射器。
尼康Coolpix W300的画质表现相比富士更加优秀,但是在细节表现力上还是不如奥林巴斯和理光。W300配备了等效焦距为24-120mm,非常实用,镜头还拥有光学防抖功能,可以弥补弱光拍摄时的劣势。
1.3 图像处理与分析
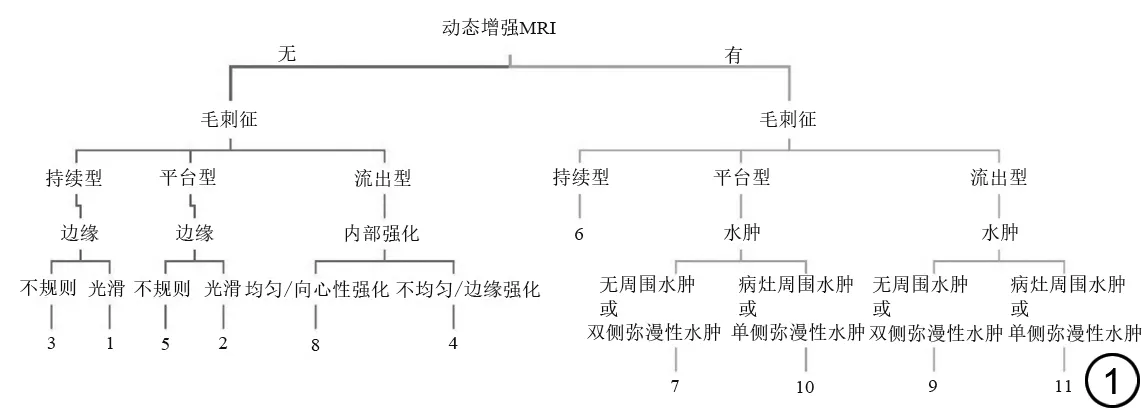
由两位高年资乳腺诊断医师(诊断医师1为工作经验30年的主任医师;诊断医师2为工作经验15年的副主任医师)根据Kaiser 评分系统解读所有检查结果,出现分歧时协商达成一致。该评分系统包括5个独立的诊断标准,即毛刺征、时间-信号强度曲线(time-signal intensity curve, TIC)类型、病变边缘、内部强化模式及瘤周水肿。两位诊断医师均不知道病理结果和BI-RADS 分级,计算并记录每个病变的最终Kaiser 评分。Kaiser 评分系统的流程图如图1所示。
1.3.2 疼痛程度 采用疼痛数字评分法(NRS)评估患者术后6 h、术后第1天、术后第2天、术后第3天的疼痛程度。NRS 是用数字式0~10代替文字来表示疼痛的程度,0 为无疼痛;1~3分为轻度疼痛,不影响患者夜间睡眠;4 ~6为中度疼痛,轻度影响患者夜间睡眠;7~10为重度疼痛,患者不能入睡或者睡眠中痛醒。
1.4 统计学分析
从图3可以看出,对任何一种弹-靶组合,随着弹丸速度的增加,坑深Ic与坑径dc之比最终都会趋近于0.5的渐近值,即形成半球形的弹坑。
2 结果
2.1 临床资料
本研究采用随机对照研究中的配对设计方法评估了Kaiser 评分、ADC 值和两者联合在乳腺BI-RADS 4 类病变诊断中的效能,结果显示在乳腺BI-RADS 4 类病变中,Kiser 评分诊断效能高于ADC 值,可以减少临床不必要的活检,联合应用Kaiser 评分和ADC值并不能显著提高诊断效能。本研究为国内首次在BI-RADS 4 类病变中同时应用Kaiser 评分和ADC 值,并对两者的诊断效能做出比较。
所有MRI原始数据传到AW 4.2后处理工作站,应用Functool 软件进行后处理,感兴趣区(region of interest, ROI)包括病灶的实性区域,避开坏死、囊变或出血的区域,避开纤维腺体及血管,测量每个ROI的ADC值及TIC,重复测量两次,以平均值作为最终数据。测量ADC 值时,于DWI 序列上病变明显高信号处勾画ROI。动态对比增强扫描采用乳腺容积成像即VIBRANT技术,第一期为蒙片,在第二或三期病变早期明显强化时勾画ROI 测量TIC。背景实质增强(background parenchymal enhancement, BPE)即乳腺MRI 图像上正常实质的强化,由两位高年资医生(诊断医师1为工作经验30年的主任医师;诊断医师2为工作经验15年的副主任医师)依据DCE-MRI 图像按照BI-RADS 系统分为4类:少量、轻度、中度、重度,分别代表<25%、25%~50%、51%~75%、>75%的腺体组织强化。
2.2 Kaiser评分与ADC值诊断效能分析
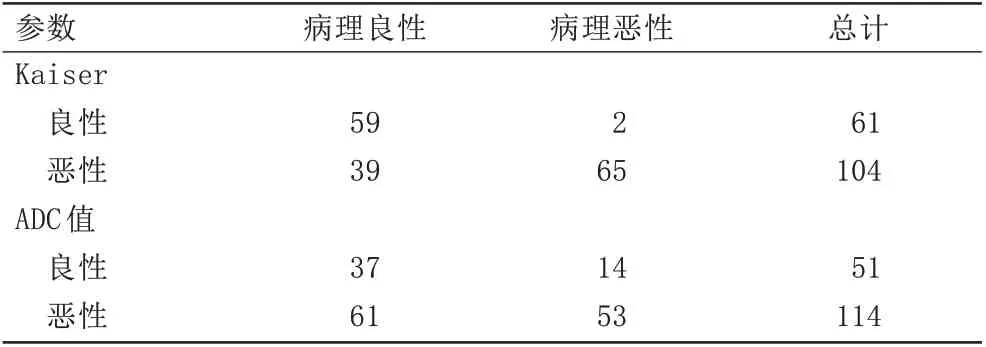
Kaiser 评分与ADC 值诊断结果见表1。恶性病变的Kaiser 评分高于良性病变,ADC 值低于良性病变,差异具有统计学意义(
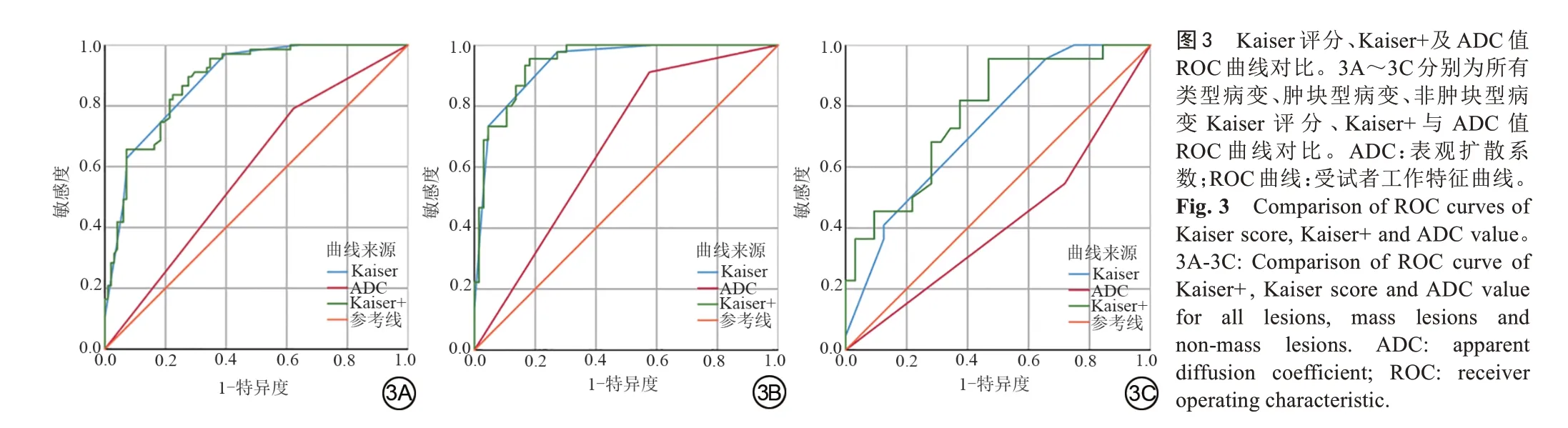
<0.05),结果见表2。对于所有病变、肿块型强化病变,Kaiser 评分的AUC 均高于ADC值的AUC,差异具有统计学意义(
<0.001),但在非肿块病变中,差异无统计学意义(
=0.152)。Kaiser评分+的AUC在所有病变、肿块及非肿块型强化病变中均高于ADC值的AUC,差异具有统计学意义(
<0.05)。在所有病变、肿块及非肿块型强化病变中,Kaiser 评分与Kaiser 评分+AUC 比较,差异均不具有统计学意义,结果见表3、图3。依据BI-RADS 系统将BPE分为4类,比较Kaiser、Kaiser+与ADC值的AUC,结果见图4、表3。在BPE 1~4类乳腺中,Kaiser评分的AUC 均高于ADC 值的AUC,这表明Kaiser 评分在诊断BI-RADS 4类病变时不受BPE影响。

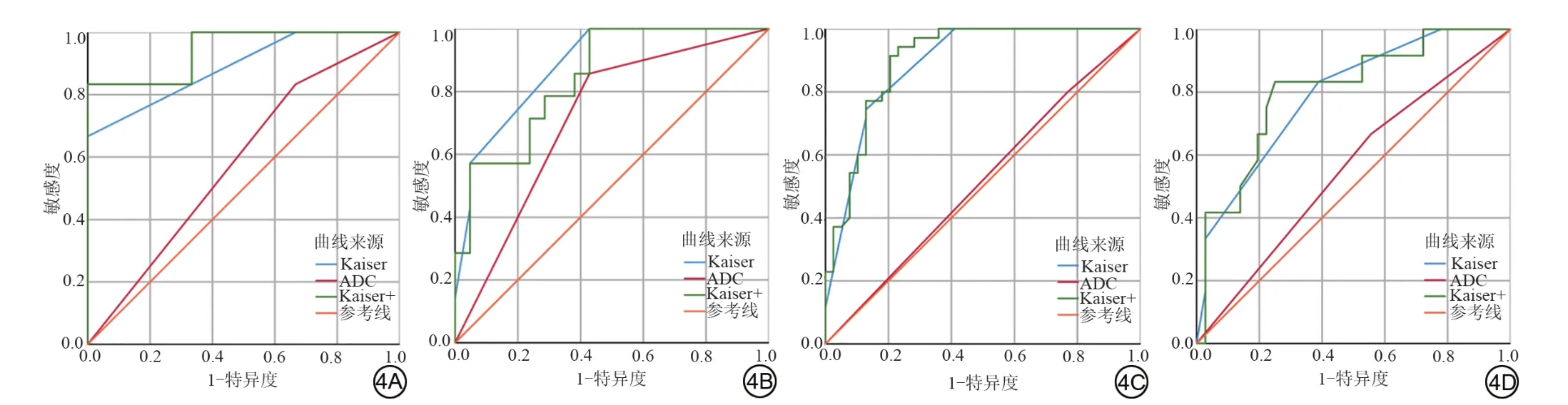

2.3 Kaiser 评分与ADC 值准确度、敏感度、特异度比较
Kaiser评分是Baltzer等
提出的一种病变分类算法,基于常规T2WI 压脂序列及DCE-MRI 序列,应用了五个独立的形态学及动态增强相关的特征,范围从1到11,提供了病变的恶性可能性,分数≤4时可以在很大程度上排除恶性,评分高则需要活检,评分结果不受设备参数及增强扫描期相影响
,易于推广。相对于BI-RADS系统仅做到使诊断报告标准化,Kaiser评分可以作为诊断依据辅助评估病变良恶性。Kaiser评分的诊断标准符合BI-RADS
,观察者间一致性良好,即使不同观察者的个人评分不同,但最终是否需要活检的最终结果是一致的,且重复性高
。Kaiser评分敏感性高,在高危女性中,采用4 作为病变的阈值可以避免超过45% BI-RADS 4 类的病灶进行不必要的活检
,并且可以对X 线表现为可疑恶性的钙化进行风险分层,降低58.3%~65.3%不必要的定向活检
。Rong 等
得出结论,对比增强乳腺X 线摄影技术与Kaiser 评分结合有助于诊断BI-RADS 4A 类病变,可以避免75.8%~82.1%不必要的良性乳腺病变活检。王珊等
的研究表明,Kaiser评分对BI-RADS 4类非肿块样强化病变具有较高的敏感性和准确性,与本研究结果一致。对于BI-RADS 3-5 类病变中性质不明确的病灶,Kaiser 评分也可以辅助诊断,提高诊断准确性,避免45.2%~60.8%的活检
。
3 讨论
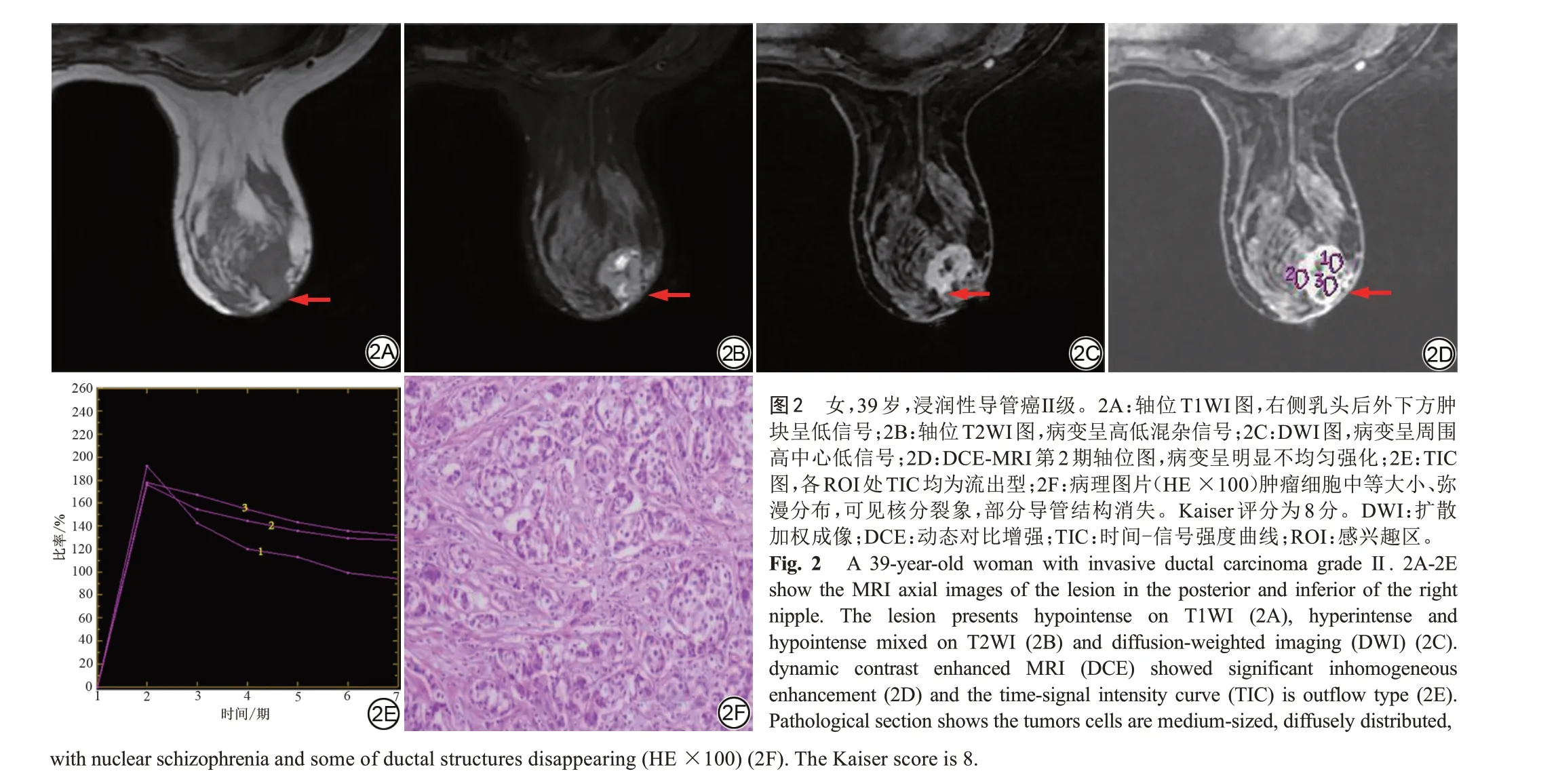
128 例患者病例共165 个病灶,其中肿块样病灶111 个,非肿块样病灶54 个;恶性67 个,良性98 个。恶性病灶中,浸润性导管癌27 个,导管原位癌17 个,导管内乳头状癌5 个,导管原位癌伴浸润性导管癌8 个,浸润性小叶癌4 个,包裹性乳头状癌1 个,浸润性筛状癌1 个,浸润性癌伴黏液分化1 个,黏液癌2 个,浸润性微乳头状癌1 个;良性病灶中,纤维腺瘤37 个,导管内乳头状瘤25 个,腺病17 个,肉芽肿性乳腺炎7 个,炎症4 个,硬化性腺病4 个,良性叶状肿瘤3个,良性肌上皮瘤1个。典型病例见图2。
3.1 DWI在乳腺病变诊断中的应用
本研究结果显示,Kaiser评分对于BI-RADS 4类病变的诊断效能高于ADC 值,而且Kaiser 评分不受BPE 影响,在每个亚组均表现出良好的鉴别能力。研究证实
,中重度BPE的女性患者DCE-MRI的敏感度低于轻微及轻度BPE的女性,高BPE可能会导致假阳性或假阴性
,且高BPE可能是乳腺癌的独立危险因素
。Kaiser 评分与ADC 值两者的结合较单独Kaiser 评分诊断效能并未见显著提高。当Kaiser评分<3时,对BI-RADS 4 类病变的诊断未出现假阴性结果;当Kaiser 评分>9 时,对BI-RADS 4 类病变的诊断未出现假阳性结果。当评分取截断值4 时,敏感度、特异度、阳性预测值、阴性预测值分别为97.0%、60.2%、62.5%、96.7%。对于肿块、非肿块强化病变,Kaiser评分诊断效能均高于ADC值,但诊断非强化病变的特异性较其他研究低
,这可能是由于本研究中非肿块病变较少,且多数为良性。Kaiser评分诊断的2例假阴性均为非肿块强化,均为导管原位癌,在评估Kaiser 评分时TIC 为流出型,被评价为4 分,这是因为导管原位癌病灶区域基底膜周围有多少不等的新生血管,所以TIC形式多样,其中平台型最常见,且在导管原位癌诊断中TIC类型差异无统计学意义
。
3.2 Kaiser评分在乳腺病变诊断中的应用
对于所有病变,Kaiser评分与ADC值诊断一致性较差(Kappa=0.192,95%
:0.039~0.345,
=0.013),Kaiser评分的准确度(124/165,75%)高于ADC值的准确度(90/165,55%),但差异无统计学意义(
>0.05)。Kaiser 评分的敏感度(65/67,97.0%)、特异度(59/98,60.2%)均高于ADC值的敏感度(53/67,79.1%)、特异度(37/98,37.8%),差异具有统计学意义(
<0.001)。根据ROC 曲线确定约登指数,确定Kaiser 评分评估BI-RADS 4类病变良恶性的截断值为4,截断值对应的敏感度为97.0%(65/67),特异度为60.2%(59/98),阳性预测值为62.5%(65/104),阴性预测值为96.7%(59/61)。对于所有病变应用Kaiser评分可以减少不必要的活检。
数据分析采用SPSS 25.0 及MedCalc 20.0(Medcalc Software)软件处理,服从正态分布的计量资料以(
ˉ±
)表示,组间比较采用独立样本
检验,应用配对卡方检验比较敏感度、特异度,采用Kappa值评价两种方法是否具有一致性。使用logistic回归联合Kaiser评分与ADC值作为一个新的预测指标Kaiser+。诊断效能采用受试者工作特征(receiver operating characteristic, ROC)曲线评估,应用准确度、敏感度、特异度、阳性预测值和阴性预测值评估诊断价值,应用DeLong检验比较曲线下面积(area under the curve, AUC),
<0.05为差异有统计学意义。
3.3 Kaiser 评分、ADC 值及两者联合在BI-RADS 4 类病变诊断效能分析
DWI 是一种功能MRI 技术,被广泛应用于评估乳腺病变,可以提高MRI的诊断准确性
,在临床上可以通过其定量参数ADC 值评估组织中水分子的扩散程度
。在恶性病变中,由于肿瘤细胞增殖、细胞外空间受压,扩散受限,导致DWI 信号增高,相应的ADC值降低。作为一种定量诊断工具,ADC 值在初步评估乳腺病变良恶性方面表现良好,但ADC值容易受到病变成分及扫描参数的影响,并且对于那些表现为T2WI或DWI等信号、非肿块强化或存在广泛坏死的病变,测量其数值困难,导致其诊断效能下降,易出现假阴性结果;另外,某些病变如黏液癌,表现为ADC值升高,与良性病变相似,单独依靠ADC值容易误诊
。
3.4 不足与展望
本研究有一定的局限性:第一,由于乳腺病变早期筛查的普及,Kaiser 评分为10、11 分的病变较少,且由于选择偏倚导致本研究BI-RADS 4 类病变恶性率(40.6%)高于文献报道
,阳性预测值会偏高,后续研究中将严格掌握研究对象的纳入与排除标准,增加样本量。第二,在测量ADC值时没有评估病灶的大小,病灶较小会导致ADC 值测量不准确,最近的研究证实Kaiser 评分可以用来评估小于5 mm 的病灶
,这可能影响结果,后续研究可以将病灶按照大小进行分层分析。第三,在二维图像上勾画ROI忽略了病变异质性的影响,这可以通过使用ITK-SNAP 软件进一步勾画三维容积ROI尽量避免。
在农业食品系统的演变下,拉美地区经历了超市迅速崛起、跨国化和巩固整合。与20世纪90年代初的低市场占有率相反,如今超市已越来越多地占据拉美国家的农业食品经济,引起了供应链的深刻转换。
综上所述,Kaiser评分对于BI-RADS 4类病变的诊断效能高于ADC 值,有望降低不必要的穿刺活检率。与单纯的Kaiser 评分相比,联合应用Kaiser 评分和ADC 值不能显著提高BI-RADS 4 类病变的诊断效能。
妈妈的玩法对我有极大的吸引力。我缠着问:“你还会玩什么?”妈妈指着楼下的柳林说:“你看,随处都可以玩:吹柳笛、吹柳哨、做弹弓、编柳帽……”
全体作者均声明无利益冲突。
[1] Leithner D, Wengert G, Helbich T, et al. MRI in the assessment of BI-RADS
4 lesions[J]. Top Magn Reson Imaging, 2017, 26(5):191-199.DOI:10.1097/RMR.0000000000000138.
[2] Bickel H, Pinker K, Polanec S, et al. Diffusion-weighted imaging of breast lesions: region-of-interest placement and different ADC parameters influence apparent diffusion coefficient values[J]. Eur Radiol,2017,27(5):1883-1892.DOI:10.1007/s00330-016-4564-3.
[3] Clauser P, Krug B, Bickel H, et al. Diffusion-weighted imaging allows for downgrading MR BI-RADS 4 lesions in contrast-enhanced MRI of the breast to avoid unnecessary biopsy[J]. Clin Cancer Res, 2021,27(7):1941-1948.DOI:10.1158/1078-0432.CCR-20-3037.
[4] Zhang M, Horvat JV, Bernard-Davila B, et al. Multiparametric MRI model with dynamic contrast-enhanced and diffusion-weighted imaging enables breast cancer diagnosis with high accuracy[J]. J Magn Reson Imaging,2019,49(3):864-874.DOI:10.1002/jmri.26285.
[5] Strigel RM,Burnside ES,Elezaby M,et al.Utility of BI-RADS assessment category 4 subdivisions for screening breast MRI[J].AJR Am J Roentgenol,2017,208(6):1392-1399.DOI:10.2214/AJR.16.16730.
[6] An YY, Liu C, Zhang HX, et al. Diagnostic value of Kaiser score for BI-RADS 4 lesions on MRI[J]. Zhejiang Med J, 2021, 43(5): 511-515.DOI:10.12056/j.issn.1006-2785.2021.43.5.2020-3139.安永玉,刘畅,张宏霞,等.Kaiser 评分对MRI 乳腺影像报告与数据系统4 类病灶的诊断价值[J]. 浙江医学, 2021, 43(5): 511-515. DOI:10.12056/j.issn.1006-2785.2021.43.5.2020-3139.
[7] Grippo C, Jagmohan P, Helbich TH, et al. Correct determination of the enhancement curve is critical to ensure accurate diagnosis using the Kaiser score as a clinical decision rule for breast MRI[J/OL]. Eur J Radiol, 2021 [2022-05-30]. https://doi.org/10.1016/j.ejrad.2021.109630.DOI:10.1016/j.ejrad.2021.109630.
[8] Wengert GJ,Pipan F,Almohanna J,et al.Impact of the Kaiser score on clinical decision-making in BI-RADS 4 mammographic calcifications examined with breast MRI[J]. Eur Radiol, 2020, 30(3): 1451-1459.DOI:10.1007/s00330-019-06444-w.
[9] Milos RI, Pipan F, Kalovidouri A, et al. The Kaiser score reliably excludes malignancy in benign contrast-enhancing lesions classified as BI-RADS 4 on breast MRI high-risk screening exams[J]. Eur Radiol,2020,30(11):6052-6061.DOI:10.1007/s00330-020-06945-z.
[10] Iima M, Honda M, Sigmund EE, et al. Diffusion MRI of the breast:current status and future directions[J]. J Magn Reson Imaging, 2020,52(1):70-90.DOI:10.1002/jmri.26908.
[11] Dijkstra H,Dorrius MD,Wielema M,et al.Quantitative DWI implemented after DCE-MRI yields increased specificity for BI-RADS 3 and 4 breast lesions[J]. J Magn Reson Imaging, 2016, 44(6): 1642-1649. DOI:10.1002/jmri.25331.
[12] Istomin A, Masarwah A, Okuma H, et al. A multiparametric classification system for lesions detected by breast magnetic resonance imaging[J/OL]. Eur J Radiol, 2020 [2022-05-30]. https://doi.org/10.1016/j.ejrad.2020.109322.DOI:10.1016/j.ejrad.2020.109322.
[13] Bitencourt AG, Graziano L, Osório CA, et al. MRI features of mucinous cancer of the breast: correlation with pathologic findings and other imaging methods[J]. AJR Am J Roentgenol, 2016, 206(2):238-246.DOI:10.2214/AJR.15.14851.
[14] Baltzer PAT, Dietzel M, Kaiser WA.A simple and robust classification tree for differentiation between benign and malignant lesions in MR-mammography[J]. Eur Radiol, 2013, 23(8): 2051-2060. DOI:10.1007/s00330-013-2804-3.
[15] Woitek R, Spick C, Schernthaner M, et al. A simple classification system (the Tree flowchart) for breast MRI can reduce the number of unnecessary biopsies in MRI-only lesions[J]. Eur Radiol, 2017, 27(9):3799-3809.DOI:10.1007/s00330-017-4755-6.
[16] Baltzer P,Krug KB,Dietzel M.Evidence-based and structured diagnosis in breast MRI using the Kaiser score[J/OL]. Rofo, 2022 [2022-05-30]. https://www.thieme-connect.com.DOI:10.1055/a-1829-5985.
[17] Dietzel M, Baltzer PAT. How to use the Kaiser score as a clinical decision rule for diagnosis in multiparametric breast MRI: a pictorial essay[J].Insights Imaging,2018,9(3):325-335.DOI:10.1007/s13244-018-0611-8.
[18] Marino MA,Clauser P,Woitek R,et al.A simple scoring system for breast MRI interpretation: does it compensate for reader experience?[J]. Eur Radiol,2016,26(8):2529-2537.DOI:10.1007/s00330-015-4075-7.
[19] Istomin A, Masarwah A, Vanninen R, et al. Diagnostic performance of the Kaiser score for characterizing lesions on breast MRI with comparison to a multiparametric classification system[J/OL]. Eur J Radiol, 2021[2022-05-30].https://doi.org/10.1016/j.ejrad.2021.109659.DOI:10.1016/j.ejrad.2021.109659.
[20] Rong X, Kang Y, Xue J, et al. Value of contrast-enhanced mammography combined with the Kaiser score for clinical decision-making regarding tomosynthesis BI-RADS 4A lesions[J/OL]. Eur Radiol, 2022 [2022-05-30].https://doi.org/10.1007/s00330-022-08810-7.DOI:10.1007/s00330-022-08810-7.
[21] Wang S,Li JY,Zheng H,et al.Analysis on Kaiser sore in diagnostic value of BI-RADS 4 types of breast non-masses enhancement[J]. J Clin Radiol,2021,40(12):2282-2286.DOI:10.13437/j.cnki.jcr.2021.12.010.王珊,李建玉,郑慧,等.Kaiser评分对乳腺BI-RADS 4类非肿块样强化病灶的诊断价值分析[J].临床放射学杂志,2021,40(12):2282-2286.DOI:10.13437/j.cnki.jcr.2021.12.010.
[22] Jajodia A, Sindhwani G, Pasricha S, et al. Application of the Kaiser score to increase diagnostic accuracy in equivocal lesions on diagnostic mammograms referred for MR mammography[J/OL]. Eur J Radiol,2021[2022-05-30].https://doi.org.10.1016/j.ejrad.2020.109413.DOI:10.1016/j.ejrad.2020.109413.
[23] Telegrafo M, Rella L, Stabile Ianora AA, et al. Effect of background parenchymal enhancement on breast cancer detection with magnetic resonance imaging[J]. Diagn Interv Imaging, 2016, 97(3): 315-320.DOI:10.1016/j.diii.2015.12.006.
[24] Jung Y, Jeong S, Kim JY, et al. Correlations of female hormone levels with background parenchymal enhancement and apparent diffusion coefficient values in premenopausal breast cancer patients: effects on cancer visibility[J/OL]. Eur J Radiol, 2020 [2022-05-30]. https://doi.org/10.1016/j.ejrad.2020.108818.DOI:10.1016/j.ejrad.2020.108818.
[25] Zhang H, Guo LL, Tao WJ, et al. Possible breast cancer risk related to background parenchymal enhancement at breast MRI: a meta-analysis study[J].Nutr Cancer,2021,73(8):1371-1377.DOI:10.1080/01635581.2020.1795211.
[26] Zhang B, Feng LL, Wang L, et al. Kaiser score for diagnosis of breast lesions presenting as non-mass enhancement on MRI[J]. Nan Fang Yi Ke Da Xue Xue Bao,2020,40(4):562-566.DOI:10.12122/j.issn.1673-4254.2020.04.18.
[27] Nadrljanski MM, Marković BB, Milošević ZČ. Breast ductal carcinoma in situ: morphologic and kinetic MRI findings[J]. Iran J Radiol,2013,10(2):99-102.DOI:10.5812/iranjradiol.4876.
[28] Lee JM, Ichikawa L, Valencia E, et al. Performance benchmarks for screening breast MR imaging in community practice[J]. Radiology,2017,285(1):44-52.DOI:10.1148/radiol.2017162033.
[29] Dietzel M, Krug B, Clauser P, et al. A multicentric comparison of apparent diffusion coefficient mapping and the Kaiser score in the assessment of breast lesions[J]. Invest Radiol, 2021, 56(5): 274-282.DOI:10.1097/RLI.0000000000000739.019-06444-w.

