Ficolin通过激活补体加重poly(I:C)联合LPS诱导的急性肺脏损伤①
胡子琪 吴 旭 姚朵朵 李燕秀 孙志夫 王 玺 张须龙
(首都医科大学基础医学院免疫学系,北京 100069)
下呼吸道感染是导致全球全年龄段人类发病和死亡的主要原因,严重威胁人类健康[1]。在呼吸道感染病原体中,流感病毒、呼吸道合胞病毒、鼻病毒等RNA病毒感染后易继发细菌感染,引起重症肺炎和肺脏免疫损伤,是呼吸道病毒感染流行期间导致死亡的主要原因[2-4]。继发细菌感染引起的免疫病理损伤是重症肺炎的重要原因,但其中的免疫致病机制尚不完全清楚。
由天然免疫细胞和天然免疫分子介导的天然免疫应答是宿主抵御病原体感染的第一道防线[5]。补体作为机体重要的天然免疫分子,可通过经典途径、凝集素途径和旁路途径活化,在天然免疫和适应性免疫应答中发挥不可或缺的作用,可通过直接裂解、调理作用、促进吞噬细胞浸润和放大T/B细胞反应等介导抗感染免疫应答,其中补体C3是补体活化的核心,可通过酶解形成多种免疫分子调节免疫应答[6]。甘露糖结合凝集素(mannose-binding lectin,MBL)、ficolin和collectin-10/11是启动凝集素途径的关键模式识别分子,在抗感染免疫应答早期发挥关键作用[7-9]。其中ficolin是由C端球形糖类识别功能区、中间α卷曲螺旋区和N端胶原样区组成,人类体内 存 在M-ficolin、L-ficolin和H-ficolin三 种类型,小鼠体内存在ficolin A和ficolin B两种类型[10]。Ficolin具有肺脏持续高表达、血清浓度远高于MBL、可识别多种配体等特点,在抗呼吸道感染中发挥重要作用,且ficolin缺失易导致肺脏反复感染[11]。Ficolin在病毒继发细菌感染中的作用及机制尚未明确,深入探讨其作用有助于阐明其致病机制并寻找潜在治疗靶点。
RNA病毒感染靶细胞后,会在复制和转录时形成双链RNA(double-stranded RNA,dsRNA),它是重要的病原体相关分子模式(pathogen associated molecular patterns,PAMPs),可通过模式识别受体(pattern recognition receptors,PRRs)激活天然免疫应答介导炎症反应[12]。Poly(I:C)是一种人工合成的dsRNA类似物,广泛用于模拟RNA病毒感染的各类实验研究[13-14]。本研究通过革兰氏阴性菌来源的内毒素LPS刺激poly(I:C)预处理的小鼠,模拟RNA病毒继发细菌感染的急性加重模型,并探讨ficolin在RNA病毒继发细菌感染急性加重肺损伤的作用及机制,为继发细菌感染的治疗提供新的思路和方法。
1 材料与方法
1.1 材料
1.1.1 实验动物6~8周龄SPF级C57BL/6小鼠和ficolin基因敲除小鼠由首都医科大学和苏州赛业公司提供,并经首都医科大学动物部伦理管理委员会批准(批准号:AEEI-2018-090)。
1.1.2 实验细胞RAW264.7细胞系购于武汉普诺赛生命科技有限公司。
1.1.3 试剂和仪器Poly(I:C)和LPS购于美国Sigma-Aldrich公司;抗C3单克隆抗体购于英国Abcam公司;抗β-actin单克隆抗体、抗tubulin单克隆抗体、HRP标记的羊抗兔IgG抗体购于美国CST公司;胎牛血清、DMEM培养液购于美国Thermo Fisher公司;胶原酶Ⅰ购于美国Sigma公司;BB515-rat anti-mouse CD45、BUV737-rat anti-mouse CD11b、BUV395-rat anti-mouse Ly6G、BV421-rat anti-mouse F4/80、BV650-rat anti-mouse MHCⅡ、AF700-rat antimouse Ly6C、FVS510染料、CD16/CD32封闭液、FACSymphony流式细胞仪、FlowJo V10流式分析软件购于美国BD公司;全自动切片扫描仪Pannoramic Scan购于匈牙利3DHIESTECH公司;AI600超灵敏化学发光成像仪购于美国GE公司。
1.2 方法
1.2.1 Poly(I:C)联合LPS刺激小鼠模型的建立6~8周龄SPF级C57BL/6小鼠和ficolin基因敲除小鼠随机分为PBS组、poly(I:C)组、LPS组以及poly(I:C)和LPS联合刺激组。通过异氟烷或乙醚麻醉,联合刺激组小鼠于造模第1天和第2天分别滴鼻给予25µl含50µg的poly(I:C),于造模第3天滴鼻给予25µl含50µg的LPS;poly(I:C)组和LPS组小鼠仅滴鼻给予等量poly(I:C)或LPS,其余进行等量PBS处理;PBS组小鼠于造模3 d滴鼻给予等量的PBS。在造模第5天处死小鼠取其肺脏组织进行检测。
1.2.2 Poly(I:C)联合LPS刺激RAW264.7细胞模型的建立将RAW264.7细胞于DMEM完全培养基中37℃、5%CO2培养至对数期,在12孔板中以1×106个/孔的密度接种,分为PBS组、poly(I:C)组、LPS组以及poly(I:C)联合LPS刺激组,每组3个复孔;50µg/ml的poly(I:C)或等量PBS处理18 h后,联合50 ng/ml LPS或等量PBS刺激6 h,收集RAW264.7细胞用于后续实验。
1.2.3 Western blot检测C3蛋白的表达取各刺激或对照组小鼠肺脏组织进行剪碎研磨,以及收取各处理或对照组RAW264.7细胞样本,采用RIPA蛋白裂解法提取组织或细胞中的总蛋白,冰浴30 min后,12 000 r/min、4℃离心15 min,收集上清液。采用BCA法测定蛋白浓度,并稀释所有蛋白样本为相同浓度,99℃加热5 min蛋白质变性后,进行SDSPAGE电泳分离,然后转膜至甲醇预浸泡过的PVDF膜,5%脱脂奶粉封闭液室温封闭2 h后加入相应一抗4℃孵育过夜,TBST洗膜后,加入相应的二抗室温孵育1 h,TBST洗膜后,使用ECL显色液于AI600超灵敏化学发光成像仪进行扫描。
1.2.4 肺脏组织HE染色将各刺激或对照组小鼠肺脏组织置入4%多聚甲醛溶液中固定,石蜡包埋,切片用于常规HE染色。石蜡切片烘烤40 min,常规脱蜡水化,苏木精复染4 min,盐酸乙醇分化2 s,返蓝30~40 min,伊红染色2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片后,使用病理切片扫描仪进行图像收集。
1.2.5 中性粒细胞和巨噬细胞流式检测取各刺激或对照组小鼠肺脏组织剪碎后于消化液(每5 ml消化液由4.25 ml DMEM培养基、500µl胶原酶Ⅰ、250µl胎牛血清组成)中37℃消化1 h,于70µm细胞筛网上轻柔研磨过滤得到肺组织细胞悬液,1 500 r/min、4℃离心10 min,加入红细胞裂解液室温避光5 min,PBS稀释后再次通过70µm细胞筛网过滤,PBS洗涤2次,加入FVS510染料,室温避光孵育15 min,洗涤1次,依次加入封闭液、BB515-rat anti-mouse CD45、BUV737-rat anti-mouse CD11b、BUV395-rat anti-mouse Ly6G、BV421-rat anti-mouse F4/80、BV650-rat anti-mouse MHCⅡ和AF700-rat anti-mouse Ly6C荧光标记流式抗体,4℃避光孵育30 min,PBS洗涤2次后于流式细胞仪检测,FlowJo V10软件分析每组小鼠中性粒细胞、肺泡巨噬细胞和间质巨噬细胞的比例。
1.3 统计学处理数据统计分析使用GraphPad Prism 8.0软件。两组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 LPS加重poly(I:C)预刺激的小鼠肺脏损伤如图1A所示,在第1、2天连续用50µg poly(I:C)预刺激,在第3天用50µg LPS滴鼻刺激建立小鼠联合刺激模型。相较于未刺激和单独刺激对照组,联合刺激组小鼠驼背姿势、竖毛现象更明显,呼吸加快以及活动度更低。在刺激第5天小鼠肺组织病理表现为:PBS组小鼠肺泡结构正常,无炎症细胞浸润和出血,poly(I:C)或LPS单独刺激组小鼠肺组织支气管腔和血管腔周围可见少量炎症细胞浸润,腔内有较少出血,肺泡少量融合;而在联合刺激组中,可见肺泡融合和弥漫性损伤,大量炎症细胞浸润于支气管和血管周围,支气管腔内充血渗出,病理损伤加重(图1B)。上述结果表明LPS加重poly(I:C)预刺激的小鼠肺脏损伤,模型建立成功。
2.2 中性粒细胞和巨噬细胞招募参与LPS诱导的poly(I:C)预刺激的急性肺脏损伤取肺组织单个细胞悬液,采用流式细胞术检测各处理组和对照组中性粒细胞、间质巨噬细胞和肺泡巨噬细胞的比例变化。结果显示,相较于PBS组,poly(I:C)、LPS单独刺激组和联合刺激组第5天,小鼠肺脏中性粒细胞(CD45+CD11b+Ly6G+)比例分别由2.4%升高至11.1%、15.3%和19.8%(图2A),间质巨噬细胞(CD45+CD11b+Ly6G-F4/80+MHCⅡ+Ly6C+)比例分别由3.0%升高至13.2%、22.8%和30.1%(图2B),而肺泡巨噬细胞(CD45+CD11b-Ly6G-F4/80+)比例由原来的11.8%分别降低至6.4%、4.0%和3.5%(图2C)。上述结果表明,poly(I:C)和LPS联合刺激诱导大量中性粒细胞和间质巨噬细胞浸润为主,并存在肺泡巨噬细胞耗竭,提示中性粒细胞和巨噬细胞大量招募参与poly(I:C)联合LPS刺激诱导的急性肺脏损伤。
2.3 Poly(I:C)和LPS联合刺激诱导补体C3活化通过Western blot检测小鼠肺脏组织和巨噬细胞系中补体C3蛋白的酶解变化。体内实验结果显示,相较于PBS组,联合刺激组小鼠肺脏总C3蛋白表达增加,并且C3活化裂解后产生的α链、iC3b片段和C3c片段也明显增多(图3A)。体外实验对RAW264.7细胞系进行poly(I:C)和/或LPS刺激。相较于PBS组,联合刺激同样诱导巨噬细胞总C3蛋白水平和活化裂解产生的C3c片段增加(图3B)。提示poly(I:C)联合LPS刺激可诱导补体C3的表达和活化增加。
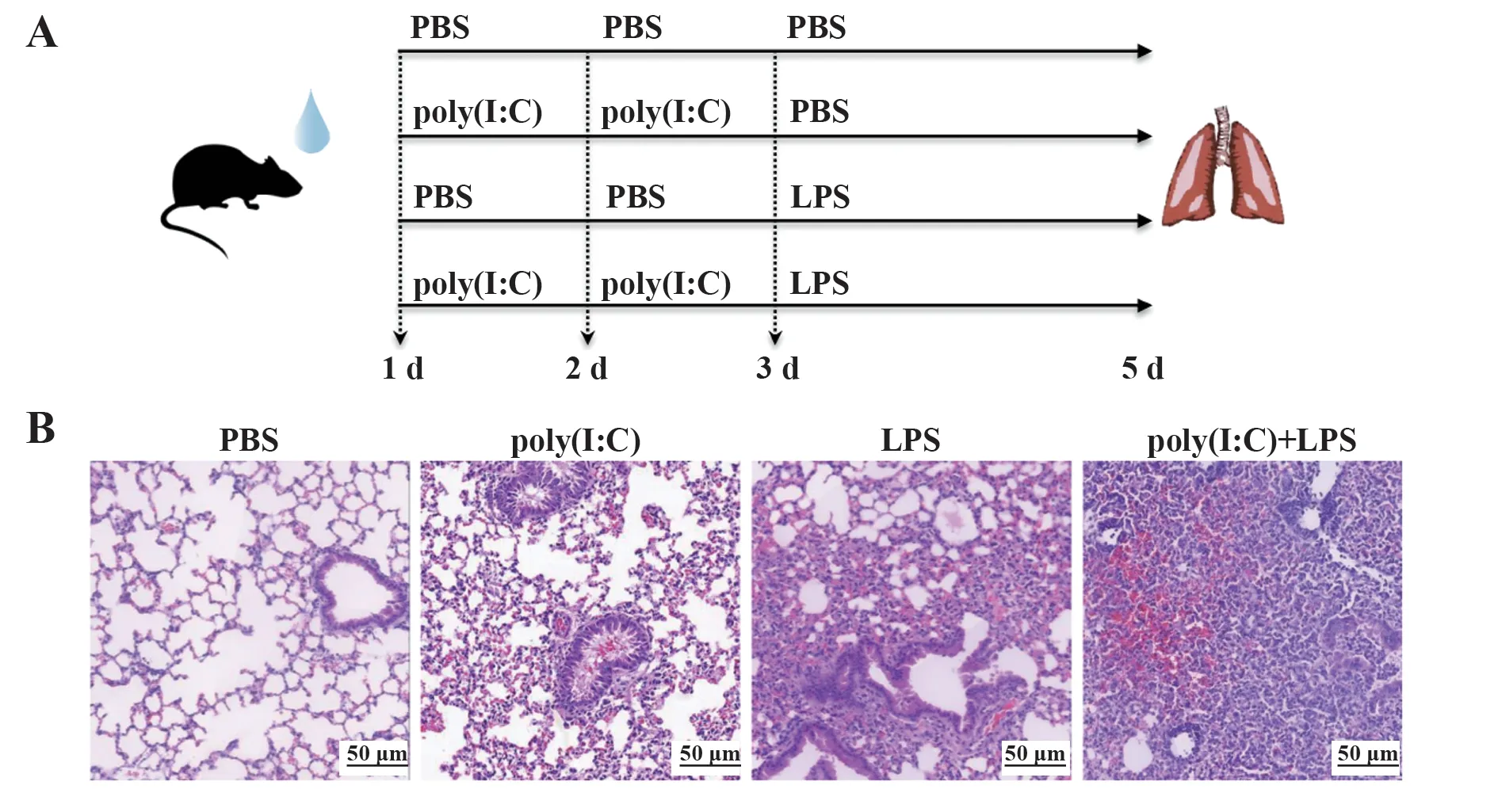
图1 Poly(I:C)联合LPS刺激加重肺脏组织病理变化Fig.1 Poly(I:C)combined with LPS stimulation aggravated lung tissue pathological changes
2.4 Ficolin参与介导poly(I:C)联合LPS刺激诱导的补体C3活化通过Western blot检测ficolin敲除小鼠联合刺激后肺脏补体C3蛋白的表达和活化变化。结果显示,在PBS组,Fcna-/-和Fcnb-/-小鼠的C3蛋白表达和活化较野生型小鼠无明显差异(图4);而在poly(I:C)联合LPS刺激组,Fcna-/-和Fcnb-/-小鼠的总C3蛋白表达和活化后产生的片段较野生型小鼠均明显降低(图4)。提示ficolin可能参与联合刺激诱导的小鼠肺脏补体C3活化。
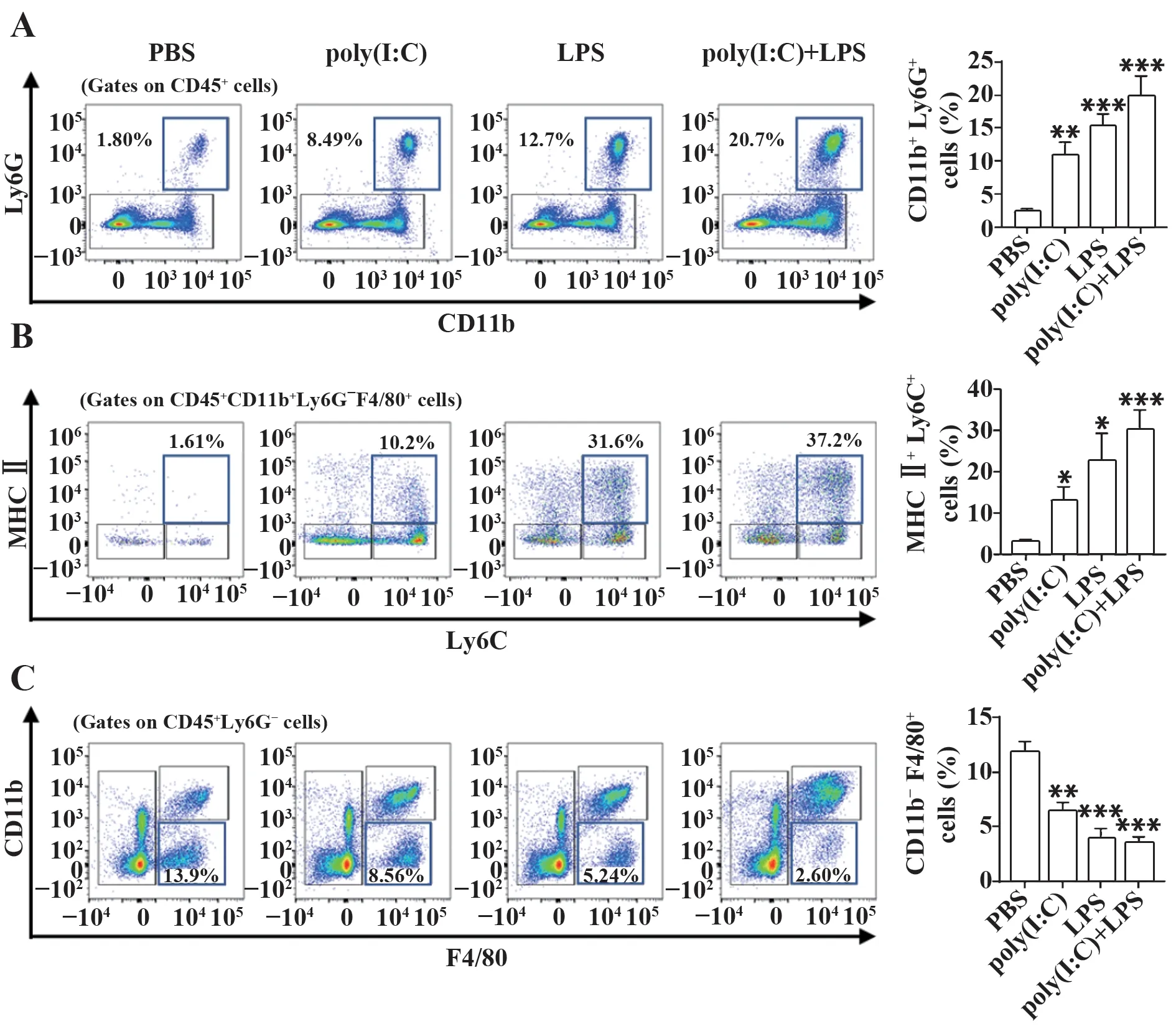
图2 Poly(I:C)联合LPS刺激大量招募中性粒细胞和巨噬细胞,并诱导肺泡巨噬细胞耗竭Fig.2 Poly(I:C)combined with LPS stimulation recruits in large numbers of neutrophils and macrophages and induces exhaustion of alveolar macrophages
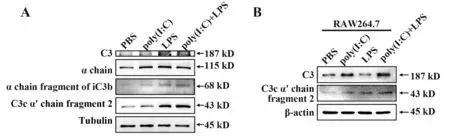
图3 Poly(I:C)联合LPS刺激诱导补体C3表达和活化增加Fig.3 Poly(I:C)combined with LPS stimulation induces increased expression and activation of complement C3
2.5 敲除ficolin缓解poly(I:C)联合LPS刺激诱导的急性肺损伤进一步利用Fcna-/-和Fcnb-/-小鼠研究ficolin在poly(I:C)联合LPS刺激诱导小鼠肺脏损伤中的作用。在PBS对照组,ficolin敲除小鼠和野生型小鼠的肺组织病理学变化均无明显差异,但在poly(I:C)单独或联合LPS刺激组,Fcna-/-和Fcnb-/-小鼠较野生型小鼠肺内支气管和血管周围炎症细胞浸润减少,肺泡融合和弥漫性损伤减轻,支气管腔内出血及病理损伤程度明显减轻(图5)。提示ficolin通过激活补体参与poly(I:C)联合LPS刺激诱导的小鼠急性肺损伤。
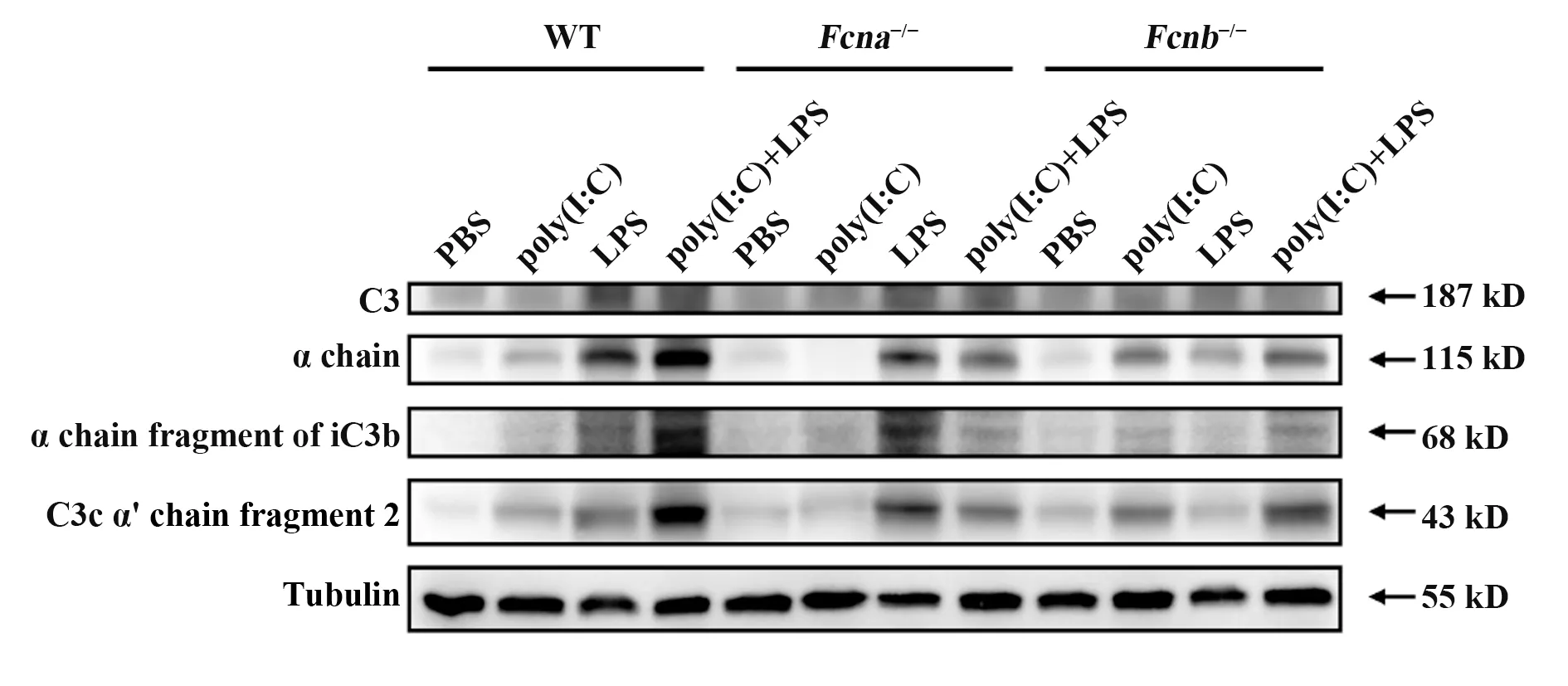
图4 敲除ficolin降低poly(I:C)联合LPS刺激诱导的补体C3活化Fig.4 Knockout of ficolin reduces activation of complement C3 induced by poly(I:C)combined with LPS stimulation
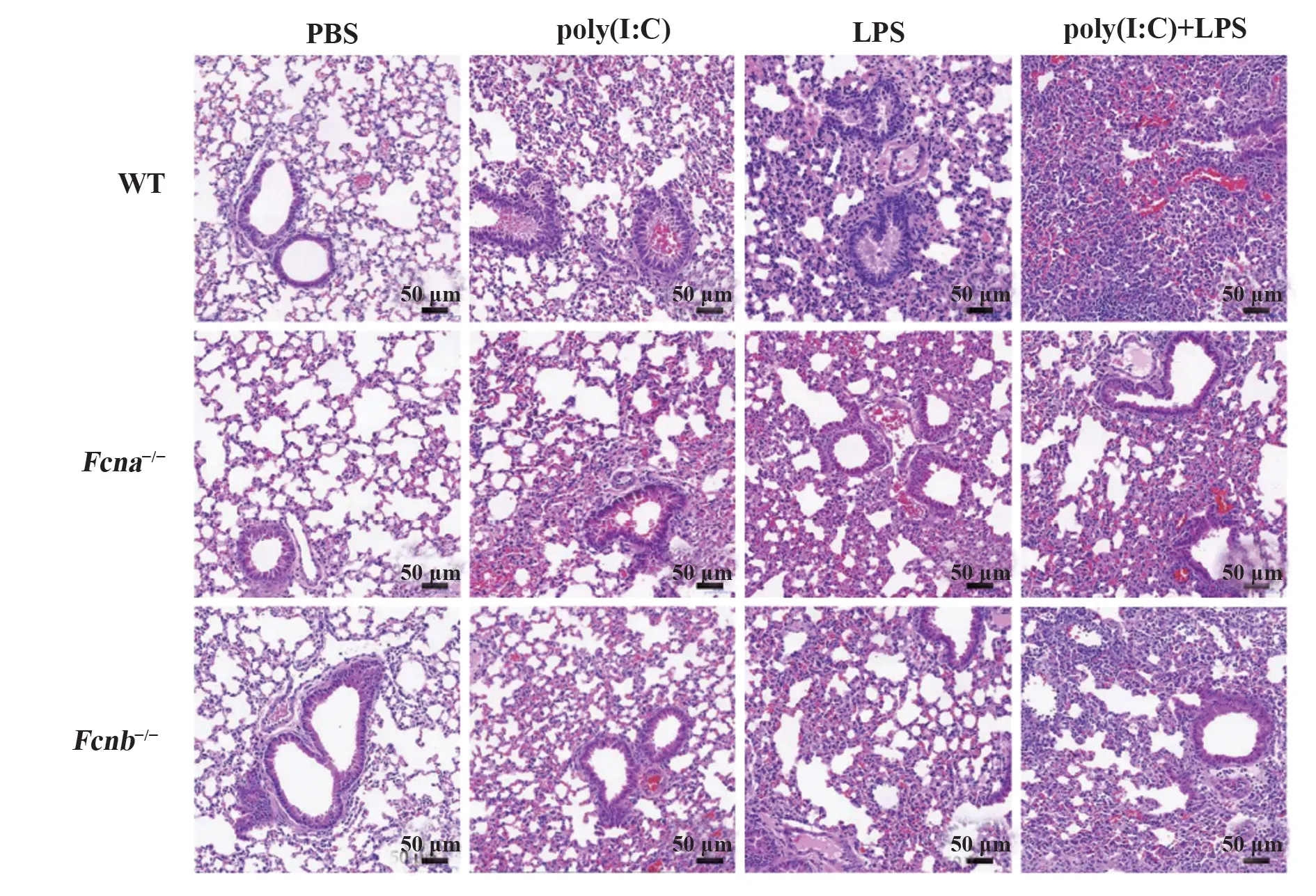
图5 Ficolin敲除对poly(I:C)联合LPS刺激后肺组织病理变化的影响Fig.5 Effect of ficolin knockout on pathological changes of lung tissue after poly(I:C)combined with LPS stimulation
2.6 敲除ficolin缓解poly(I:C)联合LPS刺激诱导的间质巨噬细胞募集和肺泡巨噬细胞耗竭利用Fcna-/-和Fcnb-/-小鼠研究ficolin在poly(I:C)联合LPS刺激对小鼠肺脏中性粒细胞、间质巨噬细胞和肺泡巨噬细胞的变化影响。结果显示,在联合刺激后第5天,ficolin敲除小鼠和野生型小鼠肺脏中性粒细胞的比例变化无显著差异(图6A);Fcna-/-和Fcnb-/-小鼠相较于野生型小鼠,间质巨噬细胞比例由33.9%分别降低至10.7%和16.1%(图6B),而肺泡巨噬细胞比例由3.81%分别升高至5.93%和5.97%(图6C)。提示ficolin参与poly(I:C)和LPS联合刺激中间质巨噬细胞的募集和肺泡巨噬细胞的耗竭。
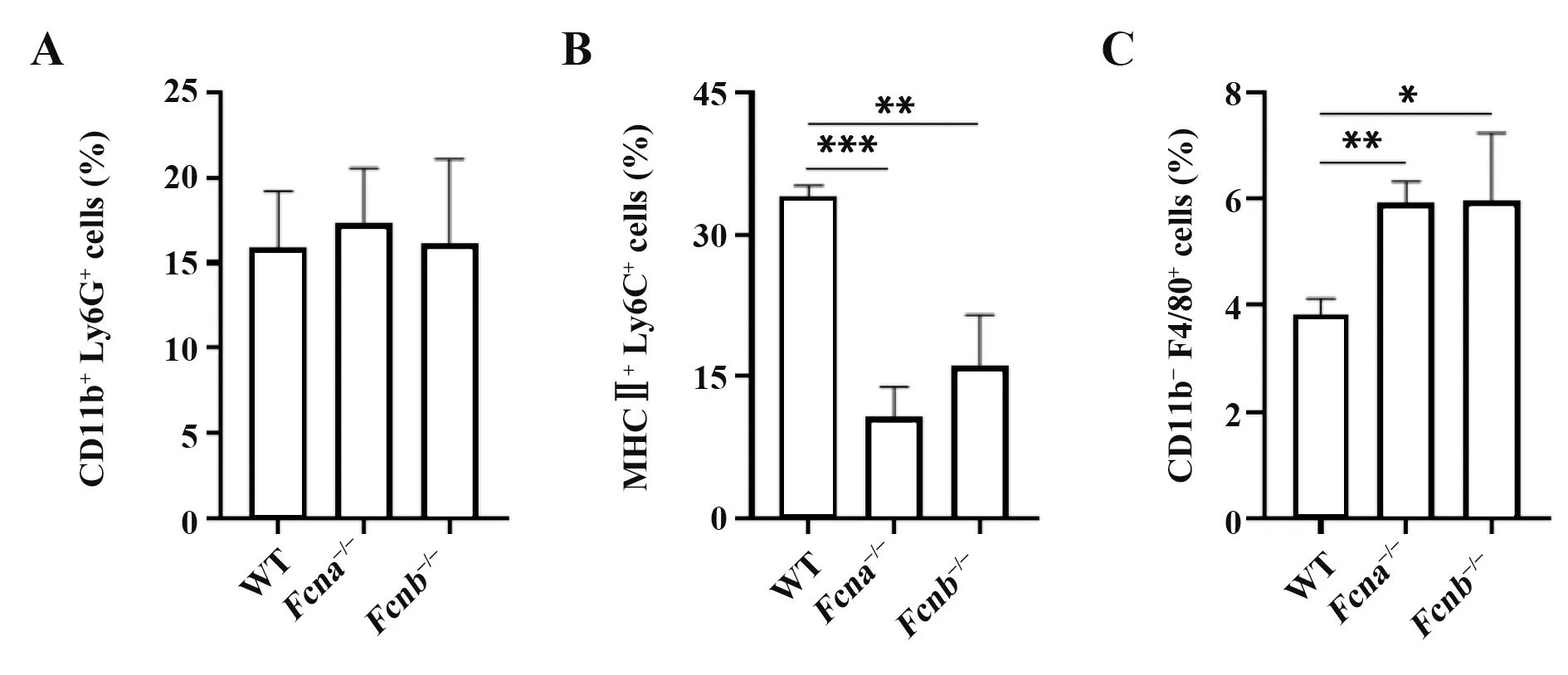
图6 Ficolin敲除对poly(I:C)联合LPS刺激后肺脏中性粒细胞和巨噬细胞比例的影响Fig.6 Effect of ficolin knockout on proportions of neutrophils and macrophages in lung after poly(I:C)combined with LPS stimulation
3 讨论
呼吸道病毒感染严重威胁人类健康,而病毒感染后继发细菌感染是导致肺脏急性损伤加重和病死率升高的重要因素之一,其中的免疫学机制尚不完全清楚,尤其是补体ficolin是否参与病毒继发细菌感染诱导的急性肺损伤还未有研究阐明。深入探究联合感染损伤加重的发生机制,有利于寻找潜在的治疗靶点,从而缓解病毒继发细菌感染诱导的急性肺损伤并降低致死率[15]。
RNA病毒侵入靶细胞后形成的dsRNA可作为主要的PAMPs与靶细胞内的PRRs结合,如Toll样受体3(TLR3)或视黄酸诱导基因(RIG-Ⅰ),诱导下游信号通路的激活和促炎细胞因子/趋化因子的分泌[16]。继发细菌感染后,革兰氏阴性菌主要致病物质LPS可激活TLR4,同样引起下游信号转导及促炎因子分泌[17]。目前用不同病毒和细菌建立各种组合感染的模型比较困难,并且之前已有研究证明通过使用病毒RNA模拟物poly(I:C)激活抗病毒免疫反应足以对宿主抗细菌免疫应答产生影响[13]。而且poly(I:C)联合LPS刺激导致的肺脏病理变化与流感病毒继发细菌感染相似,如肺损伤面积增多,肺泡广泛萎缩,并伴有明显的炎症细胞浸润[18]。因此,本实验通过滴鼻poly(I:C)和革兰氏阴性菌的内毒素LPS模拟病毒继发细菌感染所诱导的急性肺脏损伤,并进一步探究其中的免疫学发病机制。
本研究建立了LPS诱导的poly(I:C)预刺激的小鼠急性肺脏损伤模型,证实联合刺激组小鼠肺脏病理较PBS组和单独刺激组小鼠加重,发现联合刺激大量招募中性粒细胞和间质巨噬细胞进入肺脏,证实联合刺激明显诱导小鼠肺脏和RAW264.7细胞中补体C3的表达与酶解活化,并进一步发现补体ficolin在此模型中可能介导C3的活化,敲除ficolin明显减轻联合刺激诱导的小鼠肺脏病理损伤,以及降低间质巨噬细胞的募集和肺泡巨噬细胞的耗竭。提示ficolin通过激活补体参与poly(I:C)联合LPS刺激诱导的急性肺损伤。
既往研究发现ficolin在单独病毒或细菌感染中都发挥作用,并且ficolin能增强IL-1、IL-6、TNF-α等促炎因子和CXCL1/2/10、CCL14等趋化因子的表达,并抑制抗炎细胞因子IL-10的表达,导致炎症反应加重[19-22],而目前仍未有研究阐明ficolin在联合感染导致肺脏损伤加重中的作用及机制。本研究通过使用RNA病毒和革兰氏阴性菌相应的PAMPs模拟联合感染过程,初步阐明ficolin通过活化补体促进肺脏炎症反应以及促进间质巨噬细胞募集和肺泡巨噬细胞耗竭,从而加重肺脏免疫损伤,为呼吸道RNA病毒继发革兰氏阴性菌感染的预防和治疗提供潜在的干预靶点和新的方向。

