海水鱼类淀粉卵涡鞭虫病及其防控研究进展
李志成,钟志鸿,李诗钰,郭奕轩,郭庆凯,江飚,李安兴*
(1.中山大学 生命科学学院,广东省水生经济动物良种繁育重点实验室,广东 广州 510275; 2.仲恺农业工程学院 动物科技学院,广东 广州 510225)
海水鱼类淀粉卵涡鞭虫病是由眼点淀粉卵涡鞭虫Amyloodiniumocellatum感染而引起的寄生虫疾病[1]。 该病主要暴发于热带和亚热带地区,在中国、法国、印度、埃及和美国等地的海水养殖区均有发病报道,对养殖鱼类具有严重危害性[2-6]。鱼类感染眼点淀粉卵涡鞭虫后的典型症状为摄食量减少,呼吸频率加快,聚集于水面或氧气充足的区域。感染严重时,病鱼可在12 h内窒息死亡[7-8]。病鱼体表常分泌大量黏液,形成天鹅绒状的白斑,故淀粉卵涡鞭虫病又称“海水鱼天鹅绒病”[9]。淀粉卵涡鞭虫病常暴发于封闭的循环水养殖系统和水族馆中,该病已成为海水鱼类养殖的主要寄生虫病之一,给水产养殖业造成了巨大的经济损失[10]。
眼点淀粉卵涡鞭虫隶属于肉足鞭毛门Sarcomastigophora鞭毛亚门Mastigophora植鞭纲Phytomastigophora腰鞭目Dinoflagellida胚沟科Blastodinidae淀粉卵涡鞭虫属Amyloodinium[11]。该寄生虫于1931年被首次报道,Brown[1]发现,英国伦敦动物学会水族馆中养殖的海水观赏鱼类感染该寄生虫后大量死亡。起初,眼点淀粉卵涡鞭虫因形态与Chatton描述的Oodiniumpoucheti极其相似而被命名为“Oodiniumocellatum”(隶属于卵圆虫属),但通过对该虫体形态、结构和生物学特性的进一步观察发现,二者存在较大差异,Brown于1946年将其命名更正为“Amyloodiniumocellatum” (隶属于淀粉卵涡鞭虫属,为一新属),并沿用至今[12]。随后,越来越多的研究阐明了眼点淀粉卵涡鞭虫的生活史、形态结构、生活习性和宿主范围[13-15]。该寄生虫主要寄生于热带、亚热带海水鱼类的鳃、皮肤和鳍条等,是海水养殖鱼类中最常见的寄生虫之一,若条件适宜,几乎可以感染所有海水鱼类,已被列为重要的海洋鱼类病原[9,16-17]。本文全面综述了眼点淀粉卵涡鞭虫生活史、流行危害、诊断方法和防控措施等方面的研究进展,并提出未来研究和防控发展建议,以期为海水鱼类淀粉卵涡鞭虫病的科学防治提供有益参考。
1 生活史
眼点淀粉卵涡鞭虫生活史简单,为直接发育型,发育过程不需要中间宿主。眼点淀粉卵涡鞭虫生活史可分为滋养体、包囊和涡孢子3个阶段(图1),每个生命阶段均具有不同的形态和结构特征[18]。
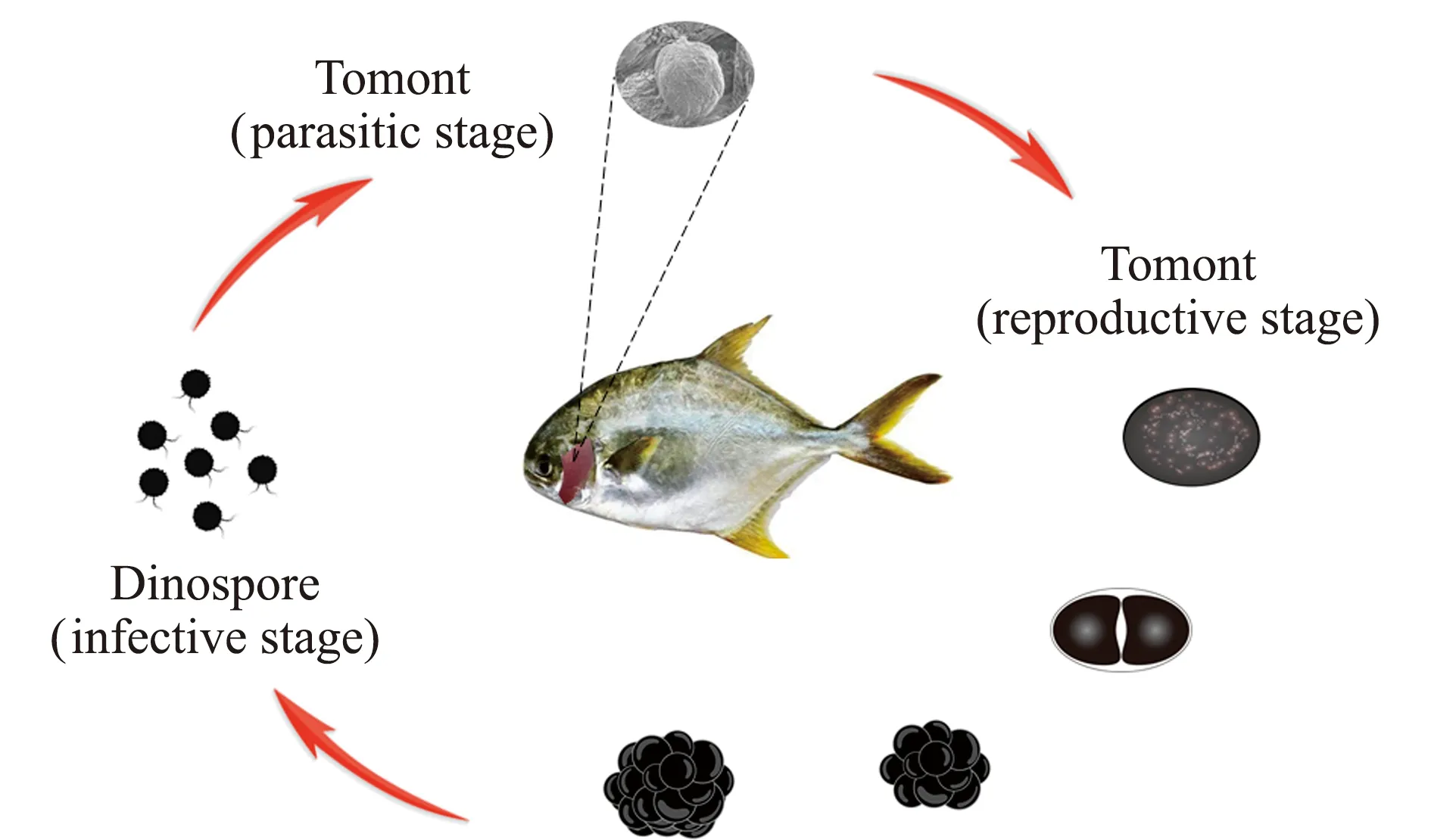
图1 眼点淀粉卵涡鞭虫生活史Fig.1 Life cycle of Amyloodinium ocellatum
滋养体为虫体唯一的寄生生活阶段,直径为20.0~120.0 μm[12]。滋养体发育初期呈梨形,发育成熟后逐渐变为球形,可通过假根附着于宿主的上皮细胞并获取营养(图2A),待发育成熟后滋养体缩回假根并从宿主脱落,沉到水底并发育形成包囊[9]。滋养体在不同宿主的寄生时间和发育大小存在差异[19]。在相同感染条件下,相比于云纹犬牙石首鱼Cynoscionnebulosus,滋养体在大西洋笛鲷Lutjanuscampechanus组织中寄生的时间更长。

A—病鱼鳃,红色箭头示寄生的滋养体;B—包囊,包囊处于分裂状态;C—涡孢子,lf—纵向鞭毛,tf—横向鞭毛。A—gill tissue of diseased fish,the red arrow showing the parasitic A.ocellatum trophonts; B—tomonts,tomonts which is in a split state; C—dinospores, lf—longitudinal flagellum, tf—transverse flagellum.图2 眼点淀粉卵涡鞭虫生活史各时期的电子显微镜观察结果[18]Fig.2 Scanning electron microscope observation of Amyloodinium ocellatum in different periods during life cycle [18]
包囊为分裂增殖阶段,包囊直径为61.3~112.7 μm[20]。滋养体从宿主脱落后假根逐渐收缩,并在表面分泌纤维质膜形成囊壁,发育形成包囊。包囊以均等二分裂的方式增殖并孵化出涡孢子(图2B)。包囊发育受温度影响较大,在23~27 ℃环境下包囊发育速度最快,在低于10 ℃时停止发育。一个发育成熟的包囊最多可分裂产生128个细胞,每个细胞孵化出2个涡孢子,即一个成熟的包囊可孵化出256个涡孢子[21]。
涡孢子为自由感染阶段,具有侵染能力,虫体直径为12.0~15.0 μm,具有一个眼点,拥有横沟、纵沟及两条鞭毛(图2C)。鞭毛是涡孢子的运动器官,其可通过鞭毛在水中自由游动寻找新的宿主进行寄生,完成一个生活史周期[14,22]。涡孢子从包囊孵化后,能保持较长时间的侵染能力,Bower等[16]发现,涡孢子在孵化4 d后仍具有较强的感染能力。涡孢子不具有保护性外壁且对化学药物敏感,故可针对此阶段虫体进行药物防控[23]。
在实验室条件下,研究人员为获得足够数量的包囊和涡孢子用于试验,可采用鱼体传代和细胞系体外传代2种方法。Bower等[16]在实验室条件下,用眼斑双锯鱼Amphiprionocellaris和杂交条纹鲈Moronesaxatilis×M.chrysops作为宿主,实现了眼点淀粉卵涡鞭虫的人工传代。Noga[24]于1987年首次成功使用孔雀花鳉Poeciliareticulata鳃细胞系实现了眼点淀粉卵涡鞭虫体外传代,且虫体体外感染时细胞病理和滋养体发育情况与鱼体体内感染相似。Oestmann等[25]用美国红鱼Sciaenopsocellatus背鳍细胞作为培养基,体外培养眼点淀粉卵涡鞭虫,并在体外连续培养了10个生活史周期。
2 流行与危害
2.1 宿主
眼点淀粉卵涡鞭虫为多宿主寄生虫,寄主范围广,是少数既可以感染硬骨鱼类又可以感染软骨鱼类的寄生虫之一[9,26]。有研究报道,该寄生虫可同时寄生于鱼体和其他体型较大的寄生虫上,如梅氏新本尼登虫Neobenedeniamelleni,表明眼点淀粉卵涡鞭虫能从非鱼类宿主中获得生长发育所需的营养物质[17]。自1931年在伦敦动物学会水族馆首次发现淀粉卵涡鞭虫病以来,海水鱼类淀粉卵涡鞭虫病先后在世界各地被报道(表1)。尤其在欧洲国家,淀粉卵涡鞭虫病已成为限制欧洲海水鱼池塘养殖的主要瓶颈[3,10]。海水鱼类淀粉卵涡鞭虫病在中国海水养殖业中也时有报道,如牙鲆Paralichthysolivaceus暴发淀粉卵涡鞭虫病,死亡率超过60%[27];大黄鱼Pseudosciaenacrocea暴发淀粉卵涡鞭虫病,若防治措施不当,死亡率可达100%[2];红鳍东方鲀Takifugurubripes严重感染眼点淀粉卵涡鞭虫时,死亡率为70%[28]。
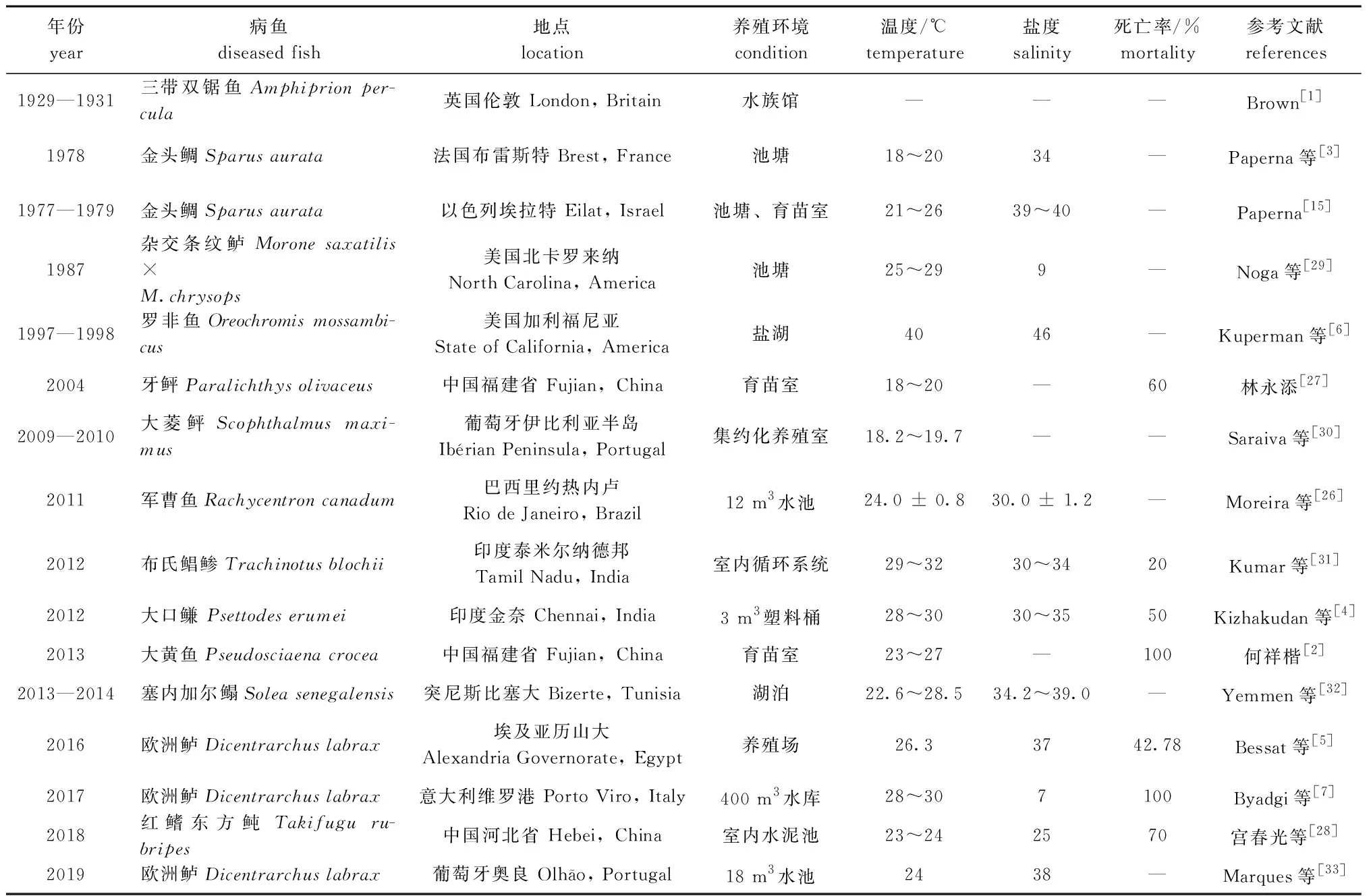
表1 海水鱼类淀粉卵涡鞭虫病的病例报道Tab.1 Reports of amyloodiniosis in marine fish
2.2 流行规律
当水温高于20 ℃ 时,养殖鱼类易暴发淀粉卵涡鞭虫病且死亡率较高[29,34]。淀粉卵涡鞭虫病主要暴发于室内封闭循环系统、池塘养殖等水体交换量小且养殖密度高的水体环境中[35]。在开放性湖泊、河口等水域中,野生鱼类虽然可被眼点淀粉卵涡鞭虫感染,但由于水体开放,鱼群密度低,不易造成大量感染,一般不会引起死亡[36]。随着高密度、工厂化和集约化养殖模式的建立及推广,该养殖环境更有利于眼点淀粉卵涡鞭虫的增殖和传播,淀粉卵涡鞭虫病将越发普遍,需引起高度重视。
包囊和涡孢子阶段是眼点淀粉卵涡鞭虫传播的主要时期。在室内工厂化养殖中,涡孢子可通过一些与水体直接接触的工具进行传播。鸟类、野生动物或其他陆生动物在不同的养殖系统间迁移的过程中,也可能携带受感染的水体而传播病原[9]。甚至有研究表明,眼点淀粉卵涡鞭虫涡孢子由于体积较小,可通过气溶胶进行传播[37]。另外,新引入的鱼种也具有携带病原的风险,需对新引进的鱼种进行消毒处理。死鱼是潜在的病原携带媒介,因为滋养体可从死鱼中脱落并在池底发育形成包囊。因此,尽快清除养殖系统中的死鱼,并定期清除池底的污染物,有助于减少水体中的虫体数量[1,9]。
迄今为止,世界各地流行的眼点淀粉卵涡鞭虫病原是否属于同一物种仍存在分歧。Levy等[38]对来自红海、地中海和墨西哥湾等海域的5株眼点淀粉卵涡鞭虫分离株的内部转录间隔区(ITS)进行序列分析,发现源于不同地区虫株的基因差异不大,所有分离株均为同一物种。然而,也有研究人员发现,不同地区分离株的环境耐受性存在差异,特别是对盐度的耐受性差异极大[18]。Noga等[29]在大西洋西部发现一株眼点淀粉卵涡鞭虫虫株,其涡孢子形态特征与之前报道的北卡罗来纳株存在明显差异。因此,目前并不能排除不同地区的菌株实际上是亚种或更低类群的可能性。
2.3 危害
当有少量眼点淀粉卵涡鞭虫寄生时,宿主不表现出任何病理变化,只有当虫体数量异常增多或宿主抵抗力下降时,宿主才表现出明显的患病症状,若处理不及时可引起宿主大量死亡,但不同鱼类对眼点淀粉卵涡鞭虫的易感性和耐受性存在差异[9,19,26]。
病鱼的鳃组织病变最为严重,鳃丝可明显看到滋养体寄生(图3),滋养体假根附着位点附近的上皮细胞出现浑浊肿胀,鳃上皮空泡变性[39];严重感染时,可见病鱼鳃组织上皮脱离、继发性片层融合、毛细血管扩张和黏液细胞增殖,局部鳃小片变短甚至消失,少量鳃小片根部融合[7,15]。研究发现,眼点淀粉卵涡鞭虫滋养体寄生可刺激宿主产生大量黏液,导致宿主鳃功能障碍,影响氧气交换效率而缺氧,从而在短期内造成养殖鱼类大量死亡,病鱼血清中的葡萄糖和甘油三酯浓度显著高于健康鱼(P<0.05)[40],表明病鱼处于慢性应激状态,需提高代谢以应对机体更高的能量需求。金头鲷Sparusaurata在感染眼点淀粉卵涡鞭虫18 h后,皮质醇和乳酸水平高于对照组,而鳃中的Na+/K+-ATP酶活性低于对照组[41]。重牙鲷Diplodussargus对眼点淀粉卵涡鞭虫感染所呈现的应激、血清指标和组织病理学反应与年龄大小相关,相比于发育成熟的重牙鲷(101.3 g±10.4 g),年幼的重牙鲷(50.0 g±5.1 g)应对眼点淀粉卵涡鞭虫感染时防御系统不够成熟,应激反应更加强烈[42]。

A—滋养体寄生导致鳃组织弥漫性病变(H.E染色);B—鳃组织上皮损伤、增生并在鳃小片之间形成腔隙,细胞浸润(H.E染色);C—滋养体寄生于口腔导致上皮损伤并增生(PAS-法阿尔新蓝染色);D—滋养体中的淀粉颗粒被染成红色,咽道上皮内有丰富的黏液细胞(PAS-法阿尔新蓝染色)。A—attached trophonts inducing severe and diffuse epithelial degeneration of lamellae(H.E staining); B—epithelial damage,hyperplasia with lacunae formation between lamellae,and cellular infiltrate(H.E staining); C—buccal cavity showing attached trophonts and epithelial damage with hyperplasia(Pas-Alcian blue staining); D—starch granules in A.ocellatum trophonts stained in red and very abundant mucous cells in the epithelium of pharyngeal tract(Pas-Alcian blue staining).图3 病鱼鳃组织病理学分析[7]Fig.3 Pathological analysis of gill from diseased fish[7]
3 诊断
对病原进行准确的鉴定,是有效控制疾病的前提。淀粉卵涡鞭虫病具有较高的发病率和死亡率,严重感染时可导致宿主急性死亡[7-8]。因此,对病鱼患病初期的及时诊断具有重要意义。目前,生产过程中常应用临床症状观察、显微镜观察和分子生物学等方法进行病鱼诊断。
3.1 临床症状
临床症状观察是最直接、最基本的诊断方法。眼点淀粉卵涡鞭虫具有广泛的致病性,当有少量虫体寄生时,病鱼不会表现出病理特征,往往难以察觉。当严重感染时,病鱼体色变暗,体表黏液分泌增多,食欲下降,喜欢聚集在水体上层或者含溶解氧较多的水域,依靠在附着物上不断摩擦身体,痉挛性喘息或不协调地游动(图4)。在光线照射下,可以看到病鱼皮肤附着有大量天鹅绒状的白色颗粒物质。感染严重的病鱼鳃丝发白甚至腐烂,鱼体因呼吸困难最终缺氧死亡[4,33,43]。通过对病鱼临床症状观察可做出初步诊断,为确诊提供必要的线索。需要注意的是,病鱼临床症状观察并不能有效确诊,存在误诊的风险。如临床症状诊断时常将海水鱼类淀粉卵涡鞭虫病与刺激隐核虫病混淆[44]。
3.2 显微镜观察
淀粉卵涡鞭虫病的确诊需基于临床症状和镜检相结合,当发现养殖鱼类出现患病症状时,可采集病鱼的鳃丝、鳍条或体表黏液制成湿片,利用光学显微镜(40倍或100倍)观察,若观察到虫体呈梨形或球形黑色颗粒状且数量较多,则可确诊为淀粉卵涡鞭虫病[9](图5)。利用光学显微镜对患病鱼进行病原检测,在水产养殖中是一种简单、快速和低成本的有效方法。

A—寄生在鳃组织中的滋养体(红色箭头指示处); B—寄生在鳍条中的滋养体(红色箭头指示处)。A—the red arrow shows the parasitic A.ocellatum trophonts on the gills; B—the red arrow shows the parasitic A.ocellatum trophonts on the fins.图5 病鱼组织中眼点淀粉卵涡鞭虫滋养体寄生观察Fig.5 Microscopic observation of trophonts on diseased fish
3.3 分子生物学方法
目前,分子生物学检测技术已逐渐应用于水产养殖鱼类病原的早期检测,常用的分子检测方法有常规PCR、巢氏PCR、实时定量PCR(qPCR)和环介导等温扩增(LAMP)等[45]。如Levy等[38]针对眼点淀粉卵涡鞭虫的核糖体DNA区域,开发了一种敏感且特异的PCR检测方法,该方法可检测出眼点淀粉卵涡鞭虫生活史周期的任一阶段且特异性强,不受水体中浮游生物或鱼体鳃组织的影响。Picón-Camacho等[46]利用LAMP法建立了一种快速检测眼点淀粉卵涡鞭虫的分子诊断方法,该方法灵敏度显著高于常规PCR方法,可检测出水体中的单个包囊或滋养体且不受水体或鳃组织中抑制物质的影响。总而言之,分子生物学检测具有简便、快速和灵敏等特点,有助于水产养殖中眼点淀粉卵涡鞭虫感染的早期检测。
4 防治措施
预防和治疗鱼类寄生虫病的常用策略为切断虫体生活史周期以阻止其增殖和传播。目前,海水鱼类淀粉卵涡鞭虫病的防治策略主要包括物理防控、化学防控、免疫防控和生物防控4个方面,在实际生产中可根据养殖条件灵活采用不同的治疗措施。
4.1 物理防控
冲洗养殖系统和过滤水体中的包囊是物理防控海水鱼类淀粉卵涡鞭虫病的主要方式。此类方法在包囊未孵化出涡孢子之前将其清除,可减少水体中虫体的数量,达到减缓疾病的作用[47]。然而,该方法仅限于小型循环养殖系统,使用局限性较大。
4.2 化学防控
4.2.1 硫酸铜 硫酸铜是水产养殖中最常用的化学药物之一,在防控淀粉卵涡鞭虫病方面也颇为有效[23,48]。生产过程中,将患病鱼置于1 mg/L硫酸铜溶液中药浴4 h,可100%驱除鱼体上寄生的滋养体。虫体体外试验结果表明,涡孢子对硫酸铜十分敏感,用质量浓度为3.13、0.78、0.20 mg/L的硫酸铜溶液分别药浴处理10、30、60 min,均可100%杀灭涡孢子,而包囊对硫酸铜具有较强的耐受性,即使在质量浓度为100 mg/L的硫酸铜溶液中连续药浴,仍能继续发育,在利用硫酸铜治疗海水鱼类淀粉卵涡鞭虫病时,杀死水体中自由游动的涡孢子以切断其生活史是关键[49]。然而,养殖水体中过量的铜离子对水生生物具有毒害作用[50-51],且不同鱼类对硫酸铜的耐受性存在差异[52-53],因此,生产上需科学合理地使用硫酸铜防控淀粉卵涡鞭虫病,切不可盲目增加硫酸铜的使用剂量。
4.2.2 福尔马林 福尔马林(含体积分数为37%~40%的甲醛)具有较强的防腐杀虫能力,能使眼点淀粉卵涡鞭虫的蛋白质变性,可达到杀灭虫体、防治鱼病的目的[15,54]。Fajer-vila等[54]将感染眼点淀粉卵涡鞭虫的黑点圆鲀Sphoeroidesannulatus在质量浓度为 51 mg/L的福尔马林中药浴1 h,可显著减少病鱼皮肤和鳃上的寄生虫数量。Kizhakudan等[4]研究表明,使用100 mg/L福尔马林药浴病鱼1 h,间隔1 d后再次药浴病鱼1 h,可完全消除养殖环境中的虫体。
4.2.3 过氧化氢 过氧化氢是潜在的“绿色”治疗剂,相对于传统化学治疗剂,过氧化氢具有环保、毒性小等特点。当使用过氧化氢防控鱼病后,水体中残留的过氧化氢会降解为水和氧气,生成无毒性残留物排放到环境中[55-57]。Montgomery-Brock等[58]评估了过氧化氢控制马鲅Polydactylussexfilis淀粉卵涡鞭虫病的效果,结果显示,使用75 mg/L过氧化氢溶液浸泡病鱼30 min能有效减少滋养体数量,6 d后再次浸泡鱼体30 min,可完全消除鱼体和水体中的眼点淀粉卵涡鞭虫。过氧化氢具有较大的应用潜力,可以有效抵抗海水鱼类淀粉卵涡鞭虫病,并可替代常规化学治疗剂。
4.2.4 其他化学药物 除上述常用药物外,还有大量研究表明,氯喹、磷酸氯喹和3,N-甲基葡萄糖胺等化学药物对眼点淀粉卵涡鞭虫均具有一定的杀灭作用[31,59-60]。由于暂无有效的疫苗,在海水鱼类淀粉卵涡鞭虫病的防治过程中,化学药物浸泡仍是主要的防治方式(表2)。但化学药物在杀虫过程中对养殖鱼类的毒性较大,因此,寻找对鱼类安全性大、无药性残留、用药浓度小、效应快和成本低的药物,是当前鱼类养殖生产中亟待解决的问题。同时,眼点淀粉卵涡鞭虫包囊对化学药物具有较强的抗性,单次用药往往不能有效根除该疾病,需反复多次用药浸泡或化学药物浸泡后倒池处理,可有效控制海水养殖鱼类暴发淀粉卵涡鞭虫病。

表2 治疗淀粉卵涡鞭虫病的常用化学药物及其效果Tab.2 Common chemical drugs and their effects in the treatment of amyloodiniosis
4.3 免疫防控
在海水鱼类淀粉卵涡鞭虫病的防控方面,免疫防控比药物防控更加安全有效,大量学者开展了宿主应对眼点淀粉卵涡鞭虫的免疫应答研究(表3),虽取得一定成果,但目前仍处于试验阶段,未成功开发出商品化疫苗。Smith等[63]首次发现,奥尼罗非鱼Oreochromisaureus经涡孢子人工免疫后,可在血清中产生特异性抗体。Cobb等[64]以亚致死剂量的涡孢子反复多次感染白条双锯鱼Amphiprionfrenatus后,再次感染时,白条双锯鱼对眼点淀粉卵涡鞭虫产生明显的抵抗力。通过ELISA法检测病鱼血清时,发现病鱼的血清抗体效价升高,产生了特异性抗体[65]。对自然感染眼点淀粉卵涡鞭虫的海鲈血液样本进行分析,发现海鲈对眼点淀粉卵涡鞭虫产生了适应性免疫反应,暗示其对眼点淀粉卵涡鞭虫的二次感染具有抗性[66]。研究发现,免疫鱼血清抑制了涡孢子对细胞的感染能力,涡孢子在细胞培养液中运动减缓,细胞培养物中的涡孢子感染性与血清抗体效价成反比,且新鲜的血清比加热灭活的血清对涡孢子具有更强的抑制效果[67]。

表3 眼点淀粉卵涡鞭虫诱导鱼体产生的免疫反应Tab.3 The immune response in fish induced by Amyloodinium ocellatum
4.4 生物防控
生物防控是指利用某些生物的生活习性抑制特定有害生物的种群密度,使其危害减少[68]。目前,生物防控策略在海水鱼淀粉卵涡鞭虫病中研究较少。Oestmann等[69]研究发现,卤虫Artemiasalina能减少美国红鱼Sciaenopsocellatus养殖系统中的涡孢子数量,但卤虫吞食涡孢子的能力有限,难以应用于实际生产中。Zhong等[70]利用红罗非鱼Oreochromisniloticus×O.mossambicus杂食性的特点,将不易受刺激隐核虫感染的红罗非鱼与易受刺激隐核虫感染的卵形鲳鲹混合饲养,能有效减少水体中刺激隐核虫包囊数量,防止卵形鲳鲹被刺激隐核虫二次感染。Imsland等[71]将圆鳍鱼Cyclopteruslumpus和大西洋鲑Salmosalar混合饲养,利用圆鳍鱼捕食海虱Lepeophtheirussalmonis的特性,有效减少了海虱感染大西洋鲑的机率。目前,将对病原体易感性不同的养殖鱼类混合饲养,利用不易感鱼吞食病原体的特性,减少养殖水体中病原体数量,这种防控策略在海水鱼类淀粉卵涡鞭虫病生物防控中尚未见报道,但防控思路值得借鉴。
4.5 其他防控策略
除了物理防控、化学防控、免疫防控和生物防控策略外,还可通过在饲料中添加益生菌或益生元提高鱼体的先天免疫系统活力,以对抗眼点淀粉卵涡鞭虫的感染[72-73]。在日常养殖过程中还应加强养殖水体的管理、养殖工具定期消毒(防止各养殖系统病原的交叉传播)和鱼体日常检查等工作。
5 存在问题及展望
5.1 海水鱼类淀粉卵涡鞭虫病研究及防控中存在的问题
眼点淀粉卵涡鞭虫是热带、亚热带地区常见的海水鱼类寄生虫,环境适应性强,严重感染时可导致宿主迅速死亡。国内外学者对淀粉卵涡鞭虫病及其病原眼点淀粉卵涡鞭虫展开了大量研究,该寄生虫的生活史、形态结构、传播方式和流行情况已基本明确。然而,海水鱼类淀粉卵涡鞭虫病的研究和防控仍存在以下几方面的问题。
1)在淀粉卵涡鞭虫病的防控方面,目前仍以硫酸铜、福尔马林等常见杀虫药物为主,具有一定的效果,但长期使用该类化学药物会造成环境污染,不利于水产养殖业的可持续发展。
2)眼点淀粉卵涡鞭虫感染诱导宿主产生免疫反应的机制及鱼类免疫系统的调控机制研究相对滞后,导致疫苗研发困难。
3)关于眼点淀粉卵涡鞭虫的人工感染方法、包囊收集、包囊计数和涡孢子计数等缺乏标准化方法,不同科研工作者使用方法不一,误差较大。建立一套眼点淀粉卵涡鞭虫标准化感染模型,以及探寻更加高效的包囊收集和计数策略具有重要意义。
4)在眼点淀粉卵涡鞭虫生活史不同时期,涡孢子对化学药物敏感,容易杀灭,但包囊和滋养体对化学药物均具有较强的耐受性,导致单次用药往往难以消除疫病,需多次反复用药或长期用药。因此,探寻包囊和滋养体对化学药物的耐受机制,寻找能有效杀灭或清除水体包囊的方法是亟待解决的问题。
5)在海水鱼类淀粉卵涡鞭虫病研究过程中,为获得足够数量的包囊和涡孢子用于试验,需要利用活鱼作为宿主进行人工传代。该项工作成本较高,操作烦琐,为保证虫株不丢失,即使在不需要虫株用于试验时传代工作仍不能间断,造成时间和经济上的巨大浪费。
5.2 未来研究和防控展望
近几十年,世界对鱼类产品的需求激增,在当前渔业捕捞近乎饱和的情况下,水产养殖业将成为增加鱼类产量的主要方式。然而,水产养殖中的疾病问题是制约集约化水产养殖健康发展的主要障碍。在养殖密度高且水体交换量小的养殖环境中,眼点淀粉卵涡鞭虫可迅速增殖和传播,危害宿主。为有效防控海水鱼类淀粉卵涡鞭虫病,减少该病暴发造成的经济损失,需做到“管理预防为主、综合治理为要”。未来关于海水鱼类淀粉卵涡鞭虫病的研究和防控仍需加强以下几方面的工作:
1)科学养殖,优化养殖密度。根据眼点淀粉卵涡鞭虫的生活史特性,在高密度养殖环境下,虫株会迅速增殖,加快疫病暴发。因此,养殖过程中需做到科学养殖管理,合理控制鱼类养殖密度。
2)预防为主,加强病原检测。利用分子生物学手段加强对养殖环境中的病原检测,在疫病暴发之前提前预警,最大程度地减少疫病造成的经济损失。
3)探寻虫株低温保存策略。目前,在水产养殖中精原干细胞和胚胎干细胞均可实现低温冷冻保存,未来要积极探寻眼点淀粉卵涡鞭虫在滋养体阶段或包囊阶段的低温保存策略,为海水鱼类淀粉卵涡鞭虫病的研究提供便利。
4)积极探索宿主发病机制。淀粉卵涡鞭虫病发病机制与多种因素密切相关,目前发病机制不详,导致不能从根本上消除疫病。未来可通过转录组、代谢组等手段,阐明淀粉卵涡鞭虫病的发病机制,以拓宽对该病的认识。
5)筛选绿色且高效的杀虫药物。为有效防控海水鱼类淀粉卵涡鞭虫病,需积极探寻更加高效且绿色的杀虫药物,消除硫酸铜、福尔马林等常规化学药物治疗鱼病时危害环境的缺陷,保障水产养殖业的可持续发展。
6)加强疫苗研发的基础研究。目前,海水鱼类淀粉卵涡鞭虫病疫苗研究成果较少,且免疫机制尚不清楚。研发安全、高效的淀粉卵涡鞭虫病疫苗是防控海水鱼类淀粉卵涡鞭虫病的关键。因此,积极探寻眼点淀粉卵涡鞭虫寄生诱导鱼体产生的免疫调控机制、加快疫苗研发进程具有重要意义。

